A psoríase é doença inflamatória crônica da pele com predisposição genética e componente autoimune, frequentemente tratada com terapia biológica como os imunomoduladores.
ObjetivosNeste estudo, os autores avaliam a eficácia e a segurança de dois desses medicamentos ao longo de um período de tratamento de 52 semanas.
MétodosFoi conduzido estudo de coorte retrospectivo de dois centros, recrutando pacientes com psoríase moderada a grave que receberam guselcumabe ou risanquizumabe em clínicas dermatológicas por um mínimo de 52 semanas.
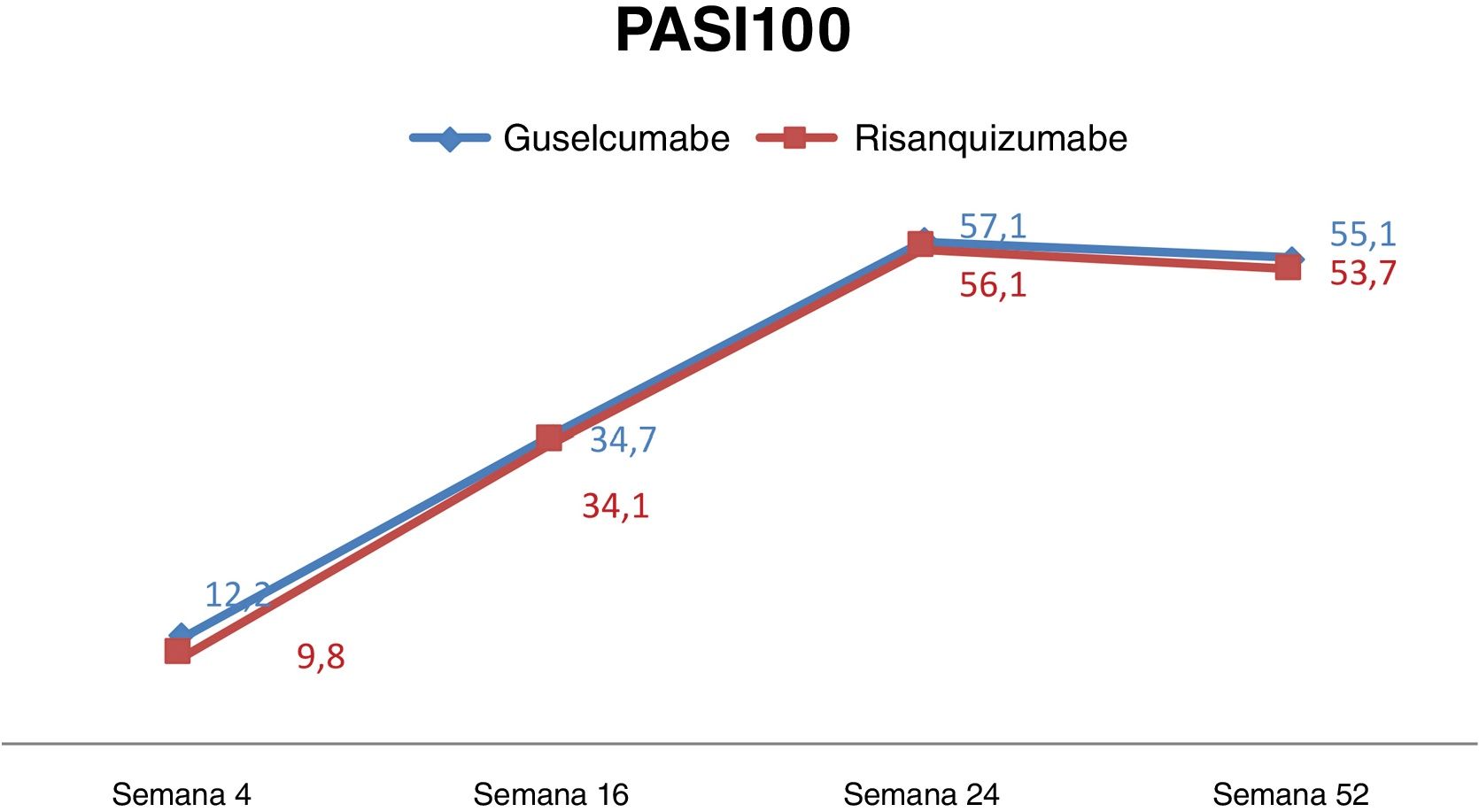
ResultadoDos 90 pacientes inscritos no estudo, 49 (54,4%) receberam guselcumabe, enquanto 41 (45,6%) receberam risanquizumabe. Em relação à eficiência da terapia, não houve diferença estatisticamente significante no PASI90 e PASI100 na semana 4 entre os dois grupos (p=0,428 e p=0,750, respectivamente). Na semana 16, as respostas PASI90 foram maiores no grupo guselcumabe (p=0,039). Entretanto, não houve diferença na resposta PASI100 na semana 16 (p=0,957). Nas semanas 24 e 52, as respostas PASI90 e PASI100 foram semelhantes em ambos os grupos. Os resultados do presente estudo demonstraram que tanto o guselcumabe quanto o risanquizumabe foram eficazes em pacientes que falharam anteriormente com outros biológicos. Os resultados clínicos nos grupos guselcumabe e risanquizumabe permaneceram inalterados durante tratamentos biológicos anteriores, incluindo anti‐TNF, anti‐IL‐17 e/ou anti‐IL‐12/23. Os tratamentos produziram resultados consistentes independentemente de fatores como obesidade, gênero e comorbidades.
Limitações do estudoO pequeno tamanho da amostra.
ConclusõesOs resultados do presente estudo demonstraram que tanto o guselcumabe quanto o risanquizumabe foram eficazes em pacientes que falharam anteriormente com outros biológicos. Os resultados clínicos nos grupos guselcumabe e risanquizumabe haviam permanecido inalterados durante tratamentos biológicos anteriores, incluindo anti‐TNF, anti‐IL‐17 e/ou anti‐IL‐12/23. Os tratamentos produziram resultados consistentes independentemente de fatores como obesidade, gênero e comorbidades.
A psoríase é doença inflamatória cutânea crônica com predisposição genética e componente autoimune, geralmente tratada com imunomoduladores, como terapias biológicas. A doença afeta principalmente a pele e as articulações, correlacionando‐se com várias comorbidades, particularmente condições cardiometabólicas.1,2 O progresso substancial no campo dos tratamentos biológicos levou ao desenvolvimento de uma nova categoria de anticorpos monoclonais humanos, guselcumabe e risanquizumabe, visando a subunidade p19da IL‐23, que recebeu aprovação da Food and Drug Administration (FDA) dos EUA em 2017 e 2019, respectivamente.2 Sua eficácia e segurança foram demonstradas em vários ensaios clínicos, incluindo VOYAGE‐1 e VOYAGE‐23,4 e ECLIPSE5 para guselcumabe, bem como UltIMMa‐1 e UltIMMa‐2,6IMMERGE7 e IMMVENT8 para risanquizumabe.
Estudos desenvolvidos na prática clínica são cruciais para verificar a eficácia e a segurança de produtos biológicos recentemente aprovados para psoríase em grupos mais diversos de pacientes, frequentemente excluídos dos ensaios clínicos. Informações sobre o uso prático desses dois agentes na psoríase estão sendo compartilhadas por meio do relato de dados da prática clínica em vários países. Apesar disso, dados comparando a eficácia e a segurança do guselcumabe e do risanquizumabe ainda são bastante limitados. Na literatura, Ruggiero et al. e Viopulus et al. compararam a eficácia e a segurança desses produtos biológicos e estabeleceram que ambos mostraram eficácia semelhante por 44 e 24 semanas, respectivamente.9,10 No presente estudo, foram avaliadas a eficácia e a segurança de ambos os medicamentos ao longo de um período de tratamento de 52 semanas.
Materiais e métodosFoi conduzido um estudo de coorte retrospectivo em dois centros, recrutando pacientes com psoríase moderada a grave que receberam guselcumabe ou risanquizumabe em clínicas dermatológicas de agosto de 2022 a março de 2023. Os critérios de inclusão compreenderam pacientes com mais de 18 anos, diagnosticados com psoríase moderada a grave e tratados com guselcumabe ou risanquizumabe por um mínimo de 52 semanas. Os pacientes tratados com guselcumabe receberam doses de 100mg nas semanas 0 e 4, e depois a cada oito semanas, enquanto aqueles tratados com risanquizumabe receberam doses de 150mg nas semanas 0 e 4, e depois a cada 12 semanas. A gravidade da psoríase foi avaliada nas semanas 4, 16, 28 e 52 por meio da Avaliação Global dos Médicos (PGA, Physicians’ Global Assessment). Os escores do Índice de Área e Gravidade da Psoríase (PASI90) e PASI100 também foram calculados.
Dados demográficos, comorbidades (hipertensão, diabetes mellitus, dislipidemia, obesidade, doença esteatose hepática não alcoólica), subtipo de psoríase, áreas corporais afetadas, presença de artrite psoriásica (AP), histórico de terapias sistêmicas anteriores e terapias biológicas, duração do tratamento, eficácia do tratamento, reações adversas, bem como resultados de exames de sangue basais e de seguimento (hemograma completo, transaminases, creatinina, azotemia, glicemia, taxa de hemossedimentação, proteína C‐reativa, colesterol total e níveis de triglicérides) foram coletados retrospectivamente.
O estudo foi conduzido de acordo com a Declaração de Helsinque após receber a aprovação dos comitês de ética locais das duas universidades participantes.
Análise estatísticaA análise estatística foi realizada utilizando o software IBM SPSS versão 25 para Windows. Os resultados foram expressos como números (n) e porcentagens (%) para dados descritivos e a análise de qui‐quadrado foi empregada para comparar variáveis categóricas. A distribuição normal foi avaliada usando o teste de Kolmogorov‐Smirnov. O teste t de Student foi aplicado para comparar variáveis constantes com distribuição normal, enquanto o teste U de Mann‐Whitney foi usado para variáveis com distribuição não normal. A análise de correlação foi realizada utilizando o teste de correlação de Spearman. A relação entre os parâmetros foi realizada pela análise de Pearson ou Spearman. Valor de p <0,05 foi considerado estatisticamente significante.
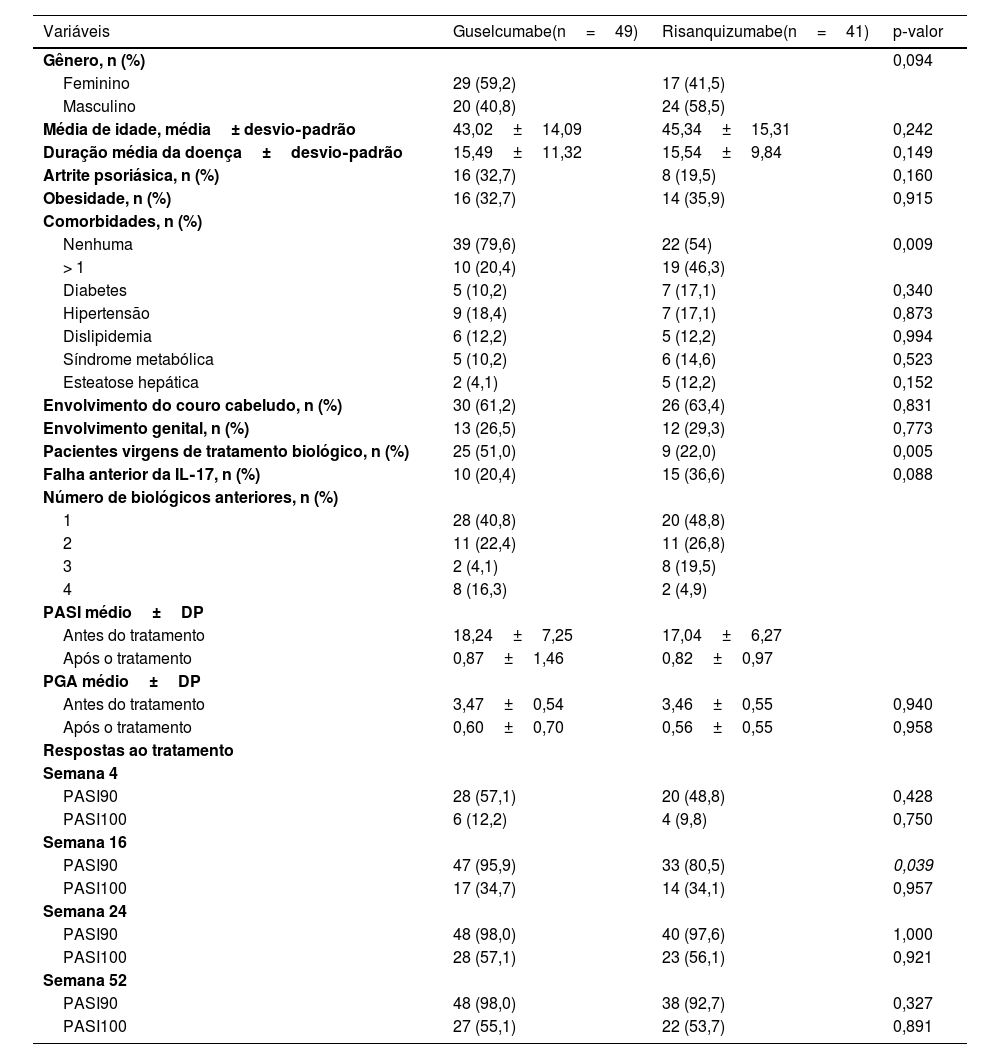
ResultadosOs dados demográficos e as características da população do estudo estão resumidos na tabela 1. Dos 90 pacientes inscritos no estudo, 49 (54,4%) receberam guselcumabe, enquanto 41 (45,6%) receberam risanquizumabe. O grupo guselcumabe era composto por 29 mulheres (59,1%) e 20 homens, enquanto o grupo risanquizumabe era composto por 17 mulheres (41,4%) e 24 homens (58,6%). Não houve diferença estatisticamente significante entre os gêneros em termos de tipo de biológico (p=0,094). Particularmente, entre as comorbidades, a hipertensão (18,4% vs. 17,1%) foi a condição mais comum, mas nenhuma diferença significante foi observada entre os dois grupos.
Dados demográficos e clínicos da população do estudo
| Variáveis | Guselcumabe(n=49) | Risanquizumabe(n=41) | p‐valor |
|---|---|---|---|
| Gênero, n (%) | 0,094 | ||
| Feminino | 29 (59,2) | 17 (41,5) | |
| Masculino | 20 (40,8) | 24 (58,5) | |
| Média de idade, média± desvio‐padrão | 43,02±14,09 | 45,34±15,31 | 0,242 |
| Duração média da doença±desvio‐padrão | 15,49±11,32 | 15,54±9,84 | 0,149 |
| Artrite psoriásica, n (%) | 16 (32,7) | 8 (19,5) | 0,160 |
| Obesidade, n (%) | 16 (32,7) | 14 (35,9) | 0,915 |
| Comorbidades, n (%) | |||
| Nenhuma | 39 (79,6) | 22 (54) | 0,009 |
| > 1 | 10 (20,4) | 19 (46,3) | |
| Diabetes | 5 (10,2) | 7 (17,1) | 0,340 |
| Hipertensão | 9 (18,4) | 7 (17,1) | 0,873 |
| Dislipidemia | 6 (12,2) | 5 (12,2) | 0,994 |
| Síndrome metabólica | 5 (10,2) | 6 (14,6) | 0,523 |
| Esteatose hepática | 2 (4,1) | 5 (12,2) | 0,152 |
| Envolvimento do couro cabeludo, n (%) | 30 (61,2) | 26 (63,4) | 0,831 |
| Envolvimento genital, n (%) | 13 (26,5) | 12 (29,3) | 0,773 |
| Pacientes virgens de tratamento biológico, n (%) | 25 (51,0) | 9 (22,0) | 0,005 |
| Falha anterior da IL‐17, n (%) | 10 (20,4) | 15 (36,6) | 0,088 |
| Número de biológicos anteriores, n (%) | |||
| 1 | 28 (40,8) | 20 (48,8) | |
| 2 | 11 (22,4) | 11 (26,8) | |
| 3 | 2 (4,1) | 8 (19,5) | |
| 4 | 8 (16,3) | 2 (4,9) | |
| PASI médio±DP | |||
| Antes do tratamento | 18,24±7,25 | 17,04±6,27 | |
| Após o tratamento | 0,87±1,46 | 0,82±0,97 | |
| PGA médio±DP | |||
| Antes do tratamento | 3,47±0,54 | 3,46±0,55 | 0,940 |
| Após o tratamento | 0,60±0,70 | 0,56±0,55 | 0,958 |
| Respostas ao tratamento | |||
| Semana 4 | |||
| PASI90 | 28 (57,1) | 20 (48,8) | 0,428 |
| PASI100 | 6 (12,2) | 4 (9,8) | 0,750 |
| Semana 16 | |||
| PASI90 | 47 (95,9) | 33 (80,5) | 0,039 |
| PASI100 | 17 (34,7) | 14 (34,1) | 0,957 |
| Semana 24 | |||
| PASI90 | 48 (98,0) | 40 (97,6) | 1,000 |
| PASI100 | 28 (57,1) | 23 (56,1) | 0,921 |
| Semana 52 | |||
| PASI90 | 48 (98,0) | 38 (92,7) | 0,327 |
| PASI100 | 27 (55,1) | 22 (53,7) | 0,891 |
A taxa de tratamento anterior com biológicos foi significantemente maior no grupo guselcumabe (p=0,005). Nenhuma diferença notável foi observada em termos de falha prévia de IL‐17 (p=0,103). As proporções de envolvimento do couro cabeludo e região genital foram semelhantes em ambos os grupos (p=0,831 e p=0,773, respectivamente).
Em relação à eficiência da terapia, não houve diferença estatisticamente significante em relação à PASI90 e PASI100 na semana 4 entre os dois grupos (p=0,428 e p=0,750, respectivamente). Na semana 16, as respostas PASI90 foram maiores no grupo guselcumabe (p=0,039). Entretanto, não houve diferença na resposta PASI100 na semana 16 (p=0,957). Nas semanas 24 e 52, as respostas PASI90 e PASI100 foram semelhantes em ambos os grupos (ver tabela 1 e fig. 1).
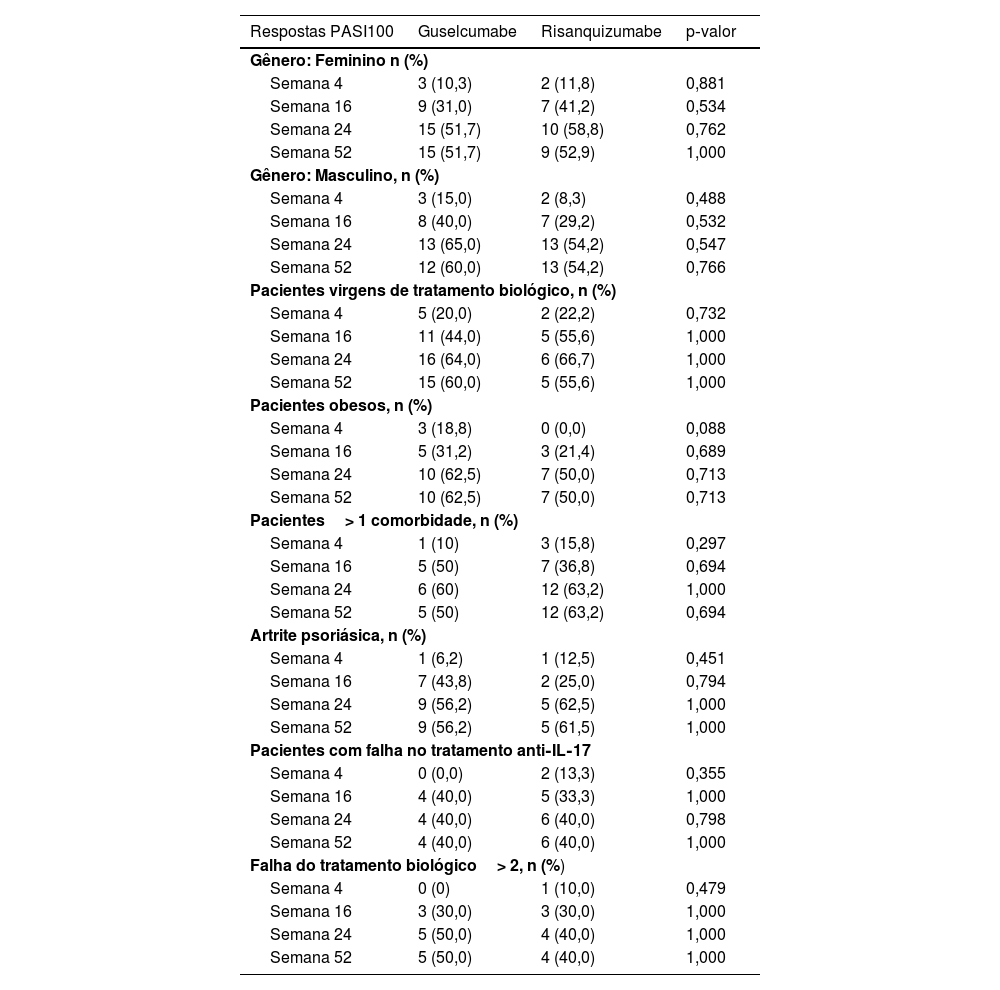
Ao avaliar as respostas PASI100 em pacientes com envolvimento do couro cabeludo e da área genital, a taxa de resposta PASI100 no grupo guselcumabe foi significantemente maior na semana 4 entre os pacientes com envolvimento do couro cabeludo (p=0,006). Entretanto, essa diferença não foi sustentada nas semanas 16 e 24. Não foram encontradas diferenças nas respostas PASI100 nas semanas 4, 16 e 24 nos pacientes com envolvimento da área genital.
Respostas PASI100 em diferentes subgrupos de pacientesNenhuma diferença significante foi demonstrada nas taxas de PASI100 dos grupos guselcumabe e risanquizumabe em pacientes virgens de tratamento com biológicos em comparação com pacientes tratados anteriormente com biológicos nas semanas 4, 16, 24 e 52. Da mesma maneira, não houve diferença significante nas taxas de PASI100 nas semanas 4, 16, 24 e 52 em pacientes obesos, pacientes com comorbidades e pacientes com artrite psoriásica (tabela 2).
Comparação das respostas do PASI100 com o tratamento com risanquizumabe e guselcumabe em relação a comorbidades, gênero e tratamentos anteriores
| Respostas PASI100 | Guselcumabe | Risanquizumabe | p‐valor |
|---|---|---|---|
| Gênero: Feminino n (%) | |||
| Semana 4 | 3 (10,3) | 2 (11,8) | 0,881 |
| Semana 16 | 9 (31,0) | 7 (41,2) | 0,534 |
| Semana 24 | 15 (51,7) | 10 (58,8) | 0,762 |
| Semana 52 | 15 (51,7) | 9 (52,9) | 1,000 |
| Gênero: Masculino, n (%) | |||
| Semana 4 | 3 (15,0) | 2 (8,3) | 0,488 |
| Semana 16 | 8 (40,0) | 7 (29,2) | 0,532 |
| Semana 24 | 13 (65,0) | 13 (54,2) | 0,547 |
| Semana 52 | 12 (60,0) | 13 (54,2) | 0,766 |
| Pacientes virgens de tratamento biológico, n (%) | |||
| Semana 4 | 5 (20,0) | 2 (22,2) | 0,732 |
| Semana 16 | 11 (44,0) | 5 (55,6) | 1,000 |
| Semana 24 | 16 (64,0) | 6 (66,7) | 1,000 |
| Semana 52 | 15 (60,0) | 5 (55,6) | 1,000 |
| Pacientes obesos, n (%) | |||
| Semana 4 | 3 (18,8) | 0 (0,0) | 0,088 |
| Semana 16 | 5 (31,2) | 3 (21,4) | 0,689 |
| Semana 24 | 10 (62,5) | 7 (50,0) | 0,713 |
| Semana 52 | 10 (62,5) | 7 (50,0) | 0,713 |
| Pacientes> 1 comorbidade, n (%) | |||
| Semana 4 | 1 (10) | 3 (15,8) | 0,297 |
| Semana 16 | 5 (50) | 7 (36,8) | 0,694 |
| Semana 24 | 6 (60) | 12 (63,2) | 1,000 |
| Semana 52 | 5 (50) | 12 (63,2) | 0,694 |
| Artrite psoriásica, n (%) | |||
| Semana 4 | 1 (6,2) | 1 (12,5) | 0,451 |
| Semana 16 | 7 (43,8) | 2 (25,0) | 0,794 |
| Semana 24 | 9 (56,2) | 5 (62,5) | 1,000 |
| Semana 52 | 9 (56,2) | 5 (61,5) | 1,000 |
| Pacientes com falha no tratamento anti‐IL‐17 | |||
| Semana 4 | 0 (0,0) | 2 (13,3) | 0,355 |
| Semana 16 | 4 (40,0) | 5 (33,3) | 1,000 |
| Semana 24 | 4 (40,0) | 6 (40,0) | 0,798 |
| Semana 52 | 4 (40,0) | 6 (40,0) | 1,000 |
| Falha do tratamento biológico> 2, n (%) | |||
| Semana 4 | 0 (0) | 1 (10,0) | 0,479 |
| Semana 16 | 3 (30,0) | 3 (30,0) | 1,000 |
| Semana 24 | 5 (50,0) | 4 (40,0) | 1,000 |
| Semana 52 | 5 (50,0) | 4 (40,0) | 1,000 |
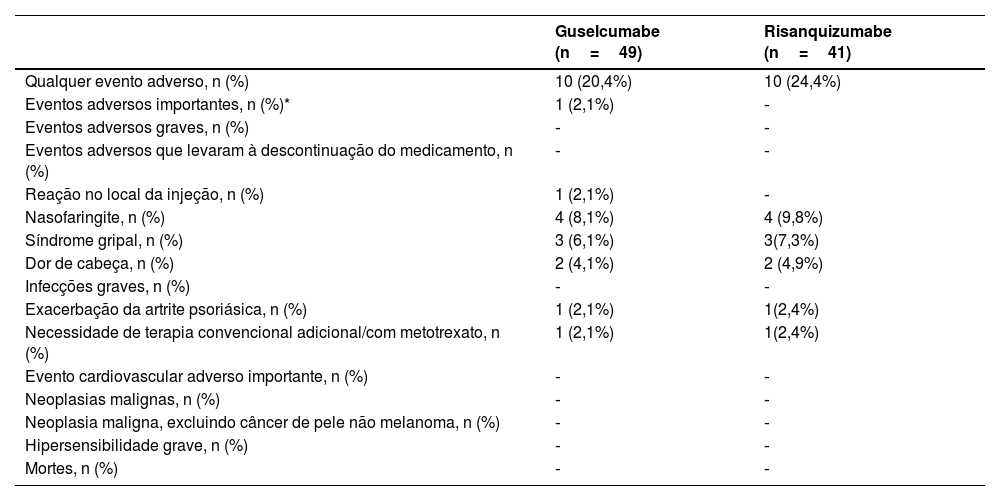
Dois pacientes tratados com guselcumabe (4,1%) descontinuaram o tratamento por falta de resposta secundária. No grupo risanquizumabe, dois pacientes (4,9%) descontinuaram o tratamento por falta de resposta secundária, enquanto um paciente (2,4%) desistiu por exacerbação de queixas articulares.
Ao analisar as taxas de efeitos colaterais que ocorrem sob o uso de medicação, elas foram semelhantes em ambos os grupos de tratamento (guselcumabe 20,4%, risanquizumabe 24,4%; tabela 3). Os efeitos colaterais mais comumente observados foram, respectivamente, faringite, síndrome gripal e dor de cabeça. Tanto no grupo risanquizumabe quanto no grupo guselcumabe, um paciente apresentou exacerbação da artrite psoriásica previamente conhecida e recebeu metotrexato adicional para controle. Ambos os pacientes tinham sido tratados anteriormente com biológicos.
Reações adversas decorrentes do uso de guselcumabe e risanquizumabe
| Guselcumabe (n=49) | Risanquizumabe (n=41) | |
|---|---|---|
| Qualquer evento adverso, n (%) | 10 (20,4%) | 10 (24,4%) |
| Eventos adversos importantes, n (%)* | 1 (2,1%) | ‐ |
| Eventos adversos graves, n (%) | ‐ | ‐ |
| Eventos adversos que levaram à descontinuação do medicamento, n (%) | ‐ | ‐ |
| Reação no local da injeção, n (%) | 1 (2,1%) | ‐ |
| Nasofaringite, n (%) | 4 (8,1%) | 4 (9,8%) |
| Síndrome gripal, n (%) | 3 (6,1%) | 3(7,3%) |
| Dor de cabeça, n (%) | 2 (4,1%) | 2 (4,9%) |
| Infecções graves, n (%) | ‐ | ‐ |
| Exacerbação da artrite psoriásica, n (%) | 1 (2,1%) | 1(2,4%) |
| Necessidade de terapia convencional adicional/com metotrexato, n (%) | 1 (2,1%) | 1(2,4%) |
| Evento cardiovascular adverso importante, n (%) | ‐ | ‐ |
| Neoplasias malignas, n (%) | ‐ | ‐ |
| Neoplasia maligna, excluindo câncer de pele não melanoma, n (%) | ‐ | ‐ |
| Hipersensibilidade grave, n (%) | ‐ | ‐ |
| Mortes, n (%) | ‐ | ‐ |
A eficácia e a segurança do guselcumabe e do risanquizumabe, dois inibidores seletivos da IL‐23, foram demonstradas em diversos ensaios de fase III. A eficácia do guselcumabe foi relatada como 73,3% nas respostas PASI90 e 37,4% nas respostas PASI100 na semana 16da fase 3 do estudo VOYAGE‐1.3 No estudo VOYAGE‐2, o guselcumabe demonstrou eficácia ao atingir o escore PASI90 em 70% dos casos e PASI100 em 34,1% dos casos.4 No presente estudo, essas taxas foram maiores para o PASI90 (95,9%) e menores para o PASI100 (34,7%), respectivamente, na semana 16.
Nos estudos UltIMMa‐1 e UltIMMa‐2, a eficácia do risanquizumabe foi relatada como 74,8% para PASI90 e 50,7% para PASI100 na semana 16 do estudo UltIMMa‐2.6 No presente estudo, essas taxas foram maiores para PASI90 (80,5%) e menores para PASI100 (34,1%). Analisando os dados da prática clínica, Fougerousse et al. conduziram estudo multicêntrico retrospectivo com 194 pacientes psoriásicos que receberam guselcumabe. Na semana 16, 50,6% dos pacientes atingiram PASI90 e 38,3% atingiram PASI100.11 Embora a taxa de resposta PASI100 espelhasse o presente estudo, a taxa de resposta PASI90 foi menor em comparação com a presente pesquisa. Em estudo com 112 pacientes psoriásicos recebendo guselcumabe, Benhadou et al. mostraram respostas PASI90 ligeiramente mais baixas (55,4%) e PASI100 semelhantes (32,1%) na semana 16 em comparação com o presente estudo.12 Em relação aos resultados em período prolongado, Galluzzo et al. relataram respostas PASI90 e PASI100 de 78,9% e 63,2%, respectivamente, em 12 meses com guselcumabe.13 Apesar de resposta PASI90 superior na semana 52 no presente estudo, a resposta PASI100 foi menor em comparação com o estudo mencionado.
Hansel et al. conduziram estudo retrospectivo de 16 semanas; PASI100 e PASI90 foram alcançados em 49,1% e 63,2%, respectivamente, usando risanquizumabe.14 Mastorino et al. relataram eficácia do risanquizumabe com PASI90 e PASI100 de 53% e 32% na semana 16, respectivamente, e 82% e 73% na semana 52.15 Gkalpakiotis et al. acompanharam 154 pacientes submetidos ao tratamento com risanquizumabe, com respostas PASI90 e PASI100 de 82,4% e 67,6%, respectivamente, na semana 52.16 Os resultados do presente estudo foram comparáveis aos do estudo de Gkalpakiotis et al. com proporção de 93% e 53,7% de respostas PASI90 e PASI100, respectivamente, na semana 52. Gargiulo et al. examinaram os resultados clínicos de 131 pacientes tratados com risanquizumabe, revelando taxas de resposta PASI90 e PASI100 de 55,73% e 36,64% na semana 16, e 78,63% e 61,10% na semana 52.17 Hansel et al. mostraram a eficácia do risanquizumabe na semana 52, 85,5% de PASI90 e 60% de PASI100.18
Além disso, a eficácia do risanquizumabe foi avaliada em pacientes que inicialmente apresentaram falha com guselcumabe. Os pacientes tratados com risanquizumabe apresentaram escores PGA mais baixos após quatro e 12 meses em comparação com o escore PGA basal.19 Após quatro meses de risanquizumabe, 46% dos pacientes apresentaram escore PGA de 0/1, aumentando para 90% em 12 meses.
Elgaard et al. relataram PASI90 de 48% e PASI100 de 44% na semana 24 em pacientes recebendo guselcumabe, enquanto os pacientes recebendo risanquizumabe tinham PASI90 de 55,6% e PASI100 de 38,9%.20 Ruggiero et al. compararam eficácia e segurança de guselcumabe e risanquizumabe e estabeleceram que ambos os medicamentos mostraram eficácia semelhante (PASI90 e PASI100) sem diferenças significantes.9 Em seu estudo, respostas PASI100 foram obtidas em 47,2% daqueles que receberam guselcumabe e em 46,8% dos pacientes usando risanquizumabe na semana 44; esses resultados foram menores quando comparados às respostas obtidas no presente estudo na semana 52.
Gerdes et al. acompanharam 303 pacientes que receberam guselcumabe por 52 semanas.21 Na semana 52, 78,4% (n=192), 62,9% (n=154) e 40,4% (n=99) da coorte do estudo atingiram respostas PASI75, PASI90 e PASI100, respectivamente. Ao contrário dos resultados do presente estudo, pacientes sem tratamento biológico anterior e pacientes que não receberam inibidor de IL‐17 antes do guselcumabe apresentaram escores PASI maiores em comparação com pacientes que receberam tratamento biológico anterior e tratamento anti‐IL‐17, respectivamente.21
Benhadou et al. estabeleceram que ter recebido tratamento anterior com biológicos e ser virgem de tratamento não afetou os resultados do tratamento com guselcumabe na semana 16.12 Por outro lado, Hansel et al. demonstraram em sua pesquisa que, sob terapia com risanquizumabe, indivíduos com exposição biológica anterior atingiram PASI100 com mais frequência na semana 36 e na semana 52 do que pacientes virgens de tratamento com biológicos.18 Além disso, Galluzzo et al. relataram que o número de comorbidades e falha biológica anterior têm implicações negativas nas respostas PASI.13 No estudo de Vaiopoulos et al., taxas significantemente maiores de resposta PASI100 foram encontradas em pacientes virgens de tratamentos biológicos recebendo risanquizumabe e guselcumabe em comparação com pacientes não virgens (89,5 vs. 76,9%).10 Os pesquisadores observaram que obesidade não afetou a resposta PASI100; inversamente, pacientes sem dislipidemia tiveram melhores respostas cutâneas. Não houve diferença nos escores do Disease Activity Index for Psoriatic Arthritis entre os grupos de medicamentos em pacientes com e sem artrite psoriásica. Eles também descobriram que a psoríase do couro cabeludo apresentou rápida melhora a partir da semana 4, enquanto a psoríase palmoplantar, a psoríase ungueal e a artrite psoriásica apresentaram melhora significante, porém mais lenta, a partir da semana 16.10 Gerdes et al. também relataram alta eficácia do guselcumabe na psoríase do couro cabeludo, palmoplantar e genital.21 Em termos gerais, não houve diferença na resposta ao tratamento com risanquizumabe entre aqueles com envolvimento de área específica, em um estudo italiano.15 O estudo de Gargiulo et al. confirmou o anterior, particularmente em relação à eficácia do risanquizumabe entre os pacientes, independentemente do envolvimento de área específica.17
De acordo com o estudo de Hansel et al., respostas PASI75, 90 e 100 mais altas foram estabelecidas em pacientes cujo IMC era <25.14 No estudo de Gerdes et al., enquanto a porcentagem de pacientes que atingiram PASI ≤ 1 foi menor em indivíduos com IMC mais alto, houve proporção elevada de respondedores PASI ≤ 1 observada em todas as categorias de IMC da semana 28 à semana 52.21 Isso pode indicar eficácia sustentável e crescente do guselcumabe em indivíduos com obesidade. Da mesma forma, Galluzzo et al. relataram que a presença de obesidade não serviu como preditor da resposta PASI.13 Da mesma maneira, estudo multicêntrico conduzido na República Tcheca revelou que tanto o IMC quanto terapia biológica anterior não tiveram impacto nas respostas PASI90 e PASI100 durante o tratamento com risanquizumabe.16 O presente estudo demonstrou que obesidade, ser virgem de tratamento biológico ou prevalência de AP não alteraram a eficácia dos tratamentos com guselcumabe e risanquizumabe.
Semelhante ao presente estudo, Ruggiero et al. relataram dois pacientes que interromperam o uso de guselcumabe em virtude de piora da AP, cujas queixas articulares já não respondiam aos medicamentos anti‐TNF e anti‐IL‐17.1 Em consonância com a literatura, não foi observada nenhuma ativação de tuberculose no presente estudo.
Shu et al. conduziram estudo de farmacovigilância para risanquizumabe e relataram efeitos adversos significantes, incluindo infarto do miocárdio, trombose e doença arterial oclusiva.22 Entretanto, esses efeitos foram de fraca prioridade clínica e ocorreram principalmente nos primeiros três meses de terapia, de acordo com as análises. Embora tenha havido debates sobre os efeitos adversos decorrentes do uso de risanquizumabe, no presente estudo, assim como no estudo de Ruggiero et al., nenhum efeito adverso grave foi observado.1
Ter a via IL‐23 como alvo seletivo não aumentou o risco de infecções oportunistas, ativação de tuberculose, candidíase oral ou doença inflamatória intestinal.23 Após cinco anos de seguimento dos 1.721 pacientes (> 7.100 pacientes‐ano) que foram tratados com guselcumabe, 32 pacientes apresentaram neoplasias malignas excluindo câncer de pele não melanoma (CPNM; 0,45/100 pacientes‐ano). Essa taxa foi comparável à taxa de malignidade excluindo CPNM (0,68/100 pacientes‐ano) no Psoriasis Longitudinal Assessment and Registry.24 Em estudo de prática clínica na Itália, entre 307 pacientes tratados com guselcumabe, efeitos adversos foram relatados em 10 pacientes (3%), incluindo um paciente com ataque isquêmico transitório; dois pacientes descontinuaram o medicamento em decorrência de eritrodermia e mal‐estar.25 Gerdes et al. observaram quatro (n=303; 1%) efeitos adversos graves relacionados ao tratamento – bronquite, infecção por vírus Epstein‐Barr, neoplasia maligna e penfigoide.21 No estudo tcheco, o risanquizumabe foi descontinuado em um participante por câncer colorretal e em outro por síndrome de Morbihan, com possível ligação ao risanquizumabe que não pôde ser descartada.16
O tamanho relativamente pequeno da amostra, a natureza retrospectiva do estudo e o período de seguimento restrito podem limitar a generalização dos resultados do presente estudo.
ConclusõesOs resultados do presente estudo mostraram que tanto o guselcumabe quanto o risanquizumabe foram eficazes em pacientes que apresentaram falha anterior com outros biológicos. Os resultados clínicos nos grupos guselcumabe e risanquizumabe haviam permanecido inalterados durante tratamentos biológicos anteriores, como anti‐TNF, anti‐IL‐17 e/ou anti‐IL‐12/23. Os tratamentos produziram resultados consistentes independentemente de fatores como obesidade, gênero e comorbidades. O presente estudo também mostrou que tanto o guselcumabe quanto o risanquizumabe são opções de tratamento seguras, e os eventos adversos mais frequentemente relatados foram faringite, síndrome gripal e dor de cabeça. Nenhum desses eventos adversos exigiu a descontinuação do tratamento.
Suporte financeiroNenhum.
Contribuição dos autoresLeyla Baykal Selçuk: Curadoria de dados; elaboração e redação do rascunho original; concepção; metodologia.
Hande Ermiş Akkuş: Curadoria de dados; elaboração e redação do rascunho original.
Burak Akşan: Curadoria de dados; elaboração e redação do rascunho original.
Deniz Aksu Arıca: Curadoria de dados; elaboração e redação do rascunho original.
Conflito de interessesNenhum.
Como citar este artigo: Selçuk LB, Akkuş HE, Akşan B, Arıca DA. Risankizumab and guselkumab for psoriasis: a 1‐year real‐world practice indirect comparison. An Bras Dermatol. 2025;100. https://doi.org/10.1016/j.abd.2024.05.005.
Trabalho realizado na Faculdade de Medicina, Karadeniz Technical University, Trabzon, Turquia e Faculdade de Medicina, Giresun University, Giresun, Turquia.