Pesticidas, principalmente os organofosforados (OP), têm sido relacionados ao aumento do risco de pênfigo vulgar (PV) e pênfigo foliáceo (PF), porém seus níveis não foram determinados em pacientes com pênfigo.
ObjetivoAvaliar a exposição e a quantificação dos pesticidas, comparando PV, PF e grupos controle no Sudeste do Brasil.
MétodosInformações sobre residência urbana ou rural e exposição a pesticidas no início do pênfigo foram avaliadas por meio de entrevista por questionário. Amostras de cabelos do couro cabeludo de casos de PV, PF e controles foram testadas para pesticidas OP e organoclorados (OC) por cromatografia em fase gasosa acoplada à espectrometria de massa.
ResultadosA minoria dos casos de PV (2 [7,1%] de 28) e PF (7 [18%] de 39), mas nenhum dos 48 controles, informou viver em áreas rurais no início do pênfigo (p=0,2853). PV (33,3%), PF (38,5%) e controles (20%) relataram exposição a pesticidas (p=0,186). Vinte e um (14,8%) de 142 indivíduos testaram positivo para OP e/ou OC: PV (2 [6,3%] de 32) e PF (11 [25,6%] de 43) apresentaram contaminação por pesticidas semelhante aos controles (8 [11,9%] de 67; p=0,4928; p=0,0753, respectivamente), mas PF apresentou maior contaminação do que PV (p=0,034). PV não mostrou nenhuma positividade para OP. Três (7%) casos de PF testaram positivo para OP e OC. Alguns PF testaram positivo para três ou quatro OP, com predominância de diazinon e diclorvós.
Limitação do estudoFalta de dados para alguns controles.
ConclusãoEmbora a frequência de pacientes com PV e PF expostos a pesticidas tenha sido semelhante, os pesticidas foram mais frequentemente detectados em amostras de cabelo de PF em comparação com PV. A relação entre causa e efeito precisa ser determinada.
O pênfigo engloba um grupo de doenças bolhosas autoimunes resultantes da produção de autoanticorpos contra as desmogleínas (Dsg). Autoanticorpos IgG contra Dsg1 afetam a pele no pênfigo foliáceo (PF), e autoanticorpos IgG contra Dsg3 e Dsg1 afetam as mucosas e a pele no pênfigo vulgar (PV).1 O PF é endêmico no Brasil, onde é conhecido como “fogo selvagem”. Mais recentemente, o diagnóstico de PV superou o de PF em algumas regiões brasileiras.2,3 Embora os alelos HLA classe I e II diferenciem as formas clínicas de PF e de PV, sua etiopatogenia não é totalmente compreendida.4–6
Fatores exógenos têm sido associados à patogênese do pênfigo, incluindo medicamentos e elementos nutricionais ricos em tiol, metais pesados, infecção pelo vírus herpes e picada de inseto.7–14 Além disso, em estudos de caso‐controle com base em entrevistas, a exposição a pesticidas, principalmente aos organofosforados (OP), tem sido relacionada ao PV na Ásia, Europa e América do Norte,15–19 e também ao “fogo selvagem” no Brasil.20 PV foi descrito após dermatite de contato com dicloro‐difenil‐tricloroetano e diazinon.21,22 Utilizando pele humana normal como substrato e amostras de soro de PV, o clorpirifós induziu pênfigo em um experimento in vitro.23
Não há relato de abordagem mais abrangente em relação à quantificação de níveis de pesticidas em uma população brasileira mais ampla de pênfigo para melhor compreensão da sua conexão ambiental com o pênfigo. Este estudo teve como objetivo avaliar a exposição a pesticidas por meio de (i) entrevista com base em questionário e (ii) medidas quantificação dos níveis de pesticidas OP e organoclorados (OC) em amostras de cabelo do couro cabeludo de pacientes com PV e PF e controles residentes na região nordeste do estado de São Paulo, uma área do Sudeste brasileiro onde ambas as formas clínicas de pênfigo são prevalentes.3
Materiais e métodosNeste estudo transversal de caso‐controle, três grupos foram comparados: pacientes com PV (doravante denominados PV), pacientes com PF (doravante denominados PF) e controles. Este estudo foi aprovado pelo Comitê de Ética em Pesquisa local do Hospital Universitário da Faculdade de Medicina de Ribeirão Preto da Universidade de São Paulo (n° 2248/2010), e todos os participantes assinaram o termo de consentimento livre e esclarecido.
Grupos de pacientes e controlesSetenta e cinco pacientes com pênfigo atendidos no Ambulatório de Dermatologia do Hospital das Clínicas da Faculdade de Medicina de Ribeirão Preto da Universidade de São Paulo (SP, Brasil) foram incluídos no estudo. Entre eles, 32 tinham PV (mediana de idade=50 anos, 75% do sexo feminino) e 43 tinham PF (mediana de idade=46 anos, 58,1% do sexo feminino), respectivamente (tabela 1). O diagnóstico de PV e PF foi estabelecido com base em características clínicas, histopatológicas e de imunofluorescência (direta, indireta ou ambas) e determinação de autoanticorpos contra Dsg1 e Dsg3 por ELISA (MBL, Japão). Os controles consistiram em 67 parentes e vizinhos saudáveis dos pacientes com pênfigo (mediana de idade=46 anos, 70,1% do sexo feminino; tabela 1). PV, PF e controles residiam na região nordeste do estado de São Paulo, localizado no Sudeste do Brasil.
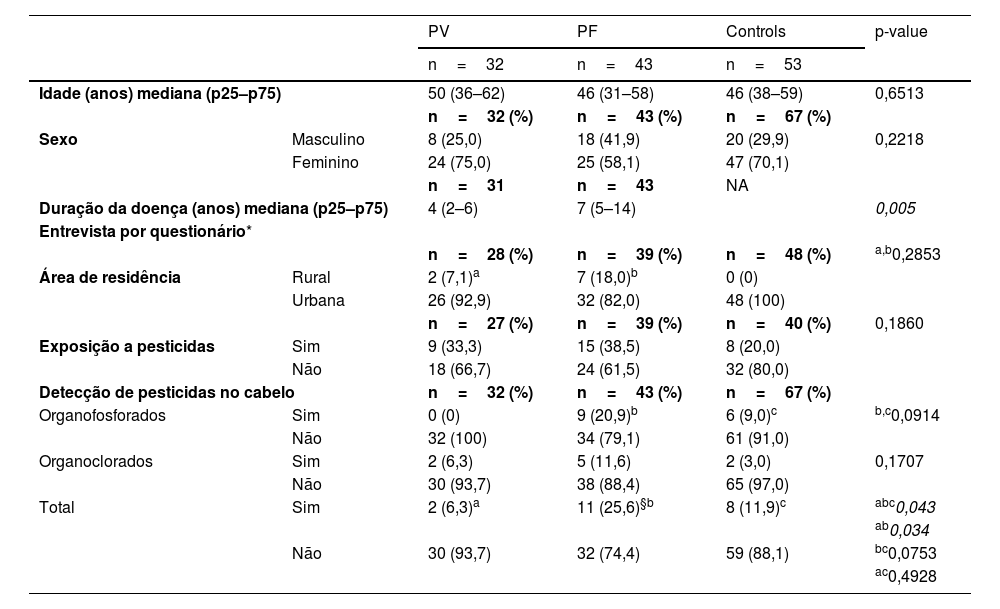
Dados demográficos e clínicos, área de residência e exposição a pesticidas no início da doença, registrados em questionários, e detecção de pesticidas organofosforados e organoclorados em amostras de cabelo de pacientes com pênfigo vulgar (PV) e pênfigo foliáceo (PF) e controles
| PV | PF | Controls | p-value | ||
|---|---|---|---|---|---|
| n=32 | n=43 | n=53 | |||
| Idade (anos) mediana (p25–p75) | 50 (36–62) | 46 (31–58) | 46 (38–59) | 0,6513 | |
| n=32 (%) | n=43 (%) | n=67 (%) | |||
| Sexo | Masculino | 8 (25,0) | 18 (41,9) | 20 (29,9) | 0,2218 |
| Feminino | 24 (75,0) | 25 (58,1) | 47 (70,1) | ||
| n=31 | n=43 | NA | |||
| Duração da doença (anos) mediana (p25–p75) | 4 (2–6) | 7 (5–14) | 0,005 | ||
| Entrevista por questionário* | |||||
| n=28 (%) | n=39 (%) | n=48 (%) | a,b0,2853 | ||
| Área de residência | Rural | 2 (7,1)a | 7 (18,0)b | 0 (0) | |
| Urbana | 26 (92,9) | 32 (82,0) | 48 (100) | ||
| n=27 (%) | n=39 (%) | n=40 (%) | 0,1860 | ||
| Exposição a pesticidas | Sim | 9 (33,3) | 15 (38,5) | 8 (20,0) | |
| Não | 18 (66,7) | 24 (61,5) | 32 (80,0) | ||
| Detecção de pesticidas no cabelo | n=32 (%) | n=43 (%) | n=67 (%) | ||
| Organofosforados | Sim | 0 (0) | 9 (20,9)b | 6 (9,0)c | b,c0,0914 |
| Não | 32 (100) | 34 (79,1) | 61 (91,0) | ||
| Organoclorados | Sim | 2 (6,3) | 5 (11,6) | 2 (3,0) | 0,1707 |
| Não | 30 (93,7) | 38 (88,4) | 65 (97,0) | ||
| Total | Sim | 2 (6,3)a | 11 (25,6)§b | 8 (11,9)c | abc0,043 |
| ab0,034 | |||||
| Não | 30 (93,7) | 32 (74,4) | 59 (88,1) | bc0,0753 | |
| ac0,4928 | |||||
NA, não aplicável.
Os questionários, elaborados pelos autores, foram aplicados a 28 pacientes com PV e 39 com PF e a 48 controles. As respostas a cada item dos questionários foram incompletas nos três grupos. Assim, 28 pacientes com PV e 40 controles responderam a “Área de residência”; e 27 pacientes com PV e 48 controles responderam às questões sobre “Exposição a pesticidas” (tabela 1). Os indivíduos foram entrevistados por ocasião da sua visita ao Ambulatório de Dermatologia do Hospital das Clínicas da Faculdade de Medicina de Ribeirão Preto da Universidade de São Paulo. Duas informações principais foram analisadas: área de residência (rural ou urbana) por ocasião do aparecimento do pênfigo e exposição a pesticidas relacionada a atividades profissionais ou outras causas.
Coleta de amostras de cabeloCom o auxílio de uma tesoura estéril, foram cortados cerca de 500mg da raiz do cabelo do couro cabeludo na região occipital e armazenados em envelopes de papel individuais em temperatura ambiente até a análise. As amostras foram testadas para pesticidas OP e OC.
Métodos analíticos de pesticidas OP e OC e valores aceitáveisOs agrotóxicos pertencentes às classes OP e OC foram analisados por cromatografia em fase gasosa acoplada à espectrometria de massa (GC/MS). O procedimento de extração para análise de amostras de cabelo para presença de OP e OC foi o mesmo descrito por Tsatsakis et al.24 e adaptado às condições instrumentais do Laboratório de Toxicologia Forense do Departamento de Química da Faculdade de Filosofia, Ciências e Letras de Ribeirão Preto da Universidade de São Paulo. Os experimentos foram realizados em um cromatógrafo a gás 7890A acoplado a um espectrômetro de massa 5975C Inert (Agilent Technologies, EUA) equipado com uma coluna cromatográfica DB‐5MSUI (30 m×0,25mm/d.i., 0,25μm de espessura de filme; Agilent Technologies, EUA). Os analitos foram eluídos com programação linear de temperatura do forno, como descrito a seguir: 60°C por 2,0min, aumento para 315°C a 30°C/min, e 315°C por 2min (tempo total de 12,5min). As temperaturas da porta de injeção e da linha de transferência foram ajustadas para 280°C. Hélio ultrapuro foi usado como gás carreador a uma vazão de 1,0mL/min, e as amostras foram injetadas no modo splitless (utilizando liner split ultrainerte desativado com lã de vidro para melhorar a cromatografia). O espectrômetro de massa foi ajustado para o modo SIM. Os dados foram adquiridos e o instrumento foi controlado com o software Agilent Technologies ChemStation, versão E02021431, fornecido pelo fabricante. A tabela suplementar 1 fornece os valores de limite de detecção (LOD) e limite de quantificação (LOQ) dos pesticidas. Os valores de ingestão diária aceitável (IDA) para OP detectados neste estudo são os seguintes: clorpirifós (10 pg/mg), diazinon (2 pg/mg) e malation (300 pg/mg).25 O uso de diclorvós, metil‐paration e paration foi banido. O uso dos pesticidas OC aldrin, BHC, DDT e endrin também foi banido, então nenhum valor de IDA está disponível para eles. As amostras que testaram positivo, mas abaixo do limite de detecção (< LOQ) foram incluídas no presente estudo.
Análise estatísticaOs testes de Kruskal‐Wallis e Mann‐Whitney foram utilizados para analisar idade e duração da doença, respectivamente. O teste de Fischer foi utilizado para analisar as frequências das variáveis. Adotou‐se p ≤ 0,05 e empregou‐se a comparação bicaudal. A análise estatística foi realizada utilizando‐se o software SPSS, 26.0 (IBM, EUA).
ResultadosDados demográficos e clínicosOs grupos de 32 PV, 43 PF e 67 controles não diferiram quanto à idade ou sexo. Dados sobre a idade de 14 controles não estavam disponíveis. A duração da doença foi maior no grupo PF do que no PV (p=0,005; tabela 1).
Dados de entrevistas com base em questionárioNão houve diferença estatística comparando área de residência urbana ou rural entre PV, PF e controles (p=0,2853). Dois (7,1%) dos 28 PV e 7 (18%) dos 39 PF, mas nenhum dos 48 controles, informaram residir na zona rural. As informações positivas ou negativas sobre a exposição a pesticidas foram semelhantes entre os grupos (p=0,186; tabela 1).
Quantificação dos níveis de OP e OC em amostras de cabeloPesticidas OP e OC foram quantificados em amostras de cabelo de 32 PV, 43 PF e 67 controles (tabela 1). Vinte e um (14,8%) dos 142 indivíduos testaram positivo para OP, OC ou ambos. O grupo PF (11 [25,6%]) apresentou mais pacientes contaminados do que o PV (2 [6,3%]), mas tinha tantos indivíduos contaminados quanto os controles (8 [11,9%]; p=0,034 e p=0,0753, respectivamente). PV e controles tiveram detecção de pesticidas semelhante (p=0,4928). Três (7%) PF testaram positivo para OP e OC. Nenhum dos 32 PV testou positivo para OP.
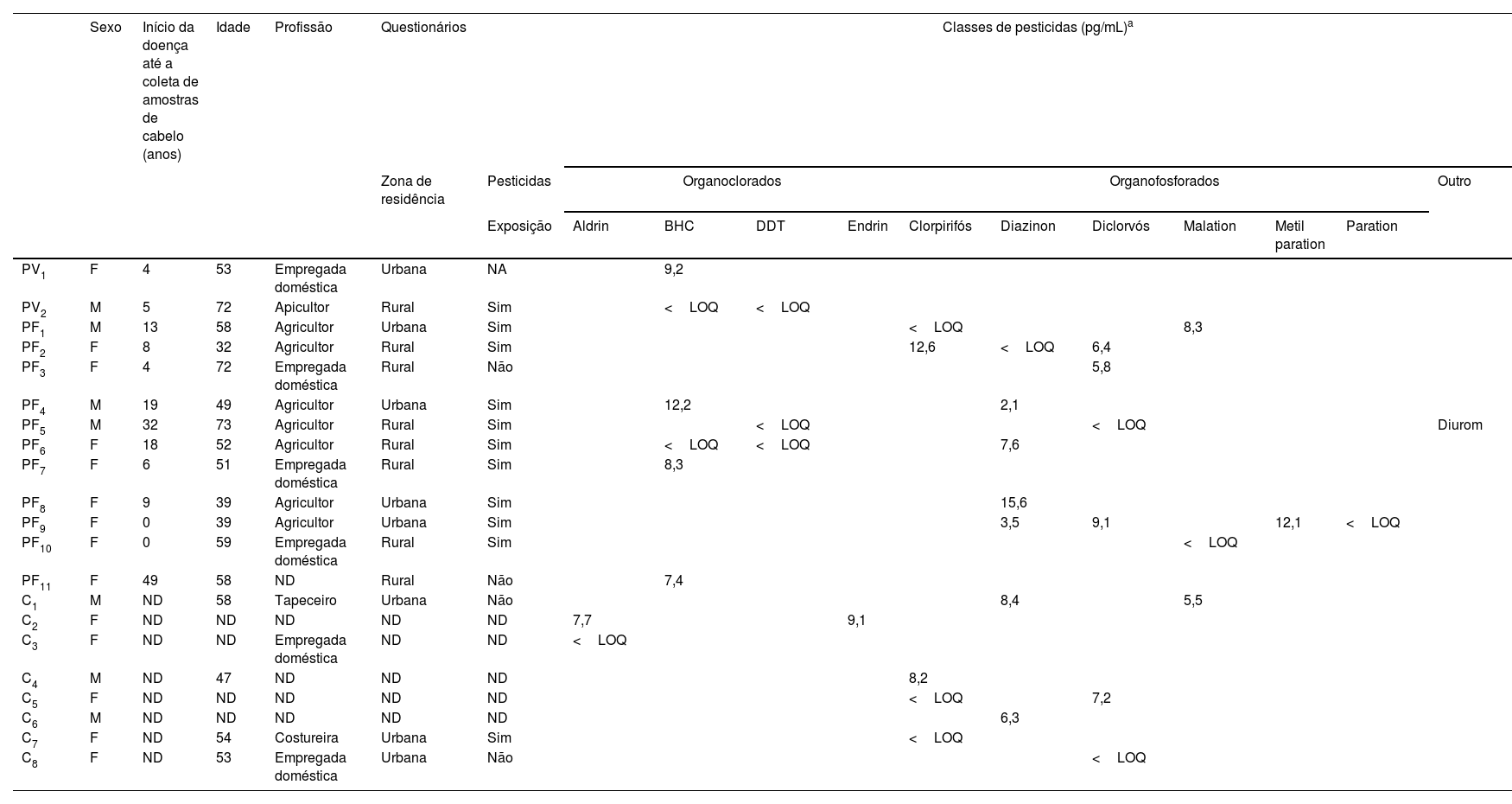
Quatro OC e seis OP foram detectados em pacientes e controles (tabela 2). Entre os OC, aldrin foi detectado em dois controles (< LOQ e 7,7 pg/mg); BHC em dois PV e quatro PF (variação ≤ LOQ a 12,2 pg/mg); DDT em um PV e dois PF (< LOQ); e endrin em um controle (9,1 pg/mg). Entre os OP, o clorpirifós foi detectado em dois PF e três controles (variação ≤ LOQ a 12,6 pg/mg); diazinon em cinco PF e dois controles (variação ≤ LOQ a 15,6 pg/mg); diclorvós em quatro PF e dois controles (variação ≤ LOQ a 9,1 pg/mg); malation em dois PF e um controle (variação ≤ LOQ a 8,3 pg/mg); metil‐paration em um PF (12,1 pg/mg); e paration em outro PF (< LOQ). Alguns PF testaram positivo para três ou quatro OP, com predominância de diazinon e diclorvós. Diurom foi detectado em um PF. Sete (70%) dos 10 PF eram do sexo feminino, residiam em áreas rurais no início do pênfigo e haviam sido expostas a pesticidas durante suas atividades profissionais no campo (tabela 2).
Dados demográficos, questionários e classes de pesticidas detectados em amostras de cabelo dos grupos pênfigo vulgar (PV; n=32), pênfigo foliáceo (PF; n=43) e controle (C; n=67)
| Sexo | Início da doença até a coleta de amostras de cabelo (anos) | Idade | Profissão | Questionários | Classes de pesticidas (pg/mL)a | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Zona de residência | Pesticidas | Organoclorados | Organofosforados | Outro | |||||||||||||
| Exposição | Aldrin | BHC | DDT | Endrin | Clorpirifós | Diazinon | Diclorvós | Malation | Metil paration | Paration | |||||||
| PV1 | F | 4 | 53 | Empregada doméstica | Urbana | NA | 9,2 | ||||||||||
| PV2 | M | 5 | 72 | Apicultor | Rural | Sim | <LOQ | <LOQ | |||||||||
| PF1 | M | 13 | 58 | Agricultor | Urbana | Sim | <LOQ | 8,3 | |||||||||
| PF2 | F | 8 | 32 | Agricultor | Rural | Sim | 12,6 | <LOQ | 6,4 | ||||||||
| PF3 | F | 4 | 72 | Empregada doméstica | Rural | Não | 5,8 | ||||||||||
| PF4 | M | 19 | 49 | Agricultor | Urbana | Sim | 12,2 | 2,1 | |||||||||
| PF5 | M | 32 | 73 | Agricultor | Rural | Sim | <LOQ | <LOQ | Diurom | ||||||||
| PF6 | F | 18 | 52 | Agricultor | Rural | Sim | <LOQ | <LOQ | 7,6 | ||||||||
| PF7 | F | 6 | 51 | Empregada doméstica | Rural | Sim | 8,3 | ||||||||||
| PF8 | F | 9 | 39 | Agricultor | Urbana | Sim | 15,6 | ||||||||||
| PF9 | F | 0 | 39 | Agricultor | Urbana | Sim | 3,5 | 9,1 | 12,1 | <LOQ | |||||||
| PF10 | F | 0 | 59 | Empregada doméstica | Rural | Sim | <LOQ | ||||||||||
| PF11 | F | 49 | 58 | ND | Rural | Não | 7,4 | ||||||||||
| C1 | M | ND | 58 | Tapeceiro | Urbana | Não | 8,4 | 5,5 | |||||||||
| C2 | F | ND | ND | ND | ND | ND | 7,7 | 9,1 | |||||||||
| C3 | F | ND | ND | Empregada doméstica | ND | ND | <LOQ | ||||||||||
| C4 | M | ND | 47 | ND | ND | ND | 8,2 | ||||||||||
| C5 | F | ND | ND | ND | ND | ND | <LOQ | 7,2 | |||||||||
| C6 | M | ND | ND | ND | ND | ND | 6,3 | ||||||||||
| C7 | F | ND | 54 | Costureira | Urbana | Sim | <LOQ | ||||||||||
| C8 | F | ND | 53 | Empregada doméstica | Urbana | Não | <LOQ | ||||||||||
BHC, hexaclorobenzeno; DDT, dicloro‐difenil‐tricloroetano; LOQ, limite de quantificação; ND, não disponível.
A patogênese do pênfigo é atribuída ao histórico genético e a fatores ambientais, incluindo pesticidas.4–6,15–20,26 Há poucos relatos de pesticidas desencadeando autoimunidade. Eles foram descritos como causadores de imunotoxicidade, disfunção endócrina, distúrbios neurodegenerativos e câncer, entre outras condições. Em relação às doenças autoimunes, os pesticidas têm sido relacionados principalmente ao lúpus eritematoso sistêmico e à artrite reumatoide.27–30
Que seja do nosso conhecimento, este é o primeiro relato sobre a quantificação de níveis de pesticidas em pacientes com PV e PF, em comparação com controles. Escolheu‐se quantificar os níveis de pesticidas em amostras de cabelo porque são considerados biomarcadores humanos de exposição aos pesticidas.31–33 O presente estudo confirmou a contaminação por OP e/ou OC em amostras de cabelo em PV, PF e controles (6,3%, 25,6% e 11,9%, respectivamente; p=0,0437). Em comparação com PV, PF apresentou maior frequência de contaminação com pesticidas (p=0,034). Além disso, nove (20,9%) de 43 PF, mas nenhum dos 32 PV testou positivo para OP. Alguns PF testaram positivo para três ou quatro OP, com predominância de diazinon e diclorvós. OC foi detectado de modo semelhante em PV, PF e controles, embora seu uso tenha sido banido desde 1985.34
O mecanismo imunológico proposto para PV utilizando clorpirifós,23 que é um dos OP detectados em PF e controles neste estudo, não explica a patogênese do PV nesse pesticida, uma vez que o PV não apresentou nenhuma contaminação por OP.
Como se explica a prevalência aumentada de contaminação por pesticidas no PF? Historicamente, no Brasil, o PF estava distribuído em áreas rurais próximas aos rios, e a exposição a pesticidas foi considerada um possível fator de risco para PF no país.20,35 Entretanto, as entrevistas com base em questionário não revelaram diferença estatística entre PV, PF e controles em termos de residência urbana ou rural e exposição a pesticidas. Por outro lado, a maioria do grupo PF com contaminação capilar por OC ou OP informou que residia na zona rural no início do pênfigo e havia sido exposta a pesticidas durante suas atividades profissionais no campo (tabela 2). Além disso, a doença tem duração maior no PF do que no PV, o que pode ter contribuído para a bioacumulação de pesticidas no PF.
A exposição a pesticidas foi confirmada em doadores de sangue e na população rural no Brasil.36–38 Além disso, o perfil imunológico foi determinado em agricultores brasileiros expostos a pesticidas.39,40 Em nosso estudo, em oito controles que apresentaram contaminação com pesticidas (seis OP e dois OC; tabela 2), foram pesquisados autoanticorpos contra Dsg1 e Dsg3 utilizando ELISA (MBL, Japão), com resultados negativos em três (C1, C7 e C8). Os perfis de HLA classe II foram determinados nos oito controles (C1 a C8; dados não mostrados). Em dois dos seis controles contaminados com OP observamos: um controle (C1) contaminado com diazinon e malation apresentou ambos os alelos HLA‐DRB1*01:01 e HLA‐DQB1*05:01 de suscetibilidade para PF; e outro (C5) contaminado com diclorvós e clorpirifós apresentou o alelo HLA‐DQB1*03:02 de suscetibilidade para PV. Os outros seis controles não apresentaram alelos associados com PV e PF (para alelos HLA associados a PV e PF, ver Brochado et al.4). Sabendo que ambas as formas clínicas de pênfigo são prevalentes na região nordeste do estado de São Paulo35 testar anticorpos contra Dsg e determinar os alelos HLA em uma ampla população exposta a pesticidas forneceria informações importantes sobre a relação pesticidas‐pênfigo.
Os resultados do presente estudo corroboram um relato recente de Chang e Tsai,41 em revisão sistemática e metanálise. Eles incluíram cinco estudos de caso‐controle15–17,19,20 com base em entrevistas sobre a relação entre exposição a pesticidas e PV e PF. Os autoress concluíram haver associação entre exposição a pesticidas e pênfigo.41 Em nosso estudo, demonstramos a contaminação do cabelo por OC e/ou OP nos três grupos estudados; o grupo PF foi o que apresentou a maior contaminação por pesticidas.
ConclusãoO presente estudo confirmou a contaminação do cabelo com pesticidas OC e/ou OP em PF, PV e controles. Os pacientes com PV não testaram positivo para pesticidas OP. Alguns pacientes com PF testaram positivo para três ou quatro OP, com predominância de diazinon e diclorvós. Embora PV e PF tenham fornecido informações semelhantes sobre residência em áreas rurais no início do pênfigo e estarem expostos a pesticidas, a detecção desses foi mais frequente em amostras de cabelo de PF em comparação com PV. A relação entre a patogênese de PF e pesticidas ainda precisa ser elucidada.
Suporte financeiroEste estudo foi parcialmente financiado pela Fundação de Amparo à Pesquisa do Estado de São Paulo (FAPESP, n° 2010/51729‐2). O primeiro autor recebeu bolsa de mestrado da Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES).
Contribuição dos autoresBruno de Martins: Aprovação da versão final do manuscrito; obtenção, análise e interpretação dos dados; revisão crítica do manuscrito.
Leonardo La Serra: Análise estatística; aprovação da versão final do manuscrito; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; revisão crítica da literatura; revisão crítica do manuscrito.
Rafael Lanaro: Aprovação da versão final do manuscrito; obtenção, análise e interpretação dos dados; revisão crítica do manuscrito.
Ana Maria Roselino: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica do manuscrito.
Conflito de interessesNenhum.
Agradecemos a Aline Lobo de Oliveira, MSc, e Daniela Francisca Nascimento, PhD, pela ajuda na coleta de amostras de cabelo. Agradecemos ao grupo técnico laboratorial pediátrico e ao corpo clínico dos ambulatórios de dermatoses autoimunes do Hospital Universitário da Faculdade de Medicina de Ribeirão Preto, Universidade de São Paulo, Ribeirão Preto, São Paulo, Brasil.
Como citar este artigo: La Serra L, Salathiel AM, Lanaro R, Martinis B, Roselino AM. Measurement of pesticides in hair samples from pemphigus foliaceous and pemphigus vulgaris patients in Southeastern Brazil. An Bras Dermatol. 2023;98:644–50.
Trabalho realizado na Divisão de Dermatologia, Hospital Universitário da Faculdade de Medicina de Ribeirão Preto, Ribeirão Preto, SP, Brasil.