As infecções sexualmente transmissíveis representam problema global de saúde pública. As uretrites estão entre as doenças mais comuns desse grupo de enfermidades, e podem ocasionar diversas complicações e facilitar a transmissão do vírus HIV.
ObjetivosInvestigar os principais agentes etiológicos causadores de uretrite em 170 homens atendidos na Fundação Alfredo da Matta.
MétodosPara a identificação dos agentes, foram colhidos exsudato uretral e urina. Foram realizados exame de Gram e cultura em meio de Thayer‐Martin para Neisseria gonorrhoeae e reação de polimerase em cadeia para Neisseria gonorrhoeae, Chlamydia trachomatis, Trichomonas vaginalis, Ureaplasma urealyticum, Ureaplasma parvum, Mycoplasma hominis, Mycoplasma genitalium e herpes simples tipos1e2.
ResultadosForam identificados N. gonorrhoeae em 102 (60,0%) pacientes,C. trachomatis em 50 (29,4%), U. urealyticum em 29 (17,0%), M. genitalium em 11 (6,5%), U. parvum em 10(5,9%) e M. hominis em sete(4,1%) pacientes. Herpes simples tipo 2 foi diagnosticado em 24 (21,6%) dos 111 pacientes que realizaram PCR para esse patógeno. Em 69casos havia coinfecção; as mais frequentes foram: N. gonorrhoeae e C. trachomatis em 21(14,7%) enfermos; N. gonorrhoeae e C. trachomatis em 21 (12,4%); N. gonorrhoeae e herpes simples tipo2 em 11 (6,5%) e N. gonorrhoeae e U. urealyticum em nove (5,3%) indivíduos.
Limitações do estudoNão relevante.
ConclusãoN. gonorrhoeae, C. trachomatis, U. urealyticum e herpes simples tipo2 foram os agentes patogênicos identificados com maior frequência no presente estudo. A principal coinfecção encontrada foi N. gonorrhoeae e C. trachomatis. T. vaginalis e herpes simples tipo1 não foram identificados em nenhum dos pacientes.
As infecções sexualmente transmissíveis (IST) representam problema global de saúde pública. Segundo estimativas da Organização Mundial da Saúde (OMS), mais de um milhão de pessoas adquirem uma IST diariamente. Em 2016, houve 376 milhões de novos casos de infecção por Chlamydia trachomatis, Neisseria gonorrhoeae, Treponema pallidum e Trichomonas vaginalis.1
As IST são afecções contagiosas, transmitidas principalmente por relação sexual. Dentre os agentes causadores das IST, destacam‐se bactérias, fungos e protozoários. As IST podem estar associadas a infertilidade masculina e feminina, câncer, doença inflamatória pélvica, prostatite, epididimite e outras complicações.1,2 É bem conhecida a importância das IST como cofator na transmissão do vírus da imunodeficiência humana (HIV). Vários estudos evidenciaram a associação entre corrimento uretral, úlceras genitais e condiloma com o aumento do risco de transmissão do HIV e modificação da evolução dessas infecções.3–7 Dentre as IST, a uretrite é uma das enfermidades mais comuns.1 Na África do Sul, estima‐se que, em 2017, ocorreram 1,42 milhão de casos de uretrite masculina causados pelo N. gonorrhoeae e 1,28 milhão por C. trachomatis.8
A uretrite é definida como inflamação da uretra, acompanhada ou não de exsudato uretral e, ao exame microscópico do esfregaço, presença de mais de cinco polimorfonucleares por campo examinado.2 Entre os fatores de risco para as uretrites estão: idade, entre 20 e 35 anos, multiplicidade de parceiros, Homens que fazem Sexo com Homens (HSH) e indivíduos com antecedente de IST.1,3–9 Os agentes mais comuns das uretrites são C. trachomatis, N. gonorrhoeae, T. vaginalis, Ureaplasma urealitycum e Mycoplasma genitalium.2,5,6,9,10M. hominis, U. parvum, herpes‐vírus tipo 2, Haemophilus influenza e adenovírus também têm sido associados à etiologia das uretrites em homens.11–13 No Brasil, há poucas investigações sobre a etiologia das uretrites. Estudo multicêntrico realizado em 1995 em Manaus, Recife, Belo Horizonte, São Paulo e Porto Alegre com 473 homens identificou, por meio de exame de Gram e cultura para gonococo, N. gonorrhoeae em 44% das amostras, C. trachomatis em 7%, N. gonorrhoeae em associação com C. trachomatis em 11% e T. vaginalis em 2%.14 Dez anos depois, por meio de novo estudo com 767 homens apresentando IST, residentes em São Paulo, Rio de Janeiro, Porto Alegre, Goiânia, Fortaleza e Manaus, verificou‐se, por meio do exame de Reação de Polimerase em Cadeia (PCR), em amostras de urina, a presença de N. gonorrhoeae em 18,4% e C. trachomatis em 13,1% das amostras.15
Estudo conduzido em Manaus identificou, dentre 800 pacientes do sexo masculino com corrimento uretral, N. gonorrhoeae em 42,7% dos casos, C. trachomatis em 10,7%, infecção pelos dois patógenos em 7,3%; em 39,3% dos enfermos, o agente etiológico não foi identificado.16
Face ao reduzido número de investigações relativas às uretrites no Brasil, decidiu‐se conduzir estudo para identificar os agentes etiológicos de 170 pacientes do sexo masculino com corrimento uretral. Os resultados dos principais aspectos relacionados a idade, fatores de risco, agentes etiológicos e coinfecções são apresentados neste trabalho.
MétodosEstudo transversal descritivo e exploratório, realizado no período de novembro de 2015 a maio de 2016 em pacientes atendidos na Fundação Alfredo da Matta (FUAM), centro de referência para diagnóstico e tratamento de IST no estado do Amazonas. Foram incluídos pacientes do sexo masculino com corrimento uretral, sem tratamento prévio com antibiótico.
Quanto aos aspectos clínicos, seguiu‐se a orientação do Ministério da Saúde, avaliando‐se a presença de exsudato uretral. Dados como idade da primeira relação sexual, orientação sexual, número de parceiros nos últimos três meses, história pregressa de IST, uso de medicamentos e frequência de utilização de preservativos também foram inseridos no protocolo configurado para esse projeto.2
Após o exame clínico, foi realizada punção digital para os seguintes testes rápidos: HIV, lues, hepatites B e C. Em caso de positividade do teste rápido para sífilis, colheu‐se sangue para venereal disease research laboratory (VDRL).2 Os testes rápidos para HIV foram realizados com o kit Tri Line (Bioclin) e o kit Imunoblot rápido HIV (Biomanguinhos). Para testagem rápida de sífilis, empregou‐se o kit Alere sífilis (Alere‐Abbott); para o VDRL, utilizou‐se reagente da marca Laborclin. Os kits Alere HCV (Alere‐Abbott) e Vikia HBsAg (Biomérieux) foram utilizados para os testes rápidos de hepatites B e C.
No mesmo dia do primeiro atendimento do paciente, foram coletadas duas amostras de exsudato uretral. Esse procedimento foi executado com o kit Digene (hc2 DNA Collection Device). Uma das amostras foi enviada para o laboratório da FUAM para a realização dos exames de Gram, cultura em meio de Thayer‐Martin e PCR para herpes simples (HSV) tipos 1 e 2. A outra amostra foi enviada para o laboratório conveniado, em Manaus, para realização de PCR para M. genitalium, M. hominis, U. urealyticum, U. parvum, T. vaginalis, N. gonorrhoeae e C. trachomatis.
A amostra de urina foi coletada duas horas após a obtenção do exsudato uretral. Os pacientes foram orientados para, no momento da coleta da urina, recolher o prepúcio, desprezar o primeiro jato e coletar o jato médio. O material foi mantido refrigerado, a 7°C, até o envio ao laboratório conveniado.
Todos os pacientes foram tratados com azitromicina 1g, em dose única, e ciprofloxacino 500mg, também em dose única. No período de realização do estudo, o ciprofloxacino era o tratamento de primeira escolha para o N. gonorrhoeae.2 Nos casos de persistência dos sintomas após sete dias, foram utilizados os medicamentos de segunda linha, indicados para o tratamento do corrimento uretral masculino.2
Este estudo foi aprovado pelo Comitê de Ética em Pesquisa da FUAM (CAAE52491215.2.0000.0002). Todos os pacientes assinaram termo de consentimento livre e esclarecido.
ResultadosForam incluídos 170 pacientes no estudo. A idade média dos enfermos era 27,7 anos e verificou‐se que 96 (57,5%) casos iniciaram a vida sexual entre 15 e 19 anos de idade. Em relação ao número de parceiros nos últimos três meses, 60 (35,3%) declararam ter tido apenas um parceiro; 56 (32,9%) tiveram dois a quatro; 36 (21,2%) indivíduos tiveram mais de cinco, e 18 (10,6%) informaram não ter tido parceiro nesse período (tabela 1). Sobre a frequência do uso de preservativo durante as relações sexuais, 167 enfermos responderam a esse item do questionário: 128 (76,6%) utilizavam‐no eventualmente, e 32 (19,2%) nunca o usaram. Dentre os que referiram orientação sexual, 151 (90,4%) eram heterossexuais, nove (5,4%) declararam‐se HSH e sete (4,2%) eram bissexuais (tabela 1).
Aspectos epidemiológicas de pacientes do sexo masculino com uretrite atendidos no ambulatório de IST da FUAM
| Características | n* | % |
|---|---|---|
| Faixa etária | ||
| <20 | 31 | 18,2 |
| 20 a 29 | 80 | 47,1 |
| 30 a 39 | 38 | 22,4 |
| 40 a 49 | 17 | 10,0 |
| >49 | 4 | 2,4 |
| Idade da 1ª relação | (n=167) | |
| <15 | 66 | 39,5 |
| 15 a 19 | 96 | 57,5 |
| 20 a 23 | 5 | 3,0 |
| Não informados=3 | ||
| Parceiros nos últimos três meses | ||
| Nenhum | 18 | 10,6 |
| 1 | 60 | 35,3 |
| 2 a 4 | 56 | 32,9 |
| ≥ 5 | 36 | 21,2 |
| Uso de preservativo | (n=167) | |
| Em todas as relações | 7 | 4,2 |
| Às vezes | 128 | 76,6 |
| Não usa | 32 | 19,2 |
| Não informados=3 | ||
| Orientação sexual | (n=167) | |
| HSH ativo | 1 | 0,6 |
| HSH passivo | 2 | 1,2 |
| HSH ativo/passivo | 6 | 3,6 |
| Bissexual | 7 | 4,2 |
| Heterossexual | 151 | 90,4 |
| Não informados=3 | ||
| Passado venéreo | ||
| Sim | 94 | 55,3 |
| Não | 76 | 44,7 |
| *n=170 | ||
Do total de pacientes incluídos no estudo, 94 (55,3%) referiam IST pregressa – 76 (75,2%) com histórico de corrimento uretral, 12 (11,9%) informavam ter tido condiloma, oito (7,9%) referiam herpes, três (3,0%) tiveram sífilis e dois (2,0%), úlcera genital de etiologia desconhecida.
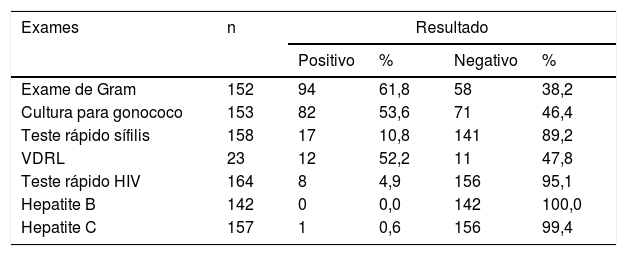
O exame de Gram foi realizado em 152 pacientes; desses, 94 (61,8%) tiveram resultado positivo para N.gonorrhoeae. A cultura para N.gonorrhoeae foi realizada em 153 pacientes; foi positiva em 82 (53,6%) casos e negativa em 71 (46,4%) (tabela 2).
Resultados de exame de Gram, cultura para N.gonorrhoeae, testes para sífilis, HIV, hepatite B, hepatite C e VDRL em pacientes do sexo masculino com corrimento uretral atendidos no ambulatório de IST da FUAM
| Exames | n | Resultado | |||
|---|---|---|---|---|---|
| Positivo | % | Negativo | % | ||
| Exame de Gram | 152 | 94 | 61,8 | 58 | 38,2 |
| Cultura para gonococo | 153 | 82 | 53,6 | 71 | 46,4 |
| Teste rápido sífilis | 158 | 17 | 10,8 | 141 | 89,2 |
| VDRL | 23 | 12 | 52,2 | 11 | 47,8 |
| Teste rápido HIV | 164 | 8 | 4,9 | 156 | 95,1 |
| Hepatite B | 142 | 0 | 0,0 | 142 | 100,0 |
| Hepatite C | 157 | 1 | 0,6 | 156 | 99,4 |
O teste rápido para sífilis foi realizado em 158 enfermos: 17 (10,8%) foram reagentes. Fez‐se VDRL de 23 pacientes, dos quais 12 (52,2%) apresentaram resultado reagente.
Dentre os 164 pacientes que realizaram teste rápido para HIV, oito (4,9%) foram positivos. Um (0,6%) dos 157 pacientes que fizeram sorologia para hepatite C foi positivo, e a sorologia para hepatite B foi negativa em todos os 142 submetidos a esse exame (tabela 2).
A PCR, realizada no exsudato uretral, identificou N. gonorrhoeae em 102 (60,0%) enfermos, C. trachomatis em 50 (29,4%), U. urealyticum em 29 (17,0%), M. genitalium em 11 (6,5%), U. parvum em 10 (5,9%) e M. hominis em sete (4,1%). T. vaginalis não foi identificado em nenhuma das amostras testadas. Em 23 (13,5%) indivíduos, não foi identificado nenhum dos patógenos testados. A PCR para HSV‐2 foi realizada em 111 pacientes, e foi positiva em 24 (21,6%) amostras examinadas. A frequência dos patógenos identificados, isoladamente e em associação a outros, está listada na tabela 3.
Agentes etiológicos e coinfecções identificados pela PCR nas amostras de exsudato uretral de170 pacientes do sexo masculino com corrimento uretral atendidos no ambulatório de IST da FUAM
| Agentes etiológicos | n* | % |
|---|---|---|
| N. gonorrhoeae | 46 | 27,1 |
| N. gonorrhoeae e C. trachomatis | 21 | 12,4 |
| C. trachomatis | 13 | 7,6 |
| N. gonorrhoeae e HSV tipo 2 | 11 | 6,5 |
| N. gonorrhoeae e U. urealyticum | 9 | 5,3 |
| U. urealyticum | 7 | 4,1 |
| M. genitalium | 5 | 2,9 |
| U. parvum | 5 | 2,9 |
| N. gonorrhoeae, C. trachomatis e HSV 2 | 4 | 2,4 |
| C. trachomatis e U. urealyticum | 3 | 1,8 |
| HSV tipo 2 | 2 | 1,2 |
| M. genitalium e U. urealyticum | 2 | 1,2 |
| N. gonorrhoeae, U. parvum e HSV 2 | 2 | 1,2 |
| N. gonorrhoeae, C. trachomatis e U. urealyticum | 2 | 1,2 |
| U. urealyticum e M. hominis | 3 | 1,8 |
| C. trachomatis e HSV 2 | 1 | 0,6 |
| C. trachomatis, M. hominis e M. urealyticum | 1 | 0,6 |
| C. trachomatis, M. genitalium | 1 | 0,6 |
| C. trachomatis, M. genitalium e HSV 2 | 1 | 0,6 |
| N. gonorrhoeae, M. hominis, U. parvum e HSV 2 | 1 | 0,6 |
| N. gonorrhoeae e M. genitalium | 1 | 0,6 |
| N. gonorrhoeae, U. parvum e M. hominis | 1 | 0,6 |
| N. gonorrhoeae, U. urealyticum e HSV 2 | 1 | 0,6 |
| N. gonorrhoeae, C. trachomatis e M. genitalium | 1 | 0,6 |
| N. gonorrhoeae, C. trachomatis e M. hominis | 1 | 0,6 |
| N. gonorrhoeae, C. trachomatis e U. parvum | 1 | 0,6 |
| U. urealyticum e HSV 2 | 1 | 0,6 |
| Nenhum agente | 23 | 13,5 |
| *n=170 |
Em 21 (12,4%) pacientes foi identificada, pela PCR, nas amostras de exsudato uretral, associação de N. gonorrhoeae e C. trachomatis. Desse modo, 80 (47%) pacientes apresentavam infecção por N. gonorrhoeae e C. trachomatis, isoladamente ou em associação. Oito (4,7%) pacientes apresentaram coinfecção desses dois micro‐organismos com mais um terceiro patógeno (tabela 3).
As outras coinfecções mais frequentes foram: N. gonorrhoeae e HSV tipo 2 em 11 (6,5%) pacientes; N. gonorrhoeae e U. urealyticum em nove (5,3%); N. gonorrhoeae, C. trachomatis e HSV tipo 2 em quatro (2,4%) e C. trachomatis e U. urealyticum em três (1,8%) (tabela 3).
Dentre o total de pacientes incluídos no trabalho, o exame de PCR foi realizado nas amostras de urina de 47 pacientes. N. gonorrhoeae foi identificado em 25 (53,2%) pacientes, C. trachomatis em 11 (23,4%), U. urealyticum em três (6,4%), M. genitalium em dois (4,3%) e U. parvum em um (2,1%). Os patógenos M. hominis e T. vaginalis não foram identificados em nenhuma das amostras. Em cinco pacientes (10,6%), os exames foram negativos.
Com a finalidade de verificar as taxas de concordância entre os testes microbiológicos convencionais, exame de Gram e cultura para N. gonorrhoeae com a PCR (em exsudato) para o mesmo agente etiológico, foram considerados todos os 152 e 153 pacientes que realizaram ambos os métodos convencionais, respectivamente. Em relação ao exame de Gram e PCR para N. gonorrhoeae, foi observado coeficiente de Kappa de concordância de 0,83 (concordância quase perfeita e significativa; p <0,0001). Resultado semelhante foi verificado entre cultura e PCR para N. gonorrhoeae: 0,87 (concordância quase perfeita e significativa; p <0,0001).
Foi realizada ainda análise das taxas de concordância entre os testes diagnósticos de PCR nas diferentes amostras clínicas coletadas, exsudato uretral e urina. Para essa análise, foram considerados os 47 pacientes que realizaram ambos os métodos diagnósticos. Concordância quase perfeita e significativa foi identificada para M. genitalium (100%) e N. gonorrhoeae (87,1%); forte e significativa para C. trachomatis (68,4%); moderada e significativa para U. urealyticum (56,1%); e razoável para U. parvum (56,1%) (p <0,0001).
Dentre os 170 pacientes incluídos no estudo, 100 (58,8%) ficaram curados com o tratamento de primeira linha. Em três (1,8%) enfermos foi empregada medicação de segunda linha com resolução clínica do quadro; um (0,6%) paciente não respondeu às medicações de primeira e segunda linhas, e 66 (38,8%) não retornaram sete dias após a administração do tratamento de primeira linha, o que foi considerado como abandono de tratamento.
Não foi observada significância estatística nos resultados dos exames laboratoriais para os três principais agentes etiológicos das uretrites entre os pacientes com diferentes orientações sexuais.
Em relação ao comportamento das quatro variáveis referidas como de maior vulnerabilidade para IST (idade, orientação sexual, número de parceiros sexuais e passado venéreo), verificou‐se que idade inferior a 30 anos constituiu fator de risco maior para a infecção por N. gonorrhoeaeOdds ratio (OR)=3,08; intervalo de confiança (IC) 95% (p=0,001).2,15
DiscussãoDe acordo com a revisão bibliográfica realizada, este é o primeiro estudo brasileiro em que a PCR foi utilizada para a identificação dos principais agentes etiológicos de corrimento uretral em homens.13–15 Dentre os principais fatores de risco para as IST, estão: idade entre 20 e 35 anos, multiplicidade de parceiros, relacionamento HSH e história pregressa de IST, especialmente uretrite.1,2,5,17 Os achados da presente investigação corroboram essas observações; a maioria dos pacientes relatava uso eventual de preservativo(76,6%), história pregressa de IST(55,3%) e mais de um parceiro sexual nos últimos três meses(54,1%).
A coinfecção com o HIV foi diagnosticada em oito (4,9%) pacientes estudados. Sabe‐se que a presença ou história pregressa de corrimento uretral aumenta a chance de transmissão de HIV nos homens.3,4,7 Na Cidade do Cabo e em Johanesburgo, África do Sul, a incidência de HIV nessa população foi de 23,8% e 38,6%, respectivamente.6 Na Índia, 32,2% dos pacientes estavam coinfectados com HIV no momento do diagnóstico do corrimento uretral.9 No Zimbábue, 28,5% dos homens com corrimento uretral apresentavam HIV; no entanto, dentre os homens com úlcera genital, a coinfecção foi maior: 45,2%.18 Nos países desenvolvidos, tais como Itália, a coinfecção com o HIV em homens com uretrite foi menos frequente(4,1%).19
Em 152 enfermos, além da PCR, fez‐se esfregaço para a identificação de diplococos Gram‐negativos, verificando‐se positividade em 94 (61,8%); 153 fizeram cultura, em meio de Thayer‐Martin, com crescimento de N. gonorrhoeae em 82 (53,4%) casos. É importante enfatizar que, no presente estudo, sem o uso da PCR, a coinfecção com outros patógenos não seria diagnosticada em 56 (33%) pacientes, e, em 68 (40%) enfermos, não haveria identificação do agente etiológico da uretrite.
Os agentes etiológicos de corrimento uretral identificados com maior frequência por meio da PCR, isoladamente ou associados, foram N. gonorrhoeae e C. trachomatis. Esses agentes foram observados nas amostras de 131 (77,05%) pacientes: 46 (27,05%) eram só portadores de N. gonorrhoeae e 13 (7,6%) tinham apenas C. trachomatis. Esses resultados são similares aos relatados na Índia, África do Sul, Zimbábue e Israel.5,8,9,20 Em países desenvolvidos, como os Estados Unidos, Japão, Austrália, Estônia e Inglaterra, C. trachomatis é mais frequente que N. gonorrhoeae.9,21–26 A associação entre N. gonorrhoeae e C. trachomatis foi identificada em 12,4% da amostra estudada. Esse achado é superior aos identificados em estudos realizados nos Estados Unidos (5,9%), Israel (5,9%) e comunidades aborígenes da Austrália(4,1%).20,21,27 Essa associação foi encontrada com maior frequência no Zimbábue (24,5%) e na Itália (30,1%).5,19
No presente estudo, além das bactérias N. gonorrhoeae e C. trachomatis, foram identificados, em amostras de exsudato uretral, isoladamente ou em associação com outros patógenos: U. urealitycum (29 pacientes; 17%), M. genitalium (11 pacientes; 6,5%), U. parvum (10 pacientes; 5,9%) e M. hominis (sete pacientes; 4,1%).
Dentre os 170 pacientes da presente investigação, foram identificadas outras coinfecções, tais como N. gonorrhoeae e HSV tipo 2 (11 pacientes; 6,5%), N. gonorrhoeae e U. urealyticum (nove pacientes; 5,3%), N. gonorrhoeae, C. trachomatis e HSV tipo 2 (quatro pacientes; 2,4%) e C. trachomatis associado a U. urealyticum (três pacientes; 1,8%). Associações de T. vaginalis com N. gonorrhoeae e C. trachomatis; M. genitalium e N. gonorrhoeae; M.genitalium e C.trachomatis; e C. trachomatis e U. urealyticum já foram demonstradas em casos de corrimento uretral.21,27–29 Bactérias dos gêneros Mycoplasma e Ureaplasma têm sido identificadas como importantes causas de uretrite não gonocócica (UNG), particularmente M. genitalium e U. urealyticum.8,28,30–34 Em relação às demais espécies de Mycoplasma e Ureaplasma, ainda persistem dúvidas do papel etiopatogênico dessas nas uretrites.33,35
Em estudos com grupos de pacientes com uretrite e sadios, identificou‐se U. parvum e M. hominis, em ambos os grupos, em proporções semelhantes.28,32 Apesar da ambiguidade do papel etiopatogênico de U. parvum, estudo realizado com pacientes sintomáticos e assintomáticos, com PCR positiva para esse patógeno na urina, verificou correlação positiva entre o número de cópias de genes 16 S rRNA de U. parvum e contagem de polimorfonucleares na urina.33 No presente estudo, não é possível definir se M. hominis e U. parvum são, realmente, causadores de uretrites. É importante ressaltar que U. parvume M. hominis fazem parte da microbiota da uretra.30,33 Portanto, outros estudos são necessários.
Dentre os 111 pacientes com corrimento uretral que realizaram PCR para HSV tipo 2, esse exame foi positivo em 24 (21,6%) enfermos, isoladamente ou em associação com outros patógenos. Na literatura, há relatos de que esses pacientes tendem a apresentar inflamação do meato urinário, disúria, ulceração genital e linfadenopatia inguinal; a presença de exsudato uretral é menos comum quando comparada a pacientes com uretrite causada por C. trachomatis.36,37
A ausência de identificação de T. vaginalis pela PCR, dentre as amostras dos 170 pacientes investigados, deve ser ressaltada. No Malawi, esse patógeno foi identificado em 17,3% dos casos estudados.38 No Japão, na Inglaterra e no Brasil, T. vaginalis é raramente identificado nos pacientes com uretrite.9,14,39 Resultado semelhante à presente pesquisa foi relatado em Israel, por Gottemann et al.; neste estudo, não foi identificado nenhum caso de corrimento uretral causado por T. vaginalis.20 O papel etiopatogênico desse patógeno nas uretrites é controverso.
Atualmente, no Brasil, a ceftriaxona e a azitromicina são empregadas como tratamento de primeira linha para o corrimento uretral em pacientes do sexo masculino. A ceftriaxona tem ação sobre N. gonorrhoeae, e a azitromicina, sobre C. trachomatis, patógenos identificados em 131 (77%) pacientes do presente estudo.2 Deve‐se salientar que a azitromicina também tem ação sobre U. urealitycum e U. parvum.40 No presente estudo, essas duas bactérias foram identificadas em 13 (7,6%) enfermos. Portanto, a combinação de substâncias utilizadas no estudo seria, teoricamente, eficaz em mais de 84% da presente amostra. Face à elevada taxa de pacientes que não retornaram após o tratamento (38,8%), essa constatação não pôde ser observada.
A escolha do método diagnóstico das uretrites dependerá do contexto em que o paciente for atendido. Porém, quando houver disponibilidade, o exame de PCR é o ideal pelo fato de, no mesmo material, serem investigados os demais agentes que podem estar associados a N. gonorrhoeae ou, isoladamente, causar UNG. A cultura, em meio de Thayer‐Martin, também é importante para a identificação de N. gonorrhoeae, particularmente nos casos com dúvida diagnóstica.
Dentre os pacientes que realizaram PCR nas amostras de exsudato uretral e urina, a concordância entre os resultados foi quase perfeita e significativa na identificação dos patógenos N. gonorrhoeae e M. genitalium, e forte para C. trachomatis. A PCR na urina vem sendo realizada em vários centros, e é um exame factível quando não há exsudato uretral evidente.30,33,35
ConclusõesDe acordo com os dados obtidos, verificou‐se, nesta investigação, que os exames de biologia molecular, tais como a PCR, são importantes para o rápido e preciso diagnóstico dos agentes etiológicos das uretrites gonocócicas e não gonocócicas. Esses procedimentos possibilitam, também, o diagnóstico de coinfecções e tratamento adequado dos pacientes que não respondem às recomendações preconizadas nos fluxogramas para a abordagem sindrômica dos corrimentos uretrais.
No presente trabalho, demonstrou‐se a presença de N. gonorrhoeae e C. trachomatis, isolados ou em associação, em 47% das amostras. Em 77% das amostras, esses agentes foram identificados, isoladamente, em associação entre si e com outros patógenos, o que justifica a manutenção da ceftriaxona e azitromicina como medicamentos de primeira linha no esquema terapêutico do corrimento uretral no Brasil. Face ao aumento dos casos de resistência do N. gonorrhoeae ao ciprofloxacino, esse antibiótico foi substituído pelo ceftriaxona em 2018.2
Os achados deste estudo indicam não haver necessidade de tratamento para T. vaginalis nos casos de falha terapêutica com a abordagem sindrômica, pois o mesmo não foi isolado em nenhum dos pacientes. Novos estudos são necessários para a comprovação desse achado.
Aspectos éticosEste estudo foi aprovado pelo Comitê de Ética em Pesquisa da FUAM (CAAE 52491215.2.0000.0002). Todos os pacientes assinaram termo de consentimento livre e esclarecido.
Suporte financeiroNenhum.
Contribuição dos autoresLucilene Sales de Souza: Concepção e o desenho do estudo; levantamento dos dados, ou análise e interpretação dos dados; redação do artigo; revisão crítica do conteúdo intelectual; aprovação final da versão a ser enviada.
José Carlos Sardinha: Concepção e o desenho do estudo; análise e interpretação dos dados; revisão crítica do conteúdo intelectual; aprovação final da versão a ser enviada.
Sinésio Talhari: Concepção e o desenho do estudo; análise e interpretação dos dados; redação do artigo; revisão crítica do conteúdo intelectual; aprovação final da versão a ser enviada.
Marcel Heibel: Levantamento dos dados; análise e interpretação dos dados; revisão crítica do conteúdo intelectual; aprovação final da versão a ser enviada.
Mônica Nunes dos Santos: Análise e interpretação dos dados; revisão crítica do conteúdo intelectual; aprovação final da versão a ser enviada.
Carolina Talhari: Concepção e o desenho do estudo; análise e interpretação dos dados; redação do artigo; revisão crítica do conteúdo intelectual; aprovação final da versão a ser enviada.
Conflito de interessesO laboratório Sabin realizou os exames de PCR para a detecção de M. genitalium, Mycoplasma hominis, U. urealyticum, Ureaplasma parvum, T. vaginalis, N. gonorrhoeae e C. trachomatis.
Ao Laboratório Sabin, pela realização dos exames de PCR para a detecção de M. genitalium, Mycoplasma hominis, U. urealyticum, Ureaplasma parvum, T. vaginalis, N. gonorrhoeae e C. trachomatis. Os autores agradecem, ainda, ao Dr. Francisco Helder Cavalcante, pelo estímulo dado a essa pesquisa enquanto Diretor‐Presidente da FUAM.
Como citar este artigo: Souza LS, Sardinha JC, Talhari S, Heibel M, Santos MN, Talhari C. Main etiological agents identified in 170 men with urethritis attended at the Fundação Alfredo da Matta, Manaus, Amazonas, Brazil. An Bras Dermatol. 2021;96:176–83.
Trabalho realizado na Fundação Alfredo da Matta e Universidade do Estado do Amazonas, Manaus, AM, Brasil.