A incidência de melanoma está crescendo em todo o mundo. O melanoma é responsável pela maioria das mortes relacionadas ao câncer de pele.1 Pacientes com melanoma passam por consultas de seguimento principalmente para evitar a progressão da doença.2 Além disso, o diagnóstico de melanoma tem sido relatado como fator de risco para o desenvolvimento subsequente de outro melanoma.3 A maioria dos pacientes com melanomas primários múltiplos (MPM) tem dois tumores primários, e apenas uma pequena parte deles apresenta três ou mais melanomas primários (3MP). A literatura é quase exclusivamente concentrada no grupo de pacientes com MPM, e não aborda pacientes com mais de dois tumores primários.4
Os autores utilizaram um banco de dados de pacientes em seguimento com melanoma no Departamento de Dermatovenereologia do Hospital Universitário (Pilsen, República Tcheca) para encontrar uma coorte de pacientes com MPM. Os autores se concentraram em pacientes com 3MP para analisá‐los em detalhes no âmbito do estudo retrospectivo.
Os dados de interesse foram sexo, idade na excisão do primeiro melanoma, número total de melanomas primários removidos, intervalo de tempo entre as excisões cirúrgicas de MPMs, classificação histopatológica de todos os melanomas (classificação AJCC no momento da excisão do tumor), localização dos melanomas (cabeça/pescoço, tronco, membros superiores, membros inferiores, outros), desenvolvimento de metástases nodais e/ou a distância durante o seguimento. Histórico de melanoma na família (até parentes próximos de segundo grau), coincidência com outro tipo de câncer, fototipo (I–IV de acordo com a classificação de Fitzpatrick), três ou mais episódios de queimadura solar na infância (sim/não/não sabe) e o número e as características dos nevos melanocíticos no tronco e nas partes proximais das extremidades (grupo 0 – sem nevos; grupo I – até 20 nevos; grupo II – até 50 nevos; grupo III,– mais de 50 nevos comuns; grupo IV – mais de 50 nevos de aparência clínica diferente, incluindo nevos atípicos) também foram investigados.
Foram identificados 3.641 pacientes em seguimento por melanoma confirmado histopatologicamente no banco eletrônico de dados do departamento, para os quais todas as informações necessárias estavam disponíveis. Foram encontrados 201 pacientes com MPM entre eles, o que representa 5,52% da coorte. Dois melanomas primários foram excisados em 161 pacientes, e 3MP nos 40 pacientes restantes (1,10% de toda a coorte e 19,90% do grupo MPM).
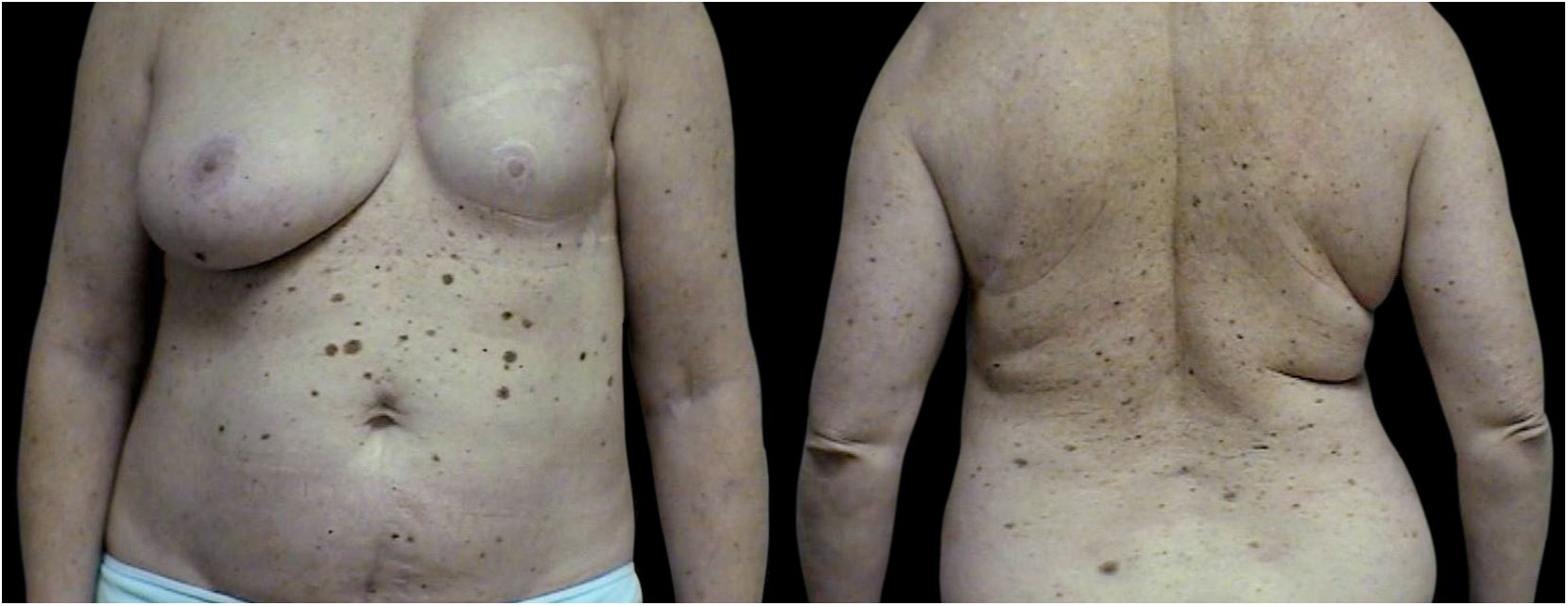
O grupo 3MP (40 pacientes) consistiu em 24 pacientes com três melanomas primários, oito pacientes com quatro tumores primários, quatro pacientes com cinco tumores primários, um paciente com seis tumores primários e três pacientes com sete melanomas primários (figs. 1 a 3).
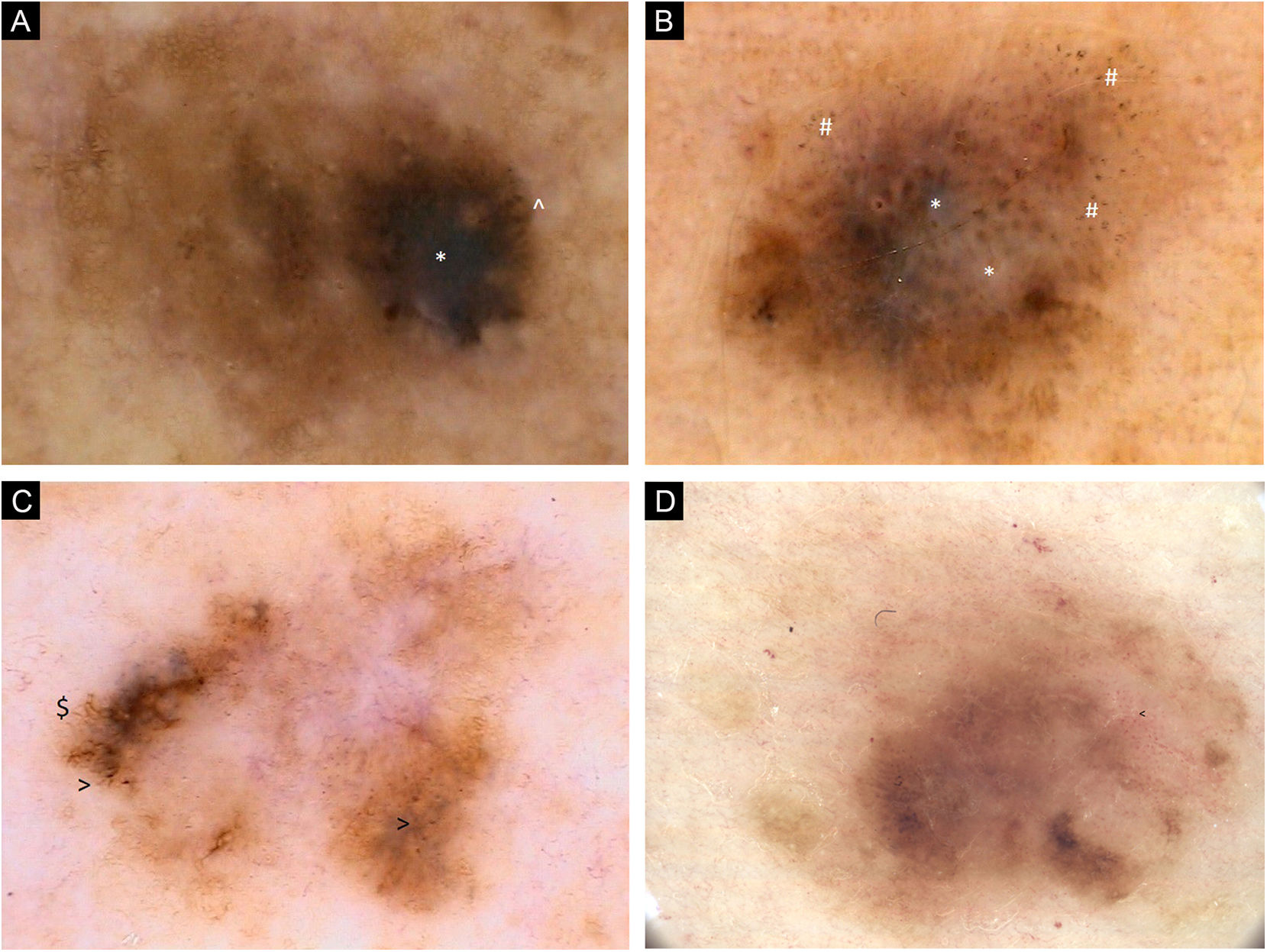
(A) Imagens dermatoscópicas de sete melanomas primários individuais. 2006, melanoma de 0,6mm, extremidade superior. Lesão caótica, rede pigmentar residual, área hiperpigmentada excêntrica com véu cinza‐azulado (*) e glóbulos pigmentados (^) na periferia. (B) Imagens dermatoscópicas de sete melanomas primários individuais. 2008, melanoma de 0,8mm, extremidade superior. Lesão caótica, áreas de regressão com estruturas branco‐azuladas (*) e pontos acinzentados (peppering, #). (C) Imagens dermatoscópicas de sete melanomas primários individuais. 2011, melanoma in situ, tronco. Lesão caótica, hipopigmentação central, rede pigmentar residual. Estrias radiadas ($) e pontos pigmentados na periferia (>). (D) Imagens dermatoscópicas de sete melanomas primários individuais. 2017, melanoma de 0,5mm, tronco. Lesão caótica, principalmente áreas sem estrutura, áreas multifocais de hiperpigmentação, vasos com padrão pontilhado (<)
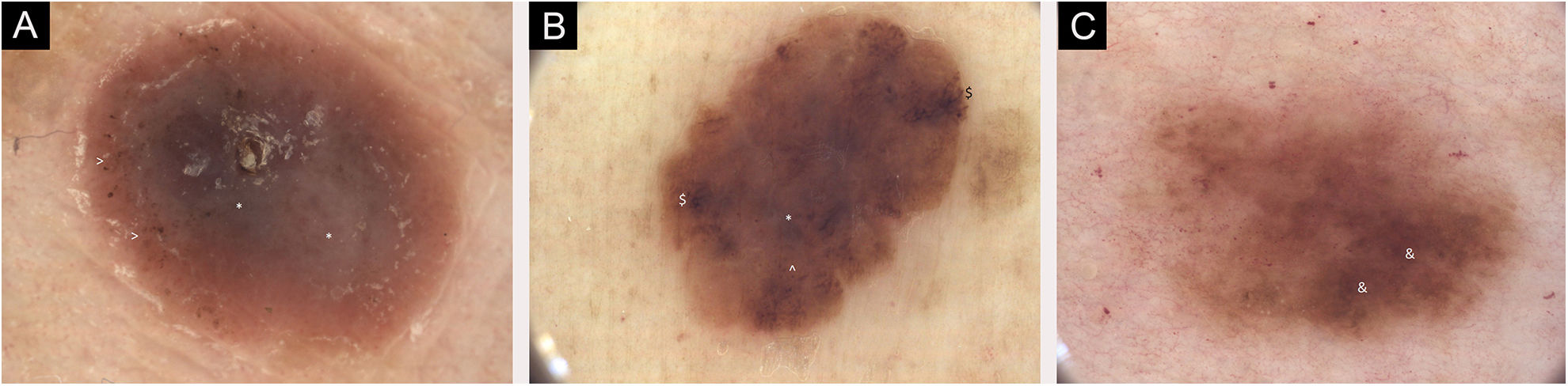
(A) Imagens dermatoscópicas de sete melanomas primários individuais. 2018, melanoma de 1,0mm, extremidade inferior. Principalmente áreas sem estrutura, centrais Estruturas azul‐esbranquiçadas, periféricas (*) e pontos pigmentados, de cor rosa (>). (B) Imagens dermatoscópicas de sete melanomas primários individuais. 2019, melanoma de 0,3mm em extremidade inferior. Lesão caótica, áreas sem estrutura, estrias radiadas ($), glóbulos pigmentados na periferia (^) e véu azul‐acinzentado central (*). (C) Imagens dermatoscópicas de sete melanomas primários individuais. 2020, melanoma de 0,1mm, no tronco. Lesão caótica com áreas hiperpigmentadas (&) e rede pigmentar acentuada. O seguimento dermatoscópico digital e as imagens de corpo inteiro foram úteis em algumas decisões sobre a excisão dos melanomas finos
O grupo consistiu em 26 homens (65,00%) e 14 mulheres (35,00%) com média de idade de 57,48 anos (intervalo de 24 a 77 anos) no momento da excisão do primeiro melanoma. O histórico familiar foi positivo para melanoma em 12 pacientes (30,00%). Todos os fototipos I?IV estavam representados; 35 pacientes (87,50%) sofreram queimaduras solares repetidas na infância. Pacientes com 3MP tendem a ter alto número de nevos melanocíticos; 21 pacientes (52,50%; grupo IV) apresentaram nevos melanocíticos múltiplos e clinicamente atípicos.
Melanomas primários subsequentes mais finos são geralmente removidos em pacientes 3MP (1° melanoma – 22,50% in situ, 40,00% estádio I, 37,50% estádio II; 2° melanoma – 57,50% in situ, 37,50% estádio I, 5,00% estádio II; 3° melanoma – 70,00% in situ, 27,50% estádio I, 2,50% estádio II). Melanomas múltiplos in situ foram excisados em apenas cinco pacientes (três tumores em três pacientes e quatro tumores em dois pacientes). Dezenove pacientes (47,50%) haviam excisado apenas melanomas in situ ou estádio IA.
O primeiro melanoma localizou‐se mais frequentemente no tronco (19 pacientes, 47,50%); em nove casos (22,50%), todos os melanomas primários ocorreram na mesma região.
O primeiro e o segundo melanomas no mesmo paciente foram frequentemente removidos de forma síncrona (intervalo de 0‐2 meses; dez pacientes, 25,00%) ou dentro de 2‐12 meses (nove pacientes, 22,50%). Em contrapartida, o segundo melanoma ocorreu após mais de cinco anos em 14 pacientes (35,00%). O terceiro melanoma foi removido de forma sincronizada com o primeiro tumor em dois pacientes (5,00%), em 12 meses, após um a cinco anos e após cinco a dez anos igualmente em nove pacientes (22,50%) e mais de dez anos após o primeiro tumor nos 11 pacientes restantes (27,50%). Em três pacientes com sete melanomas primários, todos os sete tumores foram removidos após 11, 14 e 20 anos, respectivamente. O paciente mais jovem teve um terceiro melanoma primário removido aos 35 anos de idade; na maioria dos pacientes (31 pacientes, 77,50%) isso ocorreu após os 60 anos de idade.
Metástases nodais e/ou a distância de melanoma ocorreram em oito pacientes (20,00%) com 3MP. A coincidência de melanoma com outro tipo de câncer foi observada em 14 pacientes (35,00%).
A morbidade interna dos pacientes com 3MP não excedeu significantemente a morbidade da população em geral; representada principalmente por hipertensão arterial (52,50%), doença cardíaca (30,00%), doença da vesícula biliar/hepática (17,50%), diabetes (15,00%), doenças do metabolismo lipídico (15,00%) e doença da tireoide (10,00%).
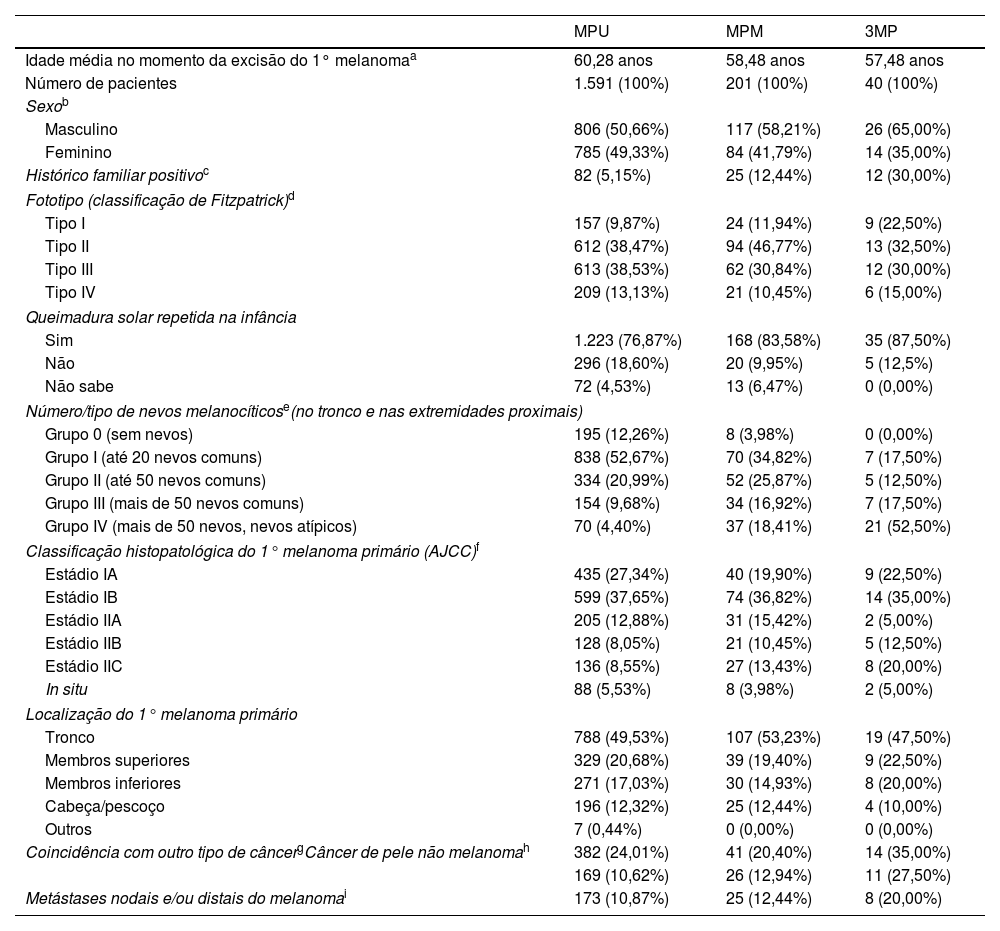
A tabela 1 apresenta as características do grupo 3MP, bem como sua comparação com o grupo MPM e o grupo de melanoma primário único – MPU (grupo controle de 1.591 pacientes com MPU excisados entre janeiro de 2010 e dezembro de 2019). Ambos os grupos MPM e 3MP são mais frequentemente representados por pacientes do sexo masculino, mais jovens, fototipos mais claros, com nevos melanocíticos múltiplos e atípicos, pessoas com histórico de queimadura solar e de melanoma na família em comparação com o grupo MPU. Além disso, os pacientes com 3MP correm maior risco de desenvolver metástases nodais e/ou a distância de melanoma, bem como outro tipo de câncer. Diferenças no histórico positivo da família, número e característica dos nevos melanocíticos e coincidência com câncer de pele foram estatisticamente e altamente significantes na comparação entre pacientes 3MP vs. MPU, mas também entre 3MP vs. MPM.
Comparação entre pacientes com melanoma primário único (MPU), melanomas primários múltiplos (MPM) e três ou mais melanomas primários (3MP)
| MPU | MPM | 3MP | |
|---|---|---|---|
| Idade média no momento da excisão do 1° melanomaa | 60,28 anos | 58,48 anos | 57,48 anos |
| Número de pacientes | 1.591 (100%) | 201 (100%) | 40 (100%) |
| Sexob | |||
| Masculino | 806 (50,66%) | 117 (58,21%) | 26 (65,00%) |
| Feminino | 785 (49,33%) | 84 (41,79%) | 14 (35,00%) |
| Histórico familiar positivoc | 82 (5,15%) | 25 (12,44%) | 12 (30,00%) |
| Fototipo (classificação de Fitzpatrick)d | |||
| Tipo I | 157 (9,87%) | 24 (11,94%) | 9 (22,50%) |
| Tipo II | 612 (38,47%) | 94 (46,77%) | 13 (32,50%) |
| Tipo III | 613 (38,53%) | 62 (30,84%) | 12 (30,00%) |
| Tipo IV | 209 (13,13%) | 21 (10,45%) | 6 (15,00%) |
| Queimadura solar repetida na infância | |||
| Sim | 1.223 (76,87%) | 168 (83,58%) | 35 (87,50%) |
| Não | 296 (18,60%) | 20 (9,95%) | 5 (12,5%) |
| Não sabe | 72 (4,53%) | 13 (6,47%) | 0 (0,00%) |
| Número/tipo de nevos melanocíticose(no tronco e nas extremidades proximais) | |||
| Grupo 0 (sem nevos) | 195 (12,26%) | 8 (3,98%) | 0 (0,00%) |
| Grupo I (até 20 nevos comuns) | 838 (52,67%) | 70 (34,82%) | 7 (17,50%) |
| Grupo II (até 50 nevos comuns) | 334 (20,99%) | 52 (25,87%) | 5 (12,50%) |
| Grupo III (mais de 50 nevos comuns) | 154 (9,68%) | 34 (16,92%) | 7 (17,50%) |
| Grupo IV (mais de 50 nevos, nevos atípicos) | 70 (4,40%) | 37 (18,41%) | 21 (52,50%) |
| Classificação histopatológica do 1° melanoma primário (AJCC)f | |||
| Estádio IA | 435 (27,34%) | 40 (19,90%) | 9 (22,50%) |
| Estádio IB | 599 (37,65%) | 74 (36,82%) | 14 (35,00%) |
| Estádio IIA | 205 (12,88%) | 31 (15,42%) | 2 (5,00%) |
| Estádio IIB | 128 (8,05%) | 21 (10,45%) | 5 (12,50%) |
| Estádio IIC | 136 (8,55%) | 27 (13,43%) | 8 (20,00%) |
| In situ | 88 (5,53%) | 8 (3,98%) | 2 (5,00%) |
| Localização do 1° melanoma primário | |||
| Tronco | 788 (49,53%) | 107 (53,23%) | 19 (47,50%) |
| Membros superiores | 329 (20,68%) | 39 (19,40%) | 9 (22,50%) |
| Membros inferiores | 271 (17,03%) | 30 (14,93%) | 8 (20,00%) |
| Cabeça/pescoço | 196 (12,32%) | 25 (12,44%) | 4 (10,00%) |
| Outros | 7 (0,44%) | 0 (0,00%) | 0 (0,00%) |
| Coincidência com outro tipo de câncergCâncer de pele não melanomah | 382 (24,01%) | 41 (20,40%) | 14 (35,00%) |
| 169 (10,62%) | 26 (12,94%) | 11 (27,50%) | |
| Metástases nodais e/ou distais do melanomai | 173 (10,87%) | 25 (12,44%) | 8 (20,00%) |
3MP, pacientes com 3 ou mais melanomas primários; MPM, pacientes com múltiplos (2 ou mais) melanomas primários; MPU, pacientes com melanoma único primário.
Comparação estatística dos resultados dos grupos 3MP vs. MPU, 3MP vs. MPM, 3MP vs. MPU+MPM. A análise estatística dos dados foi realizada com o software SAS (SAS Institute Inc., Cary, NC, EUA). Testes não paramétricos (teste de Wilcoxon, teste de mediana) foram utilizados para comparar as distribuições dos parâmetros investigados entre os grupos testados. Diferenças nas frequências foram testadas utilizando o teste exato de Fisher ou o teste de qui‐quadrado. A significância estatística foi estabelecida em 5% (p<0,05). As diferenças estatisticamente significantes são destacadas em negrito e os parâmetros relevantes com *.
Média da idade no momento da excisão do 1° melanoma: 3MP vs. MPU (p=0,2021), 3MP vs. MPM (p=0,5911), 3MP vs. MPU+MPM (p=0,2303).
Histórico familiar positivo: 3MP vs. MPU (p<0,0001), 3MP vs. MPM (p=0,0049), 3MP vs. MPU+MPM (p <0,0001).
Número/tipo de nevos melanocíticos: 3MP vs. MPU (p <0,0001), 3MP vs. MPM (p=0,0001), 3MP vs. MPU+MPM (p <0,0001).
Classificação histopatológica do 1° melanoma primário (AJCC): 3MP vs. MPU (p=0,3644), 3MP vs. MPM (p=0,6300), 3MP vs. MPU+MPM (p=0,4564).
Coincidência com outro tipo de câncer: 3MP vs. MPU (p=0,1094), 3MP vs. MPM (p=0,0445), 3MP vs. MPU+MPM (p=0,0944).
Pode‐se afirmar que pacientes com MPM têm mais fatores de risco conhecidos para melanoma, o que é ainda mais pronunciado em pacientes 3MP.5,6 De acordo com os presentes resultados, os pacientes 3MP também têm risco aumentado de metástases de melanoma e coincidência com outro tipo de câncer.7,8 É importante o seguimento de longo prazo de pacientes com melanoma, bem como de pacientes com fatores de risco para esse tipo de câncer.9,10 O teste genético de pacientes com MPM e seus tumores seria interessante e poderia ser objeto de mais pesquisas.
Suporte financeiroNenhum.
Contribuição dos autoresTomas Fikrle: Aprovação da versão final do manuscrito; revisão crítica da literatura; obtenção, análise e interpretação de dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; elaboração e redação do manuscrito; análise estatística; concepção e planejamento do estudo.
Barbora Divisova: Revisão crítica da literatura; obtenção, análise e interpretação dos dados; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados.
Karel Pizinger: Aprovação da versão final do manuscrito; participação efetiva na orientação da pesquisa; revisão crítica do manuscrito.
Conflito de interessesNenhum.
Como citar este artigo: Fikrle T, Divisova B, Pizinger K. Patients with three or more primary melanomas; clinical‐epidemiological study. An Bras Dermatol. 2023;98:684–8.
Trabalho realizado no Departamento de Dermatovenereologia, Faculdade de Medicina, Charles University, University Hospital, Pilsen, República Tcheca.