O linfoma anaplásico de grandes células (ALCL, do inglês anaplastic large cell lymphoma) é responsável por 1% a 3% dos linfomas não Hodgkin e aproximadamente 15% dos linfomas de células T. A 5ª edição da classificação de tumores hematolinfoides da Organização Mundial da Saúde (OMS) reconhece quatro subtipos diferentes de ALCL: ALK‐positivo, ALK‐negativo, cutâneo primário e aqueles associados a implantes mamários (BIA‐ALCL, do inglês breast‐implant associated anaplastic large cell lymphoma).
Em janeiro de 2011, a Food and Drug Administration (FDA) publicou 34 casos coletados entre 1997 e 2010, com provável associação entre ALCL e uso de implantes mamários. Em virtude da implementação do registo PROFILE, aproximadamente 900 casos foram notificados em todo o mundo.
Os implantes são categorizados de acordo com seu preenchimento interno (solução salina ou silicone), formato (simétrico ou assimétrico) ou superfície externa (lisa ou texturizada).1,2 Os implantes texturizados têm a maior associação com esse tipo de linfoma.
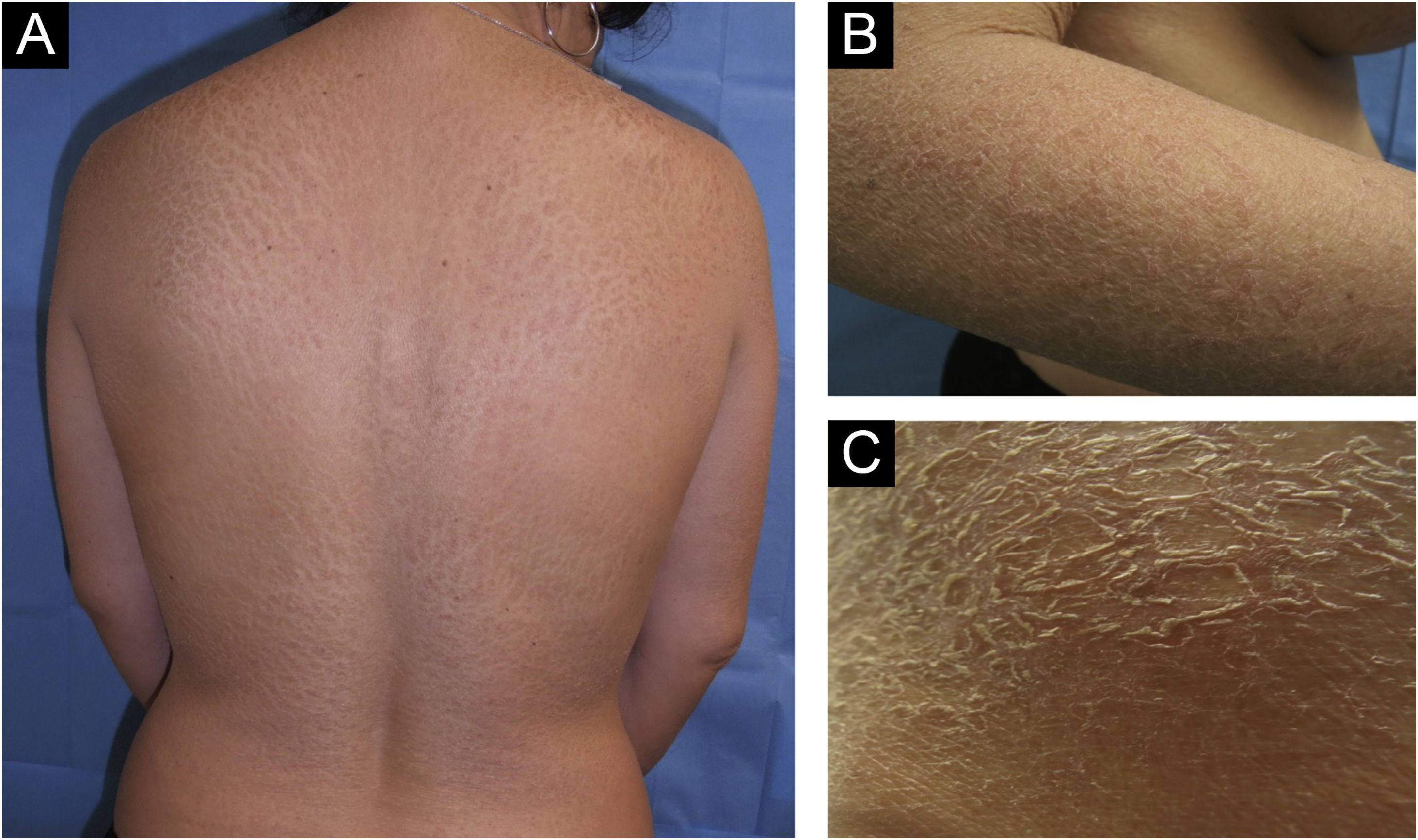
Este relato descreve o caso de uma paciente de 43 anos com história de implante de prótese mamária bilateral (texturizada em silicone) havia seis anos, por motivos estéticos. Ela procurou a clínica em virtude da presença de placas descamativas com fissuras e bordas eritematosas por todo o corpo, com história de três meses. Em algumas placas, descamação superficial fina era proeminente no sulco intermamário, no couro cabeludo e na borda das pálpebras. O exame físico revelou adenopatia fixa e indolor de 1,5cm na região axilar direita (fig. 1).
A tomografia computadorizada de tórax, associada à PET/TC de corpo inteiro, revelou coleção líquida circundando o implante mamário direito, com aumento de partes moles na articulação condroesternal, definição deficiente dos planos peitorais em sua porção medial e trabeculação de tecido adiposo subcutâneo. Também foram observadas múltiplas linfadenomegalias no mediastino anterior e bilateralmente nas regiões axilares e fossas supraclaviculares (fig. 2 A‐C).
(A–B) Coleção líquida circundando o implante mamário direito, com aumento de partes moles na articulação condroesternal, definição deficiente dos planos peitorais em sua porção medial e trabeculação de tecido adiposo subcutâneo. (C) Múltiplas linfadenomegalias foram observadas no mediastino anterior e bilateralmente nas regiões axilares e fossas supraclaviculares.
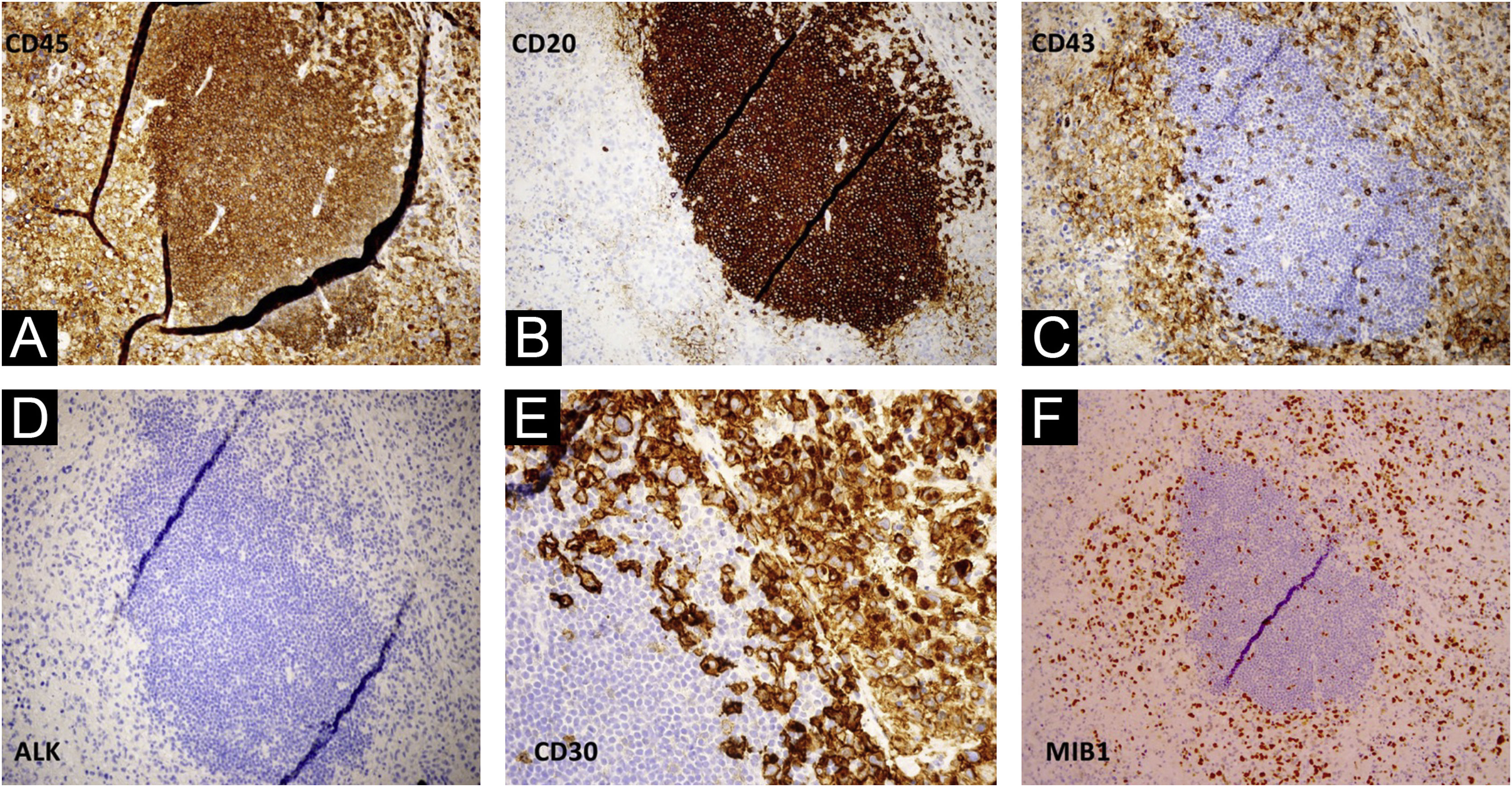
Embora a histopatologia de uma biopsia de pele sugerisse ictiose, a biopsia subsequente do linfonodo axilar direito revelou células neoplásicas com morfologia anaplásica multilobulada e aparência “embrionária” com focos de necrose tumoral. O fenótipo imuno‐histoquímico foi CD45+ CD30+, CD43+, Bcl‐2+, MUM‐1+, MIB‐1+(60%), CD3−, CD20−, CD79a−, CD10−, BCL6−, CD38−, LMP1−, ALK−, sugestivo de linfoma anaplásico de grandes células (fig. 3 A‐F).
Com base nos achados clínicos, radiológicos e histopatológicos, foi estabelecido o diagnóstico de BIA‐ALCL em estágio localmente agressivo ou extenso (estágio III, T4N2M0).
O BIA‐ALCL comumente se apresenta como seroma peri‐implante tardio (> 80%), causando distorção e assimetria das mamas. Pode manifestar‐se com linfadenopatia regional (predominantemente axilar, supra ou infraclavicular) em 20% dos casos, ou concomitante com lesões cutâneas (eritema, erupção cutânea, nódulos eritematosos) ou como de novo em 8% dos casos.3–7 No presente caso, a ictiose foi a manifestação paraneoplásica cutânea inicial do BIA‐ALCL, e o manejo dermatológico baseou‐se no uso de sabonete de glicerina, vaselina líquida e aceponato de metilprednisolona (pomada). Essa alteração cutânea pode aparecer da mesma maneira em endocrinopatias, distúrbios imunológicos, deficiências vitamínicas, infecções e com o uso de medicamentos.3
O BIA‐ALCL origina‐se da cápsula fibrosa que envolve o implante, exceto nos estágios avançados, quando compromete o tecido circundante. A doença foi diagnosticada no estágio I em 83% dos pacientes e apenas 7% apresentaram doença em estágio IV.1,6
A etiopatogenia do BIA‐ALCL é multifatorial, especificamente infecção crônica na configuração texturizada do implante, formação de biofilme Gram‐negativo, resposta imune, inflamação crônica, genética do hospedeiro (p. ex., JAK/STAT, p53) e tempo de oncogênese. Os presumíveis gatilhos incluem fricção mecânica, partículas do invólucro do implante de silicone, lixiviação de silicone e bactérias. O BIA‐ALCL se manifesta em tempo médio de oito a dez anos após o implante da prótese mamária.6–9Considerando que 2%‐4% dos casos podem ocorrer bilateralmente, ambos os implantes da presente paciente foram removidos com capsulectomia total,1,6,8,10 e a quimioterapia foi iniciada sob o regime CHOP (ciclofosfamida, cloridrato de doxorrubicina, sulfato de vincristina e prednisona). Após seis ciclos, a resposta morfometabólica completa da paciente foi confirmada por PET/CT, com posterior desaparecimento das lesões cutâneas.
Deve‐se estabelecer o papel de certos agentes (brentuximabe vedotin), terapias adjuvantes (radioterapia) e transplante autólogo de células‐tronco, principalmente em estágios localmente agressivos ou avançados (estágios II‐IV).
O presente caso de uma paciente com BIA‐ALCL que apresentou ictiose adquirida enfatiza uma abordagem multidisciplinar para diagnóstico precoce e manejo adequado.
Suporte financeiroNenhum.
Contribuição dos autoresHéctor Chiang Wong: Aprovação da versão final do manuscrito, revisão crítica da literatura, obtenção, análise e interpretação dos dados; participação intelectual em conduta propedêutica e/ou terapêutica do caso estudado.
Pilar Martínez Sánchez: Aprovação da versão final do manuscrito, obtenção dos dados, participação intelectual em conduta propedêutica e/ou terapêutica do caso estudado.
María del Carmen González Guzmán: Aprovação da versão final do manuscrito, obtenção, análise e interpretação dos dados.
Conflito de interessesNenhum.
Como citar este artigo: Wong HC, Sánchez PM, Guzmán Md. Paraneoplastic acquired ichthyosis as the first manifestation in breast implant‐associated anaplastic large cell lymphoma. An Bras Dermatol. 2024;99:628–31.
Trabalho realizado no Hospital 12 de Octubre, Madri, Espanha.