Eficácia e segurança do secuquinumabe em pacientes com psoríase foram demonstradas em ensaios clínicos randomizados e controlados.
ObjetivosAvaliar a eficácia e segurança do secuquinumabe em pacientes com psoríase em placas acompanhados em uma clínica dermatológica.
MétodosDados de 101 pacientes com psoríase em placas submetidos a pelo menos 16 semanas de tratamento com secuquinumabe entre junho de 2018 e junho de 2023 foram analisados retrospectivamente.
ResultadosCinquenta e três (53%) dos pacientes não haviam recebido tratamento biológico. As taxas de resposta PASI‐75, ‐90 e ‐100 foram de 72%, 50% e 30%, respectivamente, na semana 16 em todos os pacientes. As respostas PASI‐75 e ‐90 foram maiores em pacientes virgens de tratamento nas semanas 16 e 28 (p<0,001; p<0,001; p<0,01; p=0,01, respectivamente). A porcentagem de todos os pacientes com PASI ≤ 1, ≤ 3, ≤ 5 foi de 50%, 77% e 92%, respectivamente, na semana 16. Elas foram maiores no grupo virgem do que no grupo não virgem de tratamento nas semanas 16 e 28 (p=0,02, p<0,01; p=0,05, p=0,07, p<0,01, p=0,03, respectivamente). Na semana 52, as respostas PASI‐75, ‐90 e ‐100 foram significantemente menores em pacientes tabagistas (p=0,04; p=0,03; p<0,01, respectivamente). A duração média do tratamento com secuquinumabe foi de 19,80±12,76 meses. O secuquinumabe foi descontinuado em 14 (26,4%) dos pacientes virgens de tratamento e em 28 (58,3%) dos pacientes não virgens de tratamento em um único momento do tratamento (p<0,001). O evento adverso mais comuns nos pacientes foi infecção mucocutânea por Candida (8%). Nenhum caso de reativação de hepatite B ou C e nenhum caso de tuberculose ativa ou reativação foi observado em nenhum dos pacientes durante o período de seguimento.
Limitações do estudoEste é um estudo retrospectivo de centro único e tem relativamente poucos pacientes, incluindo apenas a população turca.
ConclusãoO secuquinumabe parece ser eficaz na psoríase em placas, particularmente em pacientes não submetidos anteriormente a tratamento com biológicos e não fumantes. Além disso, é seguro em pacientes com hepatite inativa e tuberculose.
Psoríase é doença de pele crônica, imunomediada e comum. Estima‐se que afete aproximadamente 125 milhões de pessoas em todo o mundo.1 Sua patogênese é complexa e não totalmente compreendida. Entretanto, houve avanços no entendimento da patogênese da psoríase em placas nos últimos anos. Foi demonstrado que o mecanismo de inflamação feedforward, principalmente a via das células T‐helper tipo 17 (TH17), desempenha papel na patogênese. Assim, os antagonistas da IL‐17 ganharam destaque no tratamento da doença.1,2 O secuquinumabe é um anticorpo monoclonal totalmente humano contra IL‐17A, é o primeiro agente contra IL‐17A e foi aprovado em 2015 para o tratamento da psoríase moderada a grave.2,3
A eficácia e a segurança do secuquinumabe em pacientes com psoríase foram demonstradas em ensaios clínicos randomizados e controlados.4–6 No entanto, pode haver diferenças significantes entre os resultados dos ensaios clínicos e aqueles obtidos de diferentes populações na prática diária. O objetivo do presente estudo foi avaliar a eficácia e a segurança do secuquinumabe e os fatores que afetaram sua eficácia em pacientes com psoríase em placas acompanhados em uma clínica dermatológica na Turquia.
Materiais e métodosNeste estudo observacional e retrospectivo de seguimento, foram incluídos pacientes com psoríase em placas, moderada a grave, com idade igual ou superior a 18 anos, submetidos a pelo menos 16 semanas de tratamento com secuquinumabe em uma clínica dermatológica, entre junho de 2018 e junho de 2023. Antes do tratamento com secuquinumabe, todas as infecções, incluindo infecção pelos vírus da hepatite B e C e status de tuberculose (Tb), foram avaliadas por meio de história, exame físico, hemograma completo, proteína C reativa, transaminases, exame de urina completo, radiografia de tórax, exame de prova tuberculínica (PPD, do inglês purified protein derivative) e/ou testes QuantiFERON‐TB e marcadores de vírus da hepatite B e C. Secuquinumabe (300mg, via SC) foi administrado como dose de ataque inicial nas semanas 0, 1, 2, 3 e 4, e depois uma vez a cada quatro semanas. Injeções de secuquinumabe foram administradas durante as consultas. O estudo foi aprovado pelo Comitê de Ética local (Decisão n° 25/2023).
Foram registradas características sociodemográficas, tratamentos sistêmicos e biológicos anteriores, ocorrência concomitante de artrite psoriásica e envolvimento ungueal, uso de isoniazida e estado de profilaxia para hepatite B dos pacientes. Os escores do índice de gravidade da área de psoríase (PASI, do inglês Psoriasis Area Severity Index) foram comparados antes do secuquinumabe e nas semanas 16, 28, 52, 76, 100, 148 e 196. A eficácia do secuquinumabe foi expressa como a porcentagem de pacientes que atingiram PASI‐75, PASI‐90 e PASI‐100. Além disso, os pacientes que alcançaram PASI absoluto ≤ 1, ≤ 3 e ≤ 5 com secuquinumabe foram determinados como porcentagem. Foram registrados efeitos adversos, duração do uso de secuquinumabe e motivos para a descontinuação do secuquinumabe.
Análise estatísticaFoi realizada a análise descritiva de todas as variáveis incluídas no estudo. As variáveis quantitativas foram expressas como média±desvio padrão (DP), ou como mediana e intervalo. As variáveis qualitativas foram expressas em valor absoluto (n) e porcentagem.
As análises de Qui‐Quadrado de Pearson e teste T de amostras independentes foram utilizadas na análise das tabelas cruzadas. O software IBM SPSS Statistics 21.0 (IBM Corp., Armonk, NY) foi utilizado para a análise. O valor de p<0,05 foi aceito como critério para significância estatística.
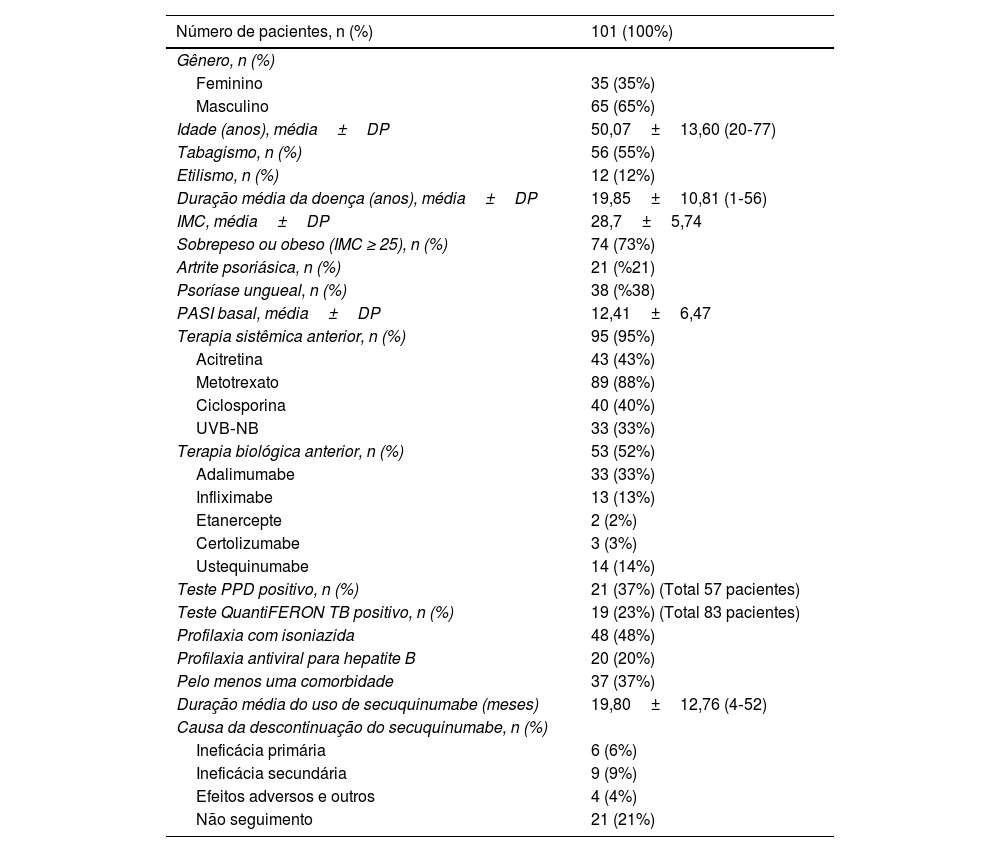
ResultadosUm total de 101 pacientes, 66 (65%) homens e 35 (35%) mulheres, foram incluídos no estudo. A média de idade dos pacientes foi de 50,07±13,60 anos. A média do índice de massa corporal (IMC) dos pacientes foi de 28,7±5,74. Setenta e quatro (73%) dos pacientes apresentavam sobrepeso ou obesidade (IMC ≥ 25). Quando os tratamentos anteriores foram avaliados, 95 (95%) pacientes haviam sido tratados com terapia sistêmica convencional e 53 (53%) pacientes eram virgens de tratamento biológico. Vinte e um (21%) pacientes apresentavam artrite psoriásica, e 38 (38%) pacientes apresentavam envolvimento ungueal (tabela 1). Trinta e sete (37%) pacientes apresentavam pelo menos uma comorbidade. As comorbidades mais comuns foram hipertensão arterial (HT; n=19), diabetes mellitus (DM; n=13), doenças da tireoide (n=11), doença arterial coronariana (n=4), asma (n=4), doença de Parkinson (n=1), hemangioma (n=1), enxaqueca (n=1), insuficiência cardíaca (n=1), esclerose múltipla (n=1), doença de Buerger (n=1), artrite reumatoide (n=1), doença de Behçet (n=1), vitiligo (1), insuficiência renal crônica (n=1) e policitemia vera (n=1).
Características basais da população do estudo
| Número de pacientes, n (%) | 101 (100%) |
|---|---|
| Gênero, n (%) | |
| Feminino | 35 (35%) |
| Masculino | 65 (65%) |
| Idade (anos), média±DP | 50,07±13,60 (20‐77) |
| Tabagismo, n (%) | 56 (55%) |
| Etilismo, n (%) | 12 (12%) |
| Duração média da doença (anos), média±DP | 19,85±10,81 (1‐56) |
| IMC, média±DP | 28,7±5,74 |
| Sobrepeso ou obeso (IMC ≥ 25), n (%) | 74 (73%) |
| Artrite psoriásica, n (%) | 21 (%21) |
| Psoríase ungueal, n (%) | 38 (%38) |
| PASI basal, média±DP | 12,41±6,47 |
| Terapia sistêmica anterior, n (%) | 95 (95%) |
| Acitretina | 43 (43%) |
| Metotrexato | 89 (88%) |
| Ciclosporina | 40 (40%) |
| UVB‐NB | 33 (33%) |
| Terapia biológica anterior, n (%) | 53 (52%) |
| Adalimumabe | 33 (33%) |
| Infliximabe | 13 (13%) |
| Etanercepte | 2 (2%) |
| Certolizumabe | 3 (3%) |
| Ustequinumabe | 14 (14%) |
| Teste PPD positivo, n (%) | 21 (37%) (Total 57 pacientes) |
| Teste QuantiFERON TB positivo, n (%) | 19 (23%) (Total 83 pacientes) |
| Profilaxia com isoniazida | 48 (48%) |
| Profilaxia antiviral para hepatite B | 20 (20%) |
| Pelo menos uma comorbidade | 37 (37%) |
| Duração média do uso de secuquinumabe (meses) | 19,80±12,76 (4‐52) |
| Causa da descontinuação do secuquinumabe, n (%) | |
| Ineficácia primária | 6 (6%) |
| Ineficácia secundária | 9 (9%) |
| Efeitos adversos e outros | 4 (4%) |
| Não seguimento | 21 (21%) |
IMC, índice de massa corporal; UVB‐NB, radiação ultravioleta B de banda estreita, PPD, exame com derivado proteico purificado; DP, desvio padrão.
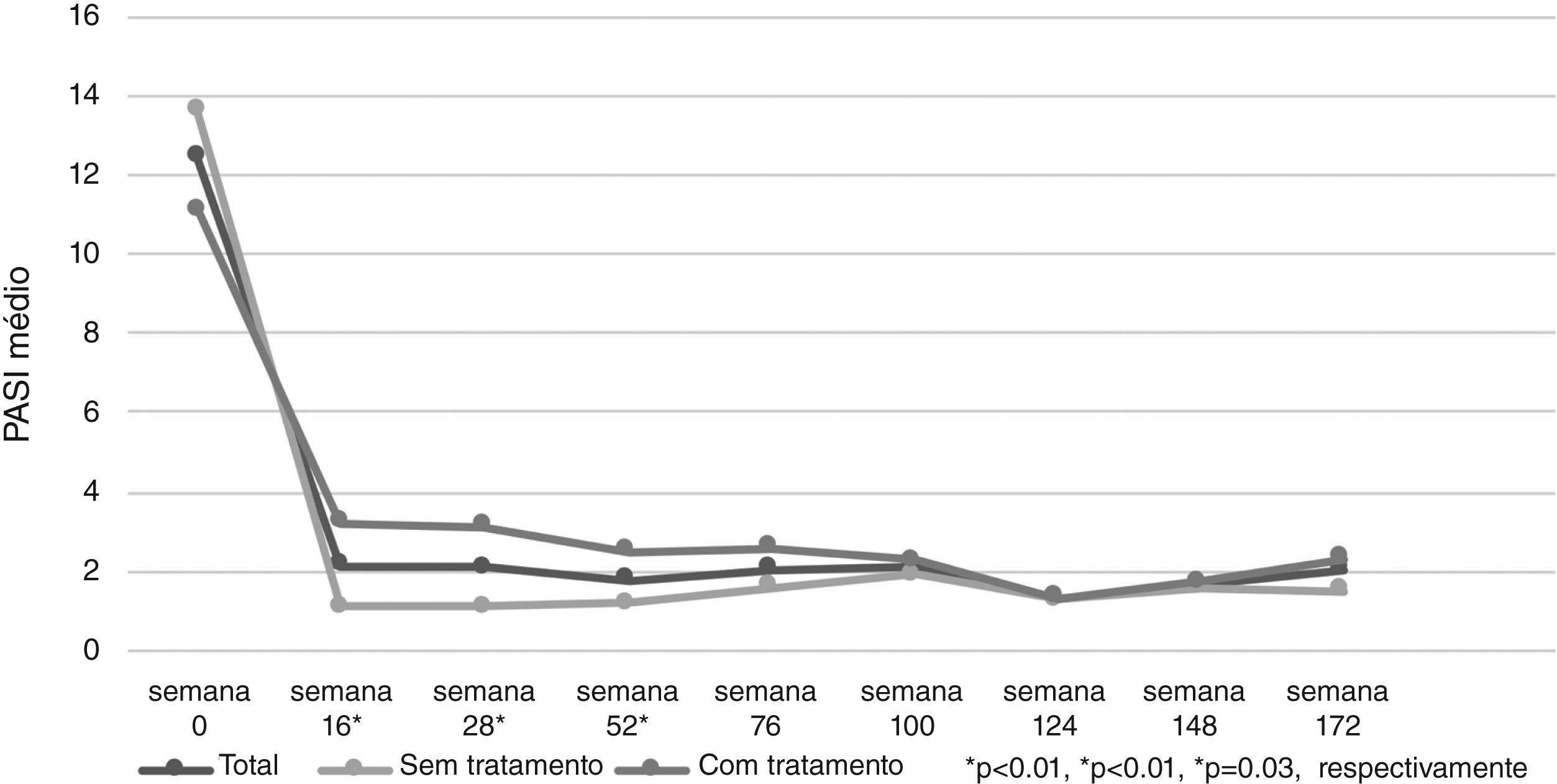
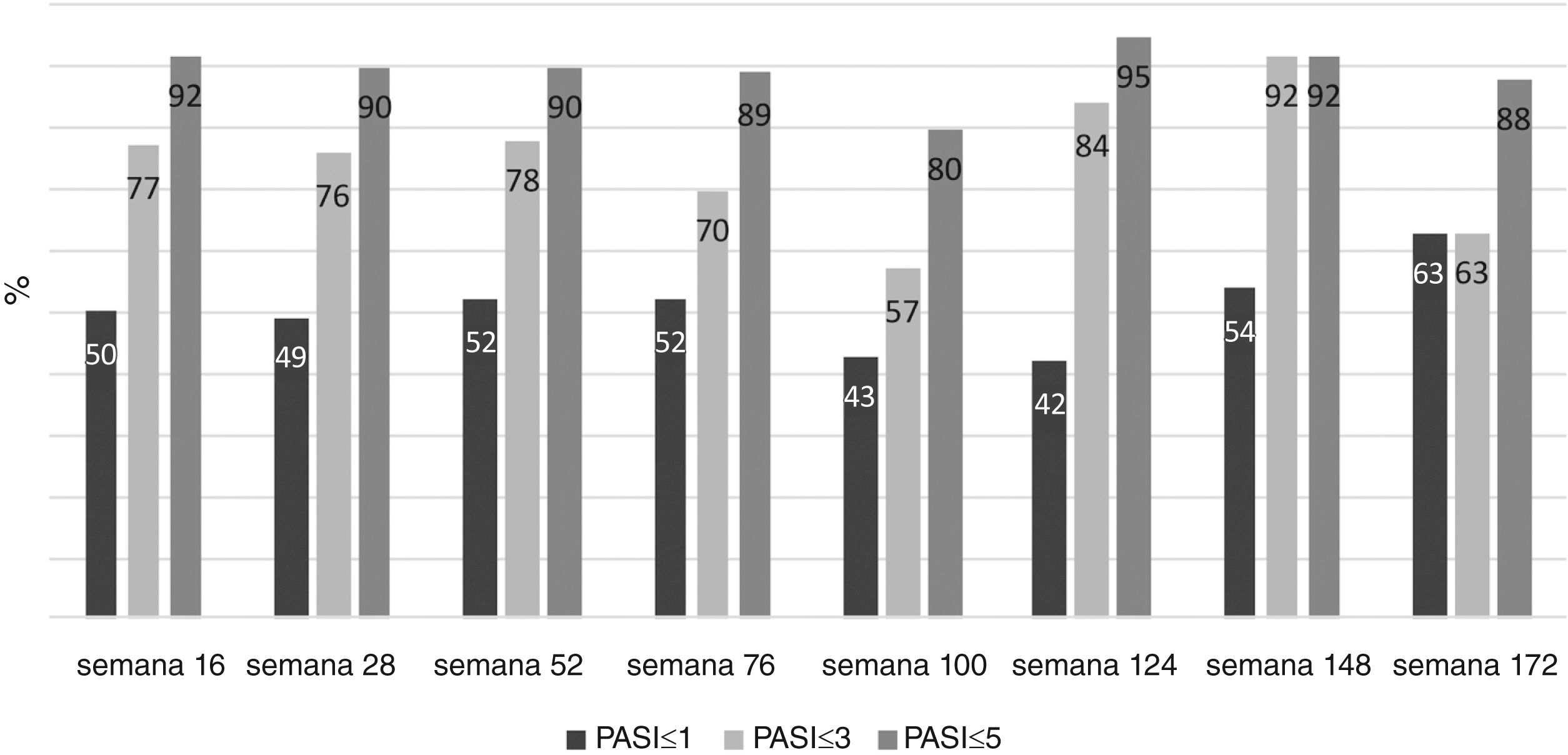
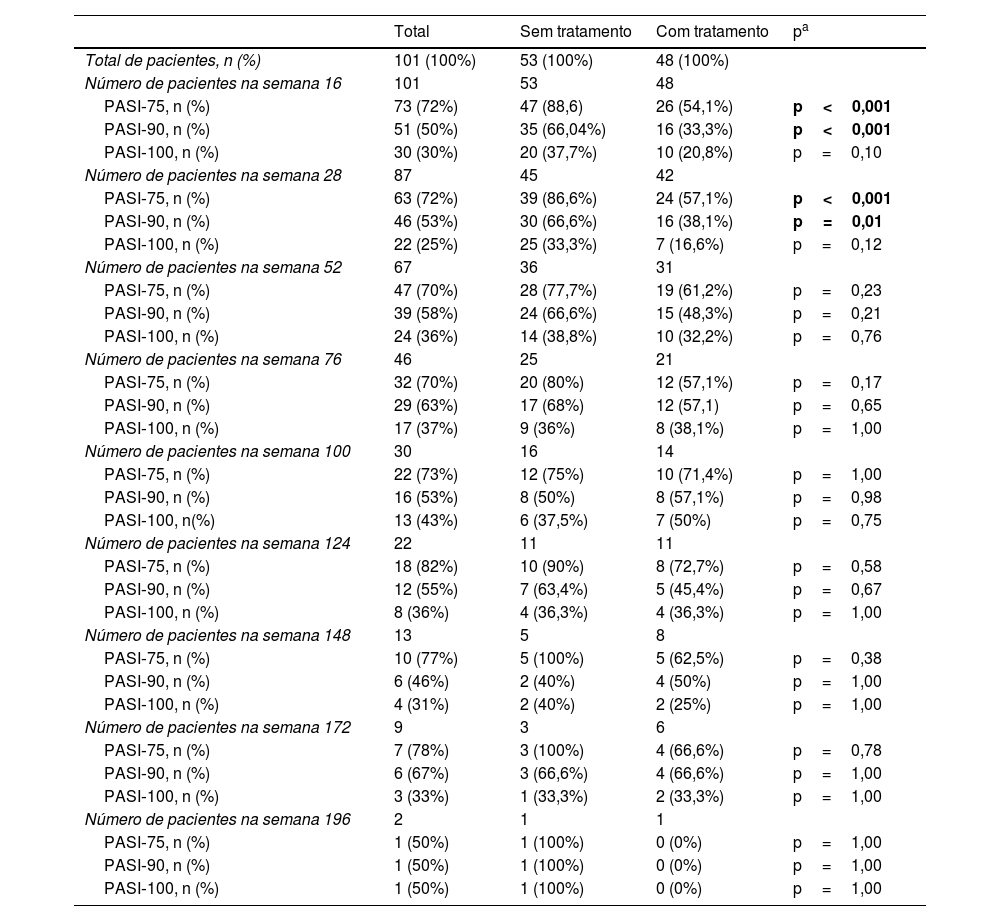
O PASI médio dos pacientes foi de 12,41±6,47 antes do tratamento com secuquinumabe. Depois de 16, 28 e 52 semanas, o PASI médio foi 2,11±3,73; 2,08±2,99; e 1,79±2,43, respectivamente. Esses valores foram significantemente menores em pacientes virgens de tratamento biológico em comparação com pacientes não virgens em 16, 28 e 52 semanas (p<0,01; p<0,01; e p=0,03, respectivamente; fig. 1). Na semana 16, 72% dos pacientes tinham PASI‐75, 50% tinham PASI‐90 e 30% tinham PASI‐100. As respostas PASI‐75 e ‐90 foram maiores em pacientes virgens de tratamento nas semanas 16 e 28 (p<0,001; p<0,001; p<0,01; p=0,01, respectivamente; tabela 2). A porcentagem de todos os pacientes com PASI ≤ 1, ≤ 3 e ≤ 5 foi de 50%, 77% e 92%, respectivamente, na semana 16 (fig. 2). No grupo virgem de tratamento, essas porcentagens foram 62,2%, 90,5%, 98,1% e 60%, 88,8%, 97,7% nas semanas 16 e 28, respectivamente. No grupo não virgem de tratamento, essas porcentagens foram 37,5%, 62,5%, 85,4% e 38,1%, 61,9%, 80,9% nas semanas 16 e 28, respectivamente. Elas foram maiores no grupo virgem do que no grupo não virgem de tratamento (p=0,02, p<0,01, p=0,05, p=0,07, p<0,01, p=0,03, respectivamente).
Resultados das respostas PASI dos grupos de pacientes de acordo com as semanas
| Total | Sem tratamento | Com tratamento | pa | |
|---|---|---|---|---|
| Total de pacientes, n (%) | 101 (100%) | 53 (100%) | 48 (100%) | |
| Número de pacientes na semana 16 | 101 | 53 | 48 | |
| PASI‐75, n (%) | 73 (72%) | 47 (88,6) | 26 (54,1%) | p<0,001 |
| PASI‐90, n (%) | 51 (50%) | 35 (66,04%) | 16 (33,3%) | p<0,001 |
| PASI‐100, n (%) | 30 (30%) | 20 (37,7%) | 10 (20,8%) | p=0,10 |
| Número de pacientes na semana 28 | 87 | 45 | 42 | |
| PASI‐75, n (%) | 63 (72%) | 39 (86,6%) | 24 (57,1%) | p<0,001 |
| PASI‐90, n (%) | 46 (53%) | 30 (66,6%) | 16 (38,1%) | p=0,01 |
| PASI‐100, n (%) | 22 (25%) | 25 (33,3%) | 7 (16,6%) | p=0,12 |
| Número de pacientes na semana 52 | 67 | 36 | 31 | |
| PASI‐75, n (%) | 47 (70%) | 28 (77,7%) | 19 (61,2%) | p=0,23 |
| PASI‐90, n (%) | 39 (58%) | 24 (66,6%) | 15 (48,3%) | p=0,21 |
| PASI‐100, n (%) | 24 (36%) | 14 (38,8%) | 10 (32,2%) | p=0,76 |
| Número de pacientes na semana 76 | 46 | 25 | 21 | |
| PASI‐75, n (%) | 32 (70%) | 20 (80%) | 12 (57,1%) | p=0,17 |
| PASI‐90, n (%) | 29 (63%) | 17 (68%) | 12 (57,1) | p=0,65 |
| PASI‐100, n (%) | 17 (37%) | 9 (36%) | 8 (38,1%) | p=1,00 |
| Número de pacientes na semana 100 | 30 | 16 | 14 | |
| PASI‐75, n (%) | 22 (73%) | 12 (75%) | 10 (71,4%) | p=1,00 |
| PASI‐90, n (%) | 16 (53%) | 8 (50%) | 8 (57,1%) | p=0,98 |
| PASI‐100, n(%) | 13 (43%) | 6 (37,5%) | 7 (50%) | p=0,75 |
| Número de pacientes na semana 124 | 22 | 11 | 11 | |
| PASI‐75, n (%) | 18 (82%) | 10 (90%) | 8 (72,7%) | p=0,58 |
| PASI‐90, n (%) | 12 (55%) | 7 (63,4%) | 5 (45,4%) | p=0,67 |
| PASI‐100, n (%) | 8 (36%) | 4 (36,3%) | 4 (36,3%) | p=1,00 |
| Número de pacientes na semana 148 | 13 | 5 | 8 | |
| PASI‐75, n (%) | 10 (77%) | 5 (100%) | 5 (62,5%) | p=0,38 |
| PASI‐90, n (%) | 6 (46%) | 2 (40%) | 4 (50%) | p=1,00 |
| PASI‐100, n (%) | 4 (31%) | 2 (40%) | 2 (25%) | p=1,00 |
| Número de pacientes na semana 172 | 9 | 3 | 6 | |
| PASI‐75, n (%) | 7 (78%) | 3 (100%) | 4 (66,6%) | p=0,78 |
| PASI‐90, n (%) | 6 (67%) | 3 (66,6%) | 4 (66,6%) | p=1,00 |
| PASI‐100, n (%) | 3 (33%) | 1 (33,3%) | 2 (33,3%) | p=1,00 |
| Número de pacientes na semana 196 | 2 | 1 | 1 | |
| PASI‐75, n (%) | 1 (50%) | 1 (100%) | 0 (0%) | p=1,00 |
| PASI‐90, n (%) | 1 (50%) | 1 (100%) | 0 (0%) | p=1,00 |
| PASI‐100, n (%) | 1 (50%) | 1 (100%) | 0 (0%) | p=1,00 |
No presente estudo, 56 (56%) dos pacientes eram tabagistas. Em geral, as taxas de resposta ao secuquinumabe foram baixas em pacientes tabagistas em todas as semanas. Na semana 52, as respostas PASI‐75 (58,33% em fumantes, 83,87% em não fumantes), PASI‐90 (44,44% em fumantes, 74,19% em não fumantes) e PASI‐100 (19,44% em fumantes, 54,84% em não fumantes) foram significantemente menores em pacientes tabagistas (p=0,04, p=0,03, p<0,01, respectivamente). Além disso, a porcentagem de pacientes com PASI absoluto ≤ 1 na semana 16 (39,29% em fumantes, 64,44% em não fumantes) e com PASI absoluto ≤ 3 na semana 52 (66,67% em fumantes, 90,32% em não fumantes) foi significantemente menor em fumantes (p=0,02, p=0,04, respectivamente). No presente estudo, a duração média do tratamento com secuquinumabe foi de 19,46±12,49 meses em fumantes e de 20,22±13,23 meses em não fumantes (p=0,77). O tratamento com secuquinumabe foi interrompido por algum motivo em 48,21% dos fumantes e 33,33% dos não fumantes (p=0,19).
Doze (12%) dos pacientes consumiam álcool e não houve relação entre o consumo de álcool e as taxas de resposta ao tratamento (p>0,05). Nos pacientes com IMC ≥ 25, presença de artrite, envolvimento ungueal e pelo menos uma comorbidade, as respostas ao tratamento foram geralmente baixas em todas as semanas em comparação com aqueles sem essas condições, mas não houve diferença significante (p>0,05).
A duração média do tratamento com secuquinumabe foi de 19,80±12,76 meses. No momento em que o estudo foi realizado, 87 pacientes atingiram o mês 7, 67 atingiram o mês 13, 30 atingiram o mês 25, 22 atingiram o mês 31, 13 atingiram o mês 37, nove atingiram o mês 43 e dois atingiram o mês 49. O secuquinumabe foi descontinuado em um algum momento durante o tratamento em 40 (40%) pacientes. Vinte e um (21%) desses pacientes não quiseram usar o secuquinumabe ou abandonaram o seguimento. Ineficácia primária foi observada em seis pacientes (6%), ineficácia secundária em nove (9%), e eventos adversos em dois (2%) pacientes. Os efeitos adversos foram neutropenia em um paciente e diarreia em outro. Além disso, um paciente desenvolveu câncer da mama subsequentemente e o secuquinumabe foi descontinuado. Um paciente apresentou piora da artrite psoriásica, embora sua pele apresentasse boas condições, e o secuquinumabe foi descontinuado. O secuquinumabe foi descontinuado em 14 (26,4%) dos pacientes virgens de tratamento e em 28 (58,3%) dos pacientes não virgens de tratamento em algum momento durante o tratamento (p<0,001). As razões para a descontinuação do secuquinumabe em pacientes virgens de tratamento foram o não seguimento (n=8; 53,8%), ineficácia secundária (n=4; 30,7%) e eventos adversos (n=2; 15,3%); em pacientes não virgens de tratamento, os motivos foram o não seguimento (n=14; 51,8%), ineficácia primária (n=6; 22,2%), ineficácia secundária (n=5; 18,5%) e outras razões (n=2; 7,4%), respectivamente (p=0,26).
O evento adverso mais comum foi infecção mucocutânea por Candida (8%). Além disso, foram observadas infecção leve do trato respiratório superior em três pacientes, infecção do trato urinário em um paciente, neutropenia em um paciente e diarreia em um paciente.
No presente estudo, 20 (20%) dos pacientes apresentavam infecção inativa pelo vírus da hepatite B (HBV; anticorpo central da hepatite B (HbcAb)+, antígeno de superfície do vírus da hepatite B (HBsAg)−, DNA do HBV−). Nenhum paciente apresentou anticorpos HBsAg+ e antivírus da hepatite C (anticorpos anti‐HCV+). Todos os pacientes com infecção inativa pelo VHB receberam profilaxia para reativação por consultor de gastroenterologia. Nenhuma reativação de hepatite B ou C foi observada no período de seguimento. No presente estudo, o teste tuberculínico (PPD) foi ≥ 5mm em 21 (48%) dos 57 pacientes avaliados com teste PPD, e o teste QuantiFERON‐TB foi positivo em 19 (23%) dos 83 pacientes avaliados com testes QuantiFERON‐TB. Quarenta e oito (48%) pacientes receberam profilaxia com isoniazida por um consultor de doenças pulmonares. Nenhum caso de Tb ativa ou reativação foi observado durante o período de seguimento.
DiscussãoA eficácia e a segurança do secuquinumabe na psoríase foram demonstradas em ensaios clínicos. As taxas de resposta de PASI‐75, ‐90, ‐100 na semana 12 com 300mg de secuquinumabe foram 81,6%, 59,2%, 28,6%, 77,1%, 54,2%, 24,1%, 86,7%, 55% e 26,7%, respectivamente, em ensaios clínicos randomizados de fase 3.4–6 No presente estudo, as taxas de resposta PASI‐75, ‐90, ‐100 foram de 72%, 50%, 30%, respectivamente, na semana 16 e foram mais baixas do que em estudos clínicos. No presente estudo, em 16 e 28 semanas, as taxas de resposta PASI‐75, ‐90, ‐100 foram maiores em pacientes virgens de tratamento em comparação com pacientes não virgens de tratamento (53% dos pacientes eram virgens de tratamentos biológicos). Nos ensaios clínicos randomizados de fase 3, 71,4%, 88,4% e 75% dos pacientes eram virgens de tratamentos biológicos, respectivamente. Portanto, as taxas de resposta PASI‐75, ‐90, ‐100 no presente estudo podem ter sido inferiores às dos estudos clínicos.4–6Em um conjunto de dados da prática clínica de 121 pacientes, as taxas de resposta PASI‐75, ‐90, ‐100 (84,3%, 68,6%, 18,2% vs. 89,3%, 73,6%, 9,1% vs. 86,1%, 64,6%, 7,6%) nas semanas 16, 24 e 52 foram superiores às do presente estudo. No entanto, naquele estudo, o número de pacientes virgens de tratamento biológico foi bem maior (80%) do que no presente.7 Ausência de tratamento biológico anterior é um dos fatores mais importantes que afetam as taxas de resposta ao secuquinumabe em pacientes com psoríase. Assim como em ensaios clínicos, foi demonstrado que a ausência de experiência biológica anterior está associada a resposta elevada ao secuquinumabe em muitos casos da prática clínica.7–12No presente estudo, o PASI absoluto dos pacientes também foi avaliado no tratamento com secuquinumabe. A porcentagem de pacientes com PASI ≤ 1, PASI ≤ 3, PASI ≤ 5 foi de 50%, 77% e 92%, respectivamente, na semana 16. Essas taxas foram maiores em pacientes virgens de tratamento do que em pacientes não virgens. Segundo dados da prática clínica de 136 pacientes na Espanha com psoríase tratados com secuquinumabe, a porcentagem de pacientes com PASI ≤ 1, ≤ 2, ≤ 3, ≤ 5 foi de 47%, 64%, 75% e 86%, respectivamente na semana 16. Essas taxas são mais baixas do que as encontradas no presente estudo. Da mesma maneira, taxas de resposta mais altas foram relatadas em pacientes virgens de tratamento naquele estudo, e apenas 27,9% dos pacientes eram virgens de tratamentos biológicos, explicando as taxas de resposta mais baixas em comparação com o presente estudo.10 Em outro estudo, o PASI absoluto baixo com secuquinumabe foi associado ao fato de os pacientes serem virgens de tratamento biológicos.11
Fatores ambientais extrínsecos, como ingestão de álcool, tabagismo, estresse, distúrbios do sono, vida sedentária e dieta, afetam a apresentação clínica, a gravidade, o curso e as taxas de resposta ao tratamento da psoríase.13 Em um estudo, descobriu‐se que a obesidade reduz a possibilidade de tratamento com produtos biológicos.14 Além disso, foi demonstrado que IMC mais elevado está associado à resposta baixa ao secuquinumabe.8,10 Em outro estudo, a obesidade foi relatada como importante fator preditivo para taxas de resposta PASI‐75 com secuquinumabe na semana 16.7 No presente estudo, as taxas de resposta PASI‐75, ‐90, ‐100 em todas as semanas foram baixas em pacientes obesos ou com sobrepeso (IMC ≥ 25), mas não houve diferença estatisticamente significante.
Os mediadores pró‐inflamatórios circulantes na psoríase causam resposta inflamatória generalizada e comorbidades, como doenças cardiovasculares, hipertensão, DM, HT e síndrome metabólica (SM).15 Além disso, muitas doenças como obesidade, artrite psoriásica, doenças inflamatórias intestinais, doenças renais crônicas, doenças autoimunes da tireoide, transtornos de humor e asma podem acompanhar a psoríase.16,17 Neste estudo, 37 (37%) dos pacientes tinham pelo menos uma comorbidade; as mais comuns foram HT (19 pacientes), DM (13 pacientes), doenças da tireoide (11 pacientes), doença arterial coronariana (quatro pacientes), e asma (quatro pacientes), respectivamente. As comorbidades também causam dificuldades no tratamento da psoríase. Um estudo demonstrou que comorbidades como SM, HT e DM estão associadas à baixa resposta ao secuquinumabe.18 No presente estudo, as taxas de resposta do secuquinumabe foram geralmente baixas em pacientes com comorbidades, mas não houve diferença estatisticamente significante. Além disso, 52,35% dos pacientes com comorbidades e 35,6% dos pacientes sem comorbidades descontinuaram o uso de secuquinumabe durante o período do tratamento.
Cinquenta e seis (56%) dos pacientes eram tabagistas no presente estudo. As taxas de resposta do secuquinumabe foram geralmente baixas em pacientes tabagistas em todas as semanas. A porcentagem de pacientes com PASI ≤ 1 na semana 16 e PASI ≤ 3 na semana 52 foi significantemente menor em fumantes. Além disso, as taxas de resposta PASI‐75, ‐90, ‐100 na semana 52 foram significantemente mais baixas nos fumantes. Há resultados conflitantes associados às taxas de resposta ao secuquinumabe e ao tabagismo na literatura.7,18 Em um estudo de coorte que avaliou um total de 2.384 pacientes recebendo terapia biológica, incluindo adalimumabe, etanercepte, infliximabe, ustequinumabe e secuquinumabe, foi relatado que o tabagismo reduz as taxas de resposta ao tratamento com todos os agentes.14 N presente estudo, 12 (12%) dos pacientes consumiam álcool e não houve relação entre a ingestão de álcool e as taxas de resposta ao secuquinumabe. Esses dados foram compatíveis com a literatura.7,14
Uma metanálise de 43 estudos relatou que as taxas de eventos adversos foram consistentes com estudos clínicos e não foi observado nenhum novo sinal de segurança associado ao secuquinumabe.19 O evento adverso mais comum na prática clínica com secuquinumabe foi infecção por Candida. Eventos adversos como nasofaringite, pneumonia, foliculite, cefaleia, diarreia, tireoidite subaguda, neutropenia, trombocitopenia e transaminases elevadas também foram relatados.7–10 O evento adverso mais comum nos pacientes do presente estudo foi candidíase oral (8%). Além disso, foi observada infecção leve do trato respiratório superior em três pacientes e infecção do trato urinário em um paciente. Nenhum desses pacientes necessitou de descontinuação do secuquinumabe. No entanto, o secuquinumabe foi descontinuado em decorrência de neutropenia em um paciente e diarreia em outro. Não foi detectada doença inflamatória intestinal (DII) no período de controle e seguimento do paciente com diarreia pelo consultor da gastroenterologia. Em dados reais de 108 pacientes com psoríase tratados com secuquinumabe, foi observada diarreia em três pacientes durante o período de seguimento, mas nenhum apresentou DII.20 Além disso, uma metanálise de 21 estudos clínicos incluindo 7.355 pacientes mostrou que o secuquinumabe não aumentou o risco de DII.21 Na análise de ensaios clínicos e dados de vigilância pós‐comercialização de até cinco anos, foi demonstrado um baixo risco de neoplasia maligna com o secuquinumabe.22 No presente estudo, câncer de mama foi detectado em uma paciente durante o tratamento com secuquinumabe. A história familiar da paciente era positiva para câncer de mama e o tratamento com secuquinumabe foi descontinuado.
Vinte (20%) pacientes apresentaram infecção inativa pelo VHB no presente estudo. Todos receberam profilaxia para reativação por gastroenterologista. Nenhum caso de reativação de hepatite B ou C foi observado no período de seguimento. Da mesma maneira, foi relatado que o secuquinumabe é seguro em pacientes com histórico de infecção por hepatite B e C em dados da prática clínica.9,23,24 O secuquinumabe foi relatado como seguro em pacientes com Tb em ensaios clínicos e também em estudos de prática clínica.9,23,25 No presente estudo, 48 (48%) pacientes receberam profilaxia com isoniazida por pneumologista. Nenhum caso de reativação de Tb foi observado nos pacientes durante o período de seguimento.
Em uma metanálise de 43 estudos, a sobrevida do secuquinumabe foi relatada como 90% aos três e seis meses e 80% aos 12 meses.19 No momento em que o presente estudo estava sendo conduzido, 87% dos pacientes atingiram sete meses, 67% atingiram 13 meses, 30% 25 meses, 22% 31 meses, 13% 37 meses, 9% 43 meses, e 2% 49 meses. Em 40 (40%) pacientes, o secuquinumabe foi descontinuado durante o tratamento. Desses, 21 interromperam o seguimento, seis foram descontinuados por ineficácia primária, nove por ineficácia secundária, dois por eventos adversos (um por neutropenia, outro por diarreia), um por câncer de mama que apareceu mais tarde e um por agravamento de artrite (mas a pele estava em boas condições). Parte do período de seguimento dos pacientes coincidiu com a pandemia de COVID‐19 (2020‐2022); portanto, a taxa de pacientes que abandonaram o seguimento pode ter sido maior do que em outros estudos. A proporção de pacientes que descontinuaram o secuquinumabe devido à ineficácia foi semelhante aos dados da prática clínica.8 Entretanto, em alguns estudos, esse número foi inferior ao do presente estudo, e isso pode ser decorrente da alta taxa de pacientes virgens de tratamentos biológicos nesses estudos.7,11 Em um estudo, a descontinuação do secuquinumabe por ineficácia foi maior do que no presente estudo. A taxa de pacientes virgens de tratamentos biológicos é muito baixa naquele estudo.10 A experiência com tratamentos biológicos anteriores é fator muito importante para a continuação do tratamento com secuquinumabe. No presente estudo, a descontinuação do medicamento por ineficácia foi mais comum em pacientes não virgens de tratamento do que em pacientes virgens de tratamento. Além disso, embora o secuquinumabe não tenha sido descontinuado em nenhum dos pacientes virgens de tratamento por ineficácia primária, ele foi descontinuado em 22,2% dos pacientes não virgens de tratamento.
LimitaçõesO presente estudo tem algumas limitações. Este é um estudo retrospectivo unicêntrico com relativamente poucos pacientes e que inclui apenas a população turca. No entanto, inclui a experiência de cinco anos na prática clínica com secuquinumabe na psoríase. Apesar dessas limitações, os autores acreditam que os resultados do presente estudo são valiosos.
ConclusãoSecuquinumabe é opção de tratamento eficaz em pacientes com psoríase em placas em uso prolongado. Nenhuma experiência com tratamentos biológicos e ausência de tabagismo podem aumentar a eficácia e a sobrevida do medicamento. É também uma opção de tratamento segura para casos de reativação de hepatite e Tb latente.
Suporte financeiroNenhum.
Contribuição dos autoresErsoy Acer: Concepção e planejamento do estudo; obtenção, análise e interpretação dos dados; análise estatística; elaboração e redação do manuscrito; revisão crítica da literatura; aprovação da versão final do manuscrito.
Hilal Kaya Erdoğan: Concepção e planejamento do estudo; obtenção, análise e interpretação dos dados; elaboração e redação do manuscrito; revisão crítica da literatura; aprovação da versão final do manuscrito.
Esra Ağaoğlu: Concepção e planejamento do estudo; obtenção, análise e interpretação dos dados; elaboração e redação do manuscrito; revisão crítica da literatura; aprovação da versão final do manuscrito.
Hatice Baştürk: Concepção e planejamento do estudo; obtenção, análise e interpretação dos dados; elaboração e redação do manuscrito; revisão crítica da literatura; aprovação da versão final do manuscrito.
Muzaffer Bilgin: Concepção e planejamento do estudo; obtenção, análise e interpretação dos dados; elaboração e redação do manuscrito; revisão crítica da literatura; aprovação da versão final do manuscrito.
Zeynep Nurhan Saraçoğlu: Concepção e planejamento do estudo; obtenção, análise e interpretação dos dados; elaboração e redação do manuscrito; revisão crítica da literatura; aprovação da versão final do manuscrito.
Conflito de interessesNenhum.
Como citar este artigo: Acer E, Erdoğan HK, Ağaoğlu E, Baştürk H, Bilgin M, Saraçoğlu ZN. Efficacy and safety of secukinumab in psoriasis: five‐year real life experience. An Bras Dermatol. 2024;99:840–6.
Trabalho realizado no Departamento de Dermatologia e Venereologia, Eskisehir Osmangazi University, Eskisehir, Turquia.