Doença linfoproliferativa cutânea primária de células T CD4+ pleomórficas pequenas/médias (PCSM‐TCLPD, do inglês primary cutaneous CD4+small/medium sized pleomorphic T‐cell lymphoproliferative disorder) tem sido considerada doença cutânea controversa que tem sido incluída entre os linfomas cutâneos de células T, apresentando‐se mais comumente como nódulo solitário e/ou placa com predileção específica e característica para cabeça e pescoço. Em virtude da considerável sobreposição entre PCSM‐TCLPD e pseudolinfoma (PL), o diagnóstico e a diferenciação são frequentemente desafiadores. A metilação do DNA na posição 5da citosina e a subsequente redução nos níveis intracelulares de 5‐hidroximetilcitosina (5‐hmC) são eventos epigenéticos chave em vários tipos de câncer, incluindo linfomas sistêmicos. No entanto, isso foi raramente estudado em linfomas cutâneos.
ObjetivosO objetivo foi explorar a utilidade da imunomarcação de 5‐hmC para diferenciar PCSM‐TCLPD de PL.
MétodosEstudo retrospectivo de uma série de casos com análise imuno‐histoquímica e análise por imunofluorescência de 5‐hmC foram realizados em PL e PCSM‐TCLPD.
ResultadosFoi observada diminuição significante da imunorreatividade nuclear de 5‐hmC em PCSM‐TCLPD em comparação com PL (p < 0,0001). Utilizando o método integral semiquantitativo de pontuação, houve diferenças estatísticas nos escores finais de 5‐hmC entre os dois grupos de estudo. A imunomarcação dupla de 5‐hmC CD4 revelou diminuição de 5‐hmC em linfócitos CD4+ de PCSM‐TCLPD.
Limitações do estudoO pequeno tamanho da amostra clínica no estudo.
ConclusõesA presença de 5‐hmC em linfócitos CD4+ sugere fortemente processo benigno do tipo PL. Além disso, a diminuição da imunomarcação nuclear de 5‐hmC em PCSM‐TCLPD indica seu status linfoproliferativo, o que auxilia na diferenciação diagnóstica com PL.
A doença linfoproliferativa cutânea primária de células T CD4+ pleomórficas pequenas/médias (PCSM‐TCLPD, do inglês primary cutaneous CD4+small/medium sized pleomorphic T‐cell lymphoproliferative disorder) foi descrita como doença clínicopatológica distinta, apresentando‐se mais comumente como nódulo solitário e/ou placa com predileção característica por cabeça e pescoço.1 Na histopatologia, a PCSM‐TCLPD é caracterizada por infiltração nodular a difusa de células T pleomórficas de tamanho pequeno a médio (CD3+, CD4+, CD8− e CD30−) em toda a derme, com pequeno número (< 30%) de grandes células T pleomórficas CD4+, sem envolvimento da epiderme. Na maioria dos casos descritos, havia mistura razoavelmente grande com pequenas células T CD8+ reativas e células B CD20+, incluindo alguns histiócitos, neutrófilos, plasmócitos e eosinófilos.2 A PCSM‐TCLPD costumava ser chamada de linfoma cutâneo primário de células T CD4+ pela Organização Europeia para Pesquisa e Tratamento do Câncer da Organização Mundial da Saúde ‐ OMS (2008). Entretanto, em virtude de seu comportamento biológico indolente e potencial maligno incerto, a doença foi redesignada como “doença linfoproliferativa cutânea primária de células T CD4+ pleomórficas pequenas/médias” no esquema de classificação da OMS de 2016.3
De longe, a consideração diagnóstica diferencial mais importante e difícil envolve a hiperplasia linfoide benigna.4 Uma importante entidade no âmbito da hiperplasia linfoide cutânea é o pseudolinfoma (PL). O PL é caracterizado por pápulas, placas ou nódulos subcutâneos vermelhos ou marrons na cabeça, pescoço e membros superiores. As características histopatológicas são infiltração nodular ou infiltração difusa de linfócitos na derme média e inferior, principalmente pequenos linfócitos, acompanhados de histiócitos, eosinófilos e plasmócitos. Pode haver folículos linfoides e centros germinativos. Em última análise, os PLs se comportam de maneira clinicamente benigna e as lesões eventualmente se resolvem espontaneamente após a identificação e eliminação do agente iniciador ou com terapia não agressiva (como uso tópico ou injeção intradérmica de esteroides).5
Em muitos casos, pode ser impossível diferenciá‐los.6,7 A PCSM‐TCLPD geralmente tem prognóstico favorável e comportamento indolente, especialmente com lesão solitária, e a taxa de sobrevida em cinco anos é de 98,4% nos casos relatados, embora poucos pacientes com desfechos provavelmente desfavoráveis possam apresentar curso agressivo, lesões múltiplas, grandes e de crescimento rápido, recorrentes, resistentes ao tratamento e fatais.8 Nesse caso, pode ser importante diferenciar a PCSM‐TCLPD do PL para continuar o monitoramento clínico vigilante ou optar por tratamentos diferentes.
A 5‐hidroximetilcitosina (5‐hmC) é o produto da oxidação da 5‐citosina (5‐mc), que também é importante marcador epigenético envolvido em vários processos fisiológicos e patológicos. A 5‐hmC é catalisada pelas hidroxilases 5‐mC: a família de enzimas ten‐eleven translocation (TET), incluindo TET1, 2 e 3. A enzima TET2 tem sido extensivamente estudada nos eventos epigenéticos. O banco de dados Gene Ontology mostrou que a maioria dos genes alterados por metilação anormal estava relacionada à regulação da transcrição gênica e ao metabolismo celular. Como importante produto intermediário da desmetilação do DNA, a 5‐hmC foi recentemente encontrada apenas em mamíferos, com sua expressão deletada em vários tipos de câncer, sugerindo que a diminuição de 5‐hmC é um dos eventos epigenéticos importantes que ocorrem durante a diferenciação celular e o desenvolvimento do tumor.9–11 Foi demonstrado que a expressão de 5‐hmC é um marcador potencial para diferenciar entre melanomas e nevos melanocíticos.12
A hipótese dos autores é que a 5‐hmC poderia ser um potencial biomarcador útil para diferenciar PCSM‐TCLPD de hiperplasia linfoide cutânea benigna (PL) CD4+. Além disso, os autores pretendem descrever o perfil da 5‐hmC em doenças linfoproliferativas cutâneas de células T.
Materiais e métodosCoortes de pacientes e amostras de tecidoUm total de seis casos de PCSM‐TCLPD e 20 casos de PL diagnosticados no departamento de dermatologia de janeiro de 2012 a junho de 2022 foram incluídos para serem submetidos à análise imuno‐histoquímica (IHQ), e todos os dados dos pacientes foram anonimizados. O consentimento informado foi obtido de todos os pacientes antes da cirurgia, e todas as amostras foram claramente diagnosticadas por pelo menos dois dermatologistas experientes. Os critérios de inclusão para os grupos PCSM‐TCLPD e PL foram clínica e histopatologicamente baseados nos critérios definidos pela classificação da Organização Mundial da Saúde‐Organização Europeia para Pesquisa e Tratamento do Câncer (OMS‐EORTC).13–15
Avaliação por imuno‐histoquímicaOs estudos imuno‐histoquímicos foram realizados de acordo com o procedimento regular (anticorpo para 5‐hmC, diluído em 1:5000, Active Motif; anticorpos para TET2, diluídos em 1:500, Abcam). Além disso, controles positivos apropriados foram incluídos. Tecido tonsilar normal, proveniente da otorrinolaringologia, foi selecionado como controle positivo externo. A expressão de 5‐hmC e TET2 em macrófagos e células dendríticas em tonsilas foi utilizada como controle positivo. Os controles negativos foram obtidos omitindo‐se o anticorpo primário.
Avaliação por imunofluorescênciaAs análises de imunofluorescência foram realizadas de acordo com o procedimento regular (anticorpos para 5‐hmC, diluídos a 1:500, Active Motif; anticorpos para CD4, diluídos a 1:200, Santa Cruz). O anticorpo correspondente ao isotipo apropriado foi utilizado em todos os experimentos. A análise das imagens foi realizada utilizando‐se um microscópio confocal C2 conectado a uma câmera digital (Nikon, Japão).
Sistema de pontuaçãoDois patologistas revisaram todos os cortes de tecido e confirmaram os resultados da IHQ. Os patologistas estavam “cegos” ao avaliar a imunomarcação com 5‐hmC. A reação positiva para 5‐hmC mostrou grânulos amarelo‐acastanhados, localizados principalmente no núcleo. A taxa de células positivas para 5‐hmC e a intensidade da cor de cada corte foram classificadas pelo método integral semiquantitativo.16 A intensidade da imunomarcação foi dividida em quatro graus: 0 para ausência de imunomarcação, 1 para imunomarcação amarelo‐claro, 2 para amarelo médio e 3 para marrom. Além disso, a porcentagem de células positivas para 5‐hmC foi avaliada utilizando campos de grande aumento representativos (HPF, do inglês high‐Power fields; /μm2). Um total de 5 HPF não sobrepostos foi selecionado aleatoriamente para contar a porcentagem de células positivas para 5‐hmC em cada corte histológico. A pontuação final de 5‐hmC de cada corte histológico foi o produto do escore de intensidade de imunomarcação pela porcentagem de células positivas para 5‐hmC: ≥ 4 pontos constitui alta expressão, < 4 pontos, baixa expressão.
Análise estatísticaAs análises estatísticas foram realizadas utilizando o software GraphPad Prism 9.0. As imagens foram processadas pelo programa Image J (NIH, EUA). A menos que especificamente mencionado, o teste t de Student bicaudal foi utilizado para comparar diferenças entre os dois grupos; valor de p < 0,05 foi considerado limite para diferenças significantes. Todos os dados são apresentados como média ± desvio padrão (DP).
ResultadosCaracterísticas clínicas de PCSM‐TCLPD e PLOs grupos de estudo foram compostos por 14 pacientes do sexo masculino e 12 do sexo feminino, com média de idade de 48,5 anos na apresentação (variação de 17 a 83 anos). Nenhum paciente havia falecido no momento da coleta de dados. Doenças extracutâneas foram excluídas pelo estadiamento de acordo com as diretrizes internacionais.15 O diagnóstico de PCSM‐TCLPD e PL foi estabelecido com base na correlação clinicopatológica. Todos os casos apresentaram os aspectos histopatológicos característicos, como descrito anteriormente. Exames laboratoriais e de imagem de rotina (linfonodos superficiais e radiografia de tórax) foram avaliados em todos os casos; todas as investigações foram negativas, e nenhum paciente apresentava história de lesões clínicas sugestivas de micose fungoide. Além disso, nenhuma comorbidade relevante surgiu durante o período de seguimento (tabela S1, tabela S2).
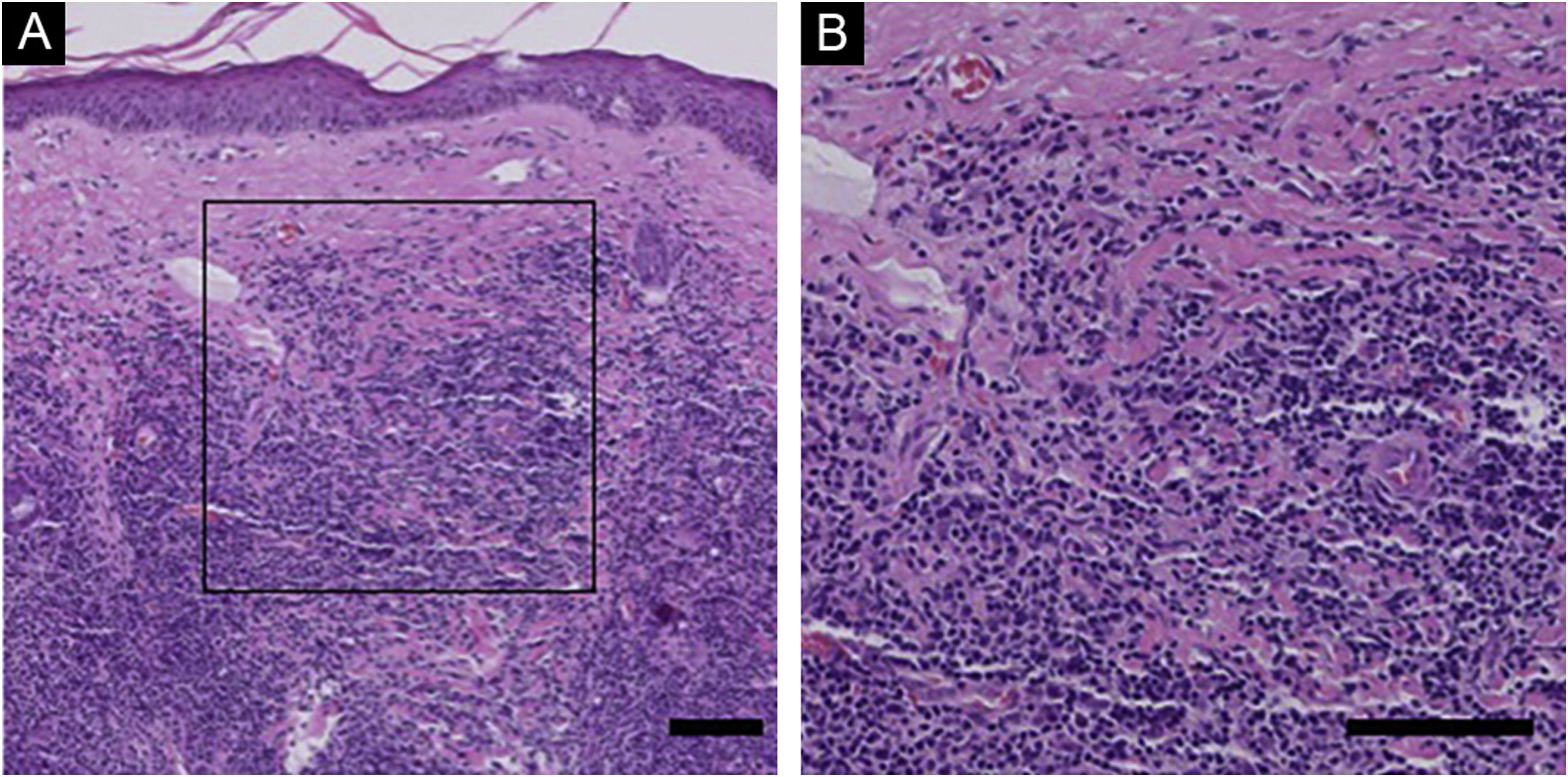
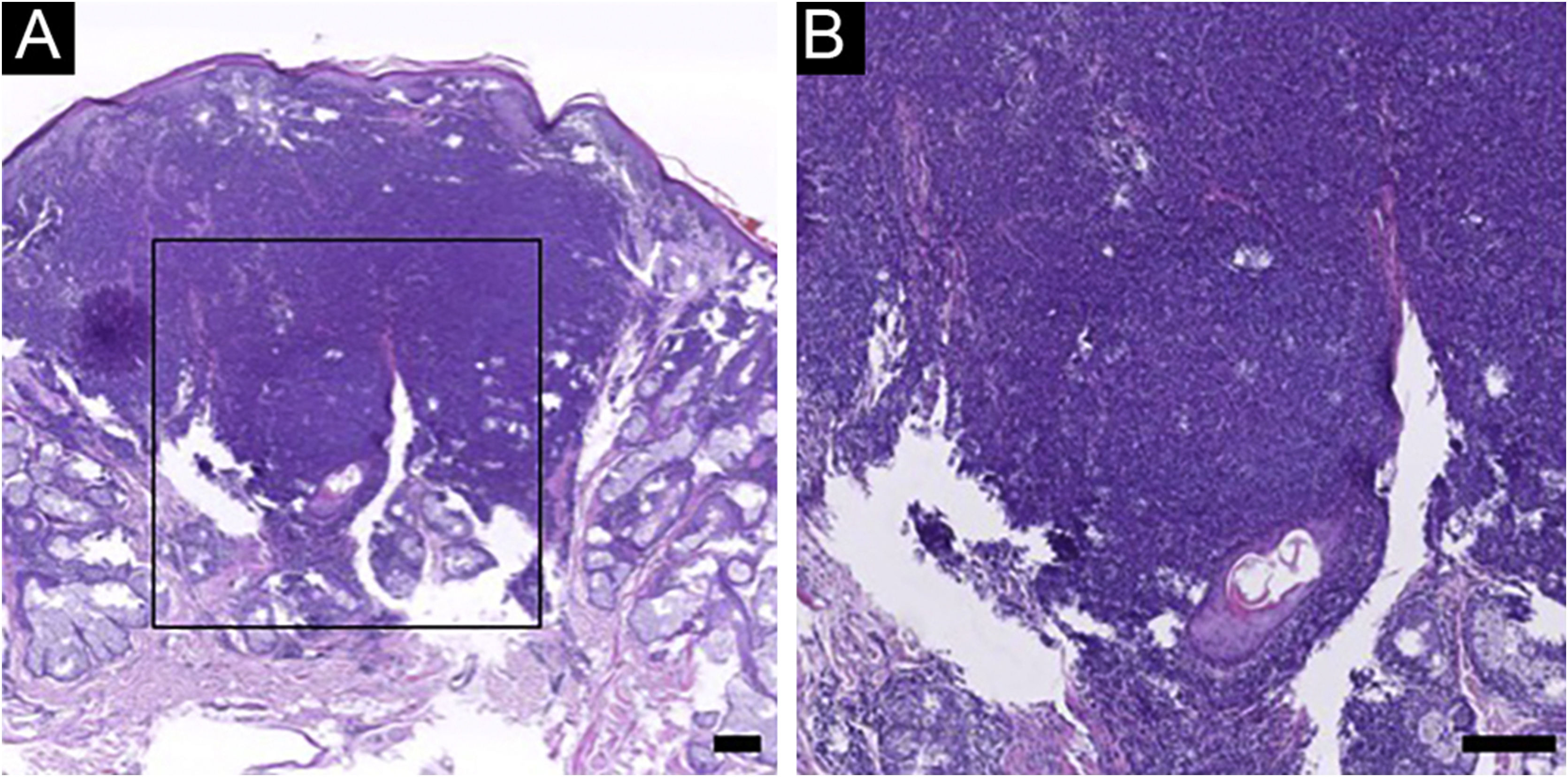
Achados histopatológicos e imuno‐histoquímicos de PCSM‐TCLPD e PLTodos os casos de PCSM‐TCLPD mostraram infiltrado nodular a difuso por toda a derme, estendendo‐se até o tecido adiposo subcutâneo, sem envolvimento da epiderme (fig. 1). Os infiltrados eram predominantemente compostos por linfócitos de tamanho pequeno/médio, com número variável (5% a 20%) de células linfoides de tamanho médio a grande, com núcleos hipercromáticos. Em todos os casos havia considerável mistura com histiócitos, que em alguns casos eram acompanhados por células gigantes multinucleadas. Plasmócitos geralmente estavam presentes, mas havia poucos eosinófilos.
A ‐ Histopatologia da PCSM‐TCLPD. Nenhuma anormalidade óbvia foi observada na epiderme e infiltração difusa de células linfoides foi observada em toda a derme. B ‐ Em maior aumento, um grande número de linfócitos de tamanho pequeno a médio foi visto na derme, com mastócitos, plasmócitos e eosinófilos entre os linfócitos. (Hematoxilina & eosina, barra de escala = 100μm).
Nos casos de PL, a maioria apresentava infiltrados predominantemente intradérmicos, densos, linfocíticos (nodulares ou difusos). Em alguns casos, estendiam‐se ao tecido subcutâneo. Em geral, o infiltrado consistia em linfócitos B de tamanho pequeno a médio, sem atipias nucleares significantes. Centros germinativos reativos ou folículos linfoides (fig. S1) foram comumente encontrados.
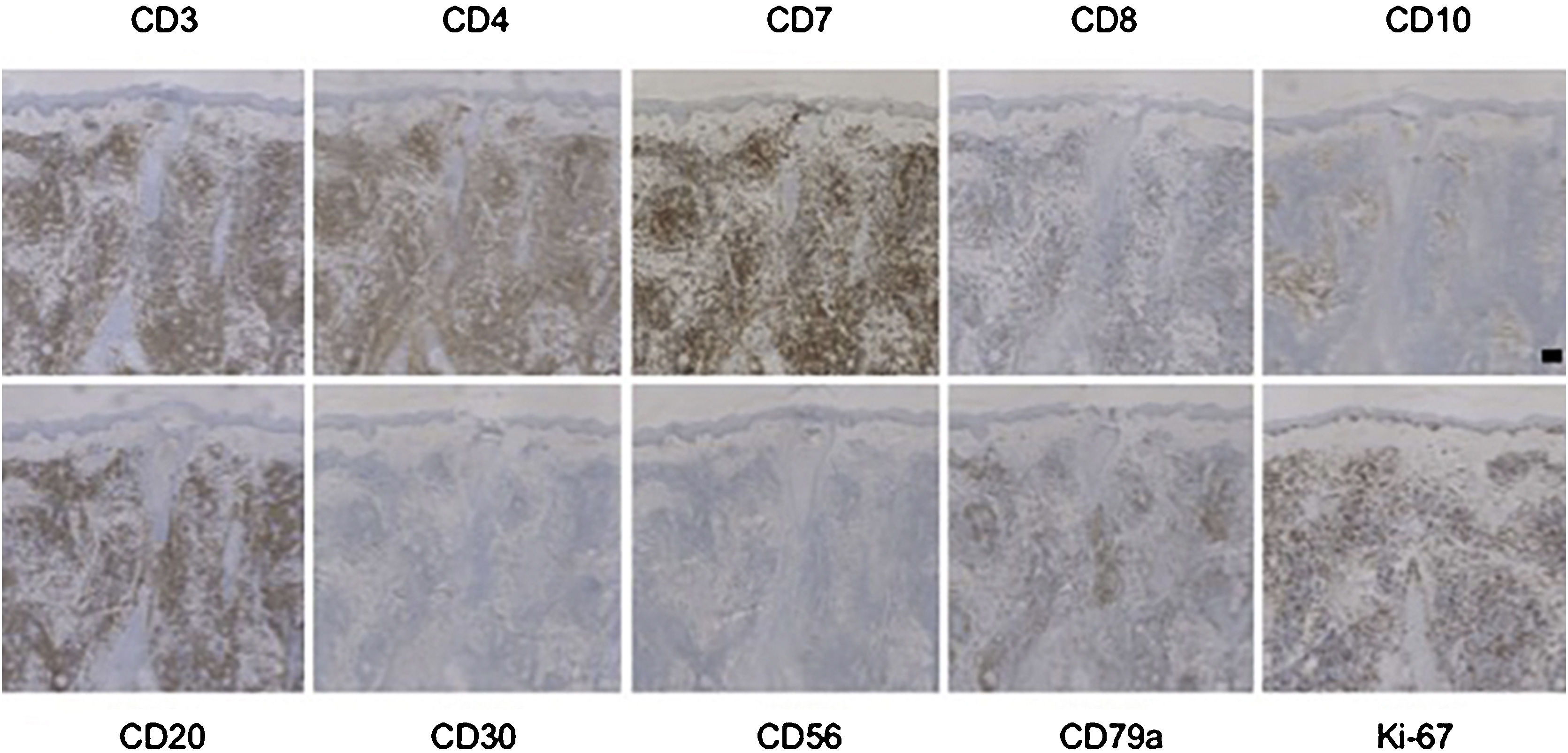
A IHQ mostrou positividade para CD3 e CD4 em todos os casos de PCSM‐TCLPD, e CD7 foi positivo em todos os casos testados. Os linfócitos CD8+ eram poucos ou ausentes. CD30 foi negativo em todos os seis casos e nenhum caso foi CD56+. Havia poucos casos TIA‐1 positivos, e apenas um caso apresentou expressão N/D (não disponível) de TIA‐1 (fig. 2, tabela S3).
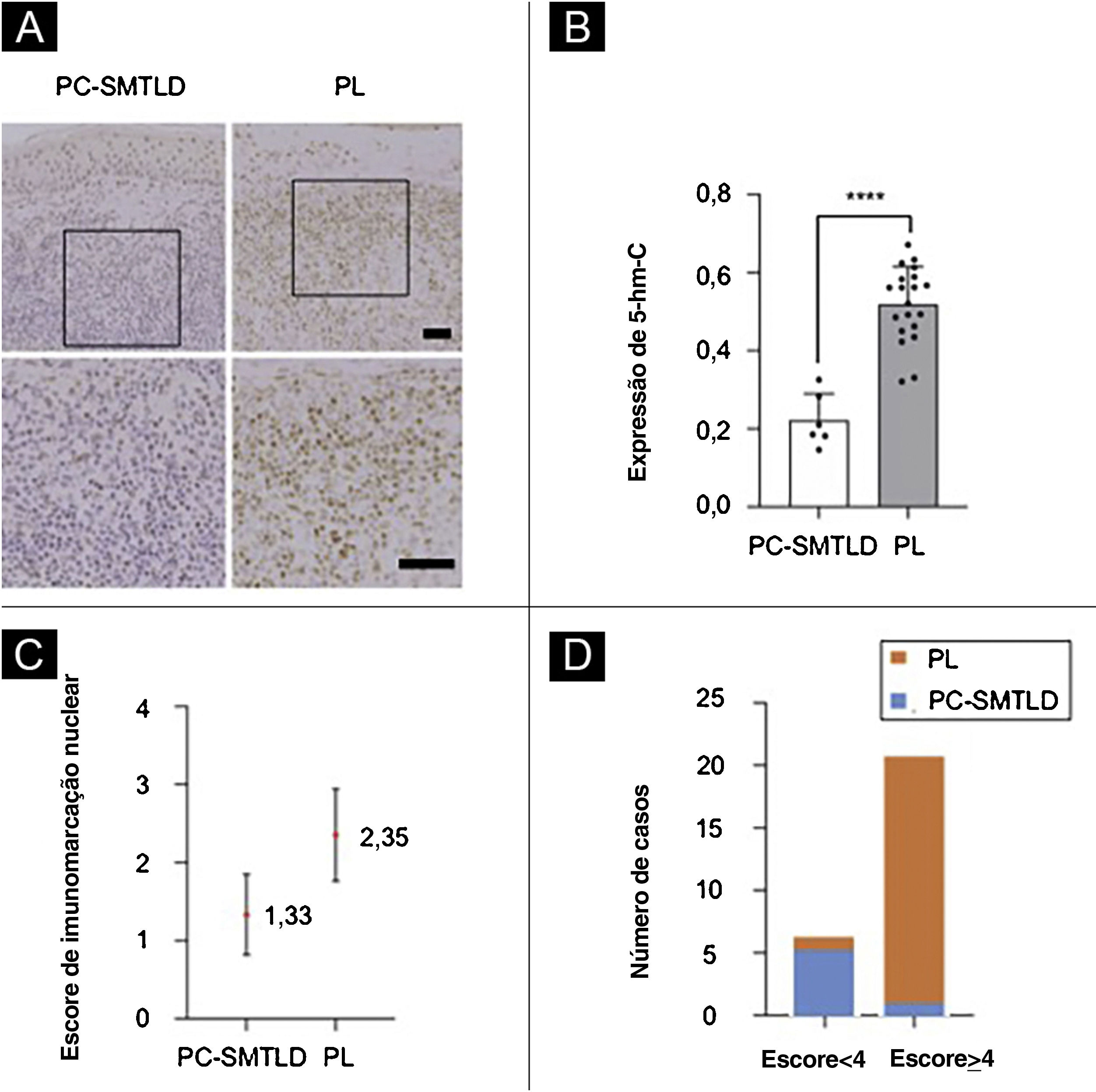
Análise imuno‐histoquímicaTodos os 26 casos demonstraram forte imunorreatividade nuclear distinta para 5‐hmC na epiderme (fig. 3A), enquanto a imunomarcação em linfócitos infiltrados foi diversificada. A taxa média de expressão positiva de 5‐hmC foi de 22,14% (IC95%: 22,14 ± 4,99) em seis casos de PCSM‐TCLPD e 51,43% (IC95%: 51,88 ± 4,10) em 15 casos de PL. Diminuição significante da expressão de 5‐hmC foi observada em casos de PCSM‐TCLPD quando comparados com PL (p < 0,0001; fig. 3B).
Expressão de 5‐hmC. Doença linfoproliferativa cutânea primária de células T CD4+ pleomórficas pequenas/médias (PCSM‐TCLPD) e pseudolinfoma (PL): diminuição significante da expressão de 5‐hmC foi observada em PCSM‐TCLPD quando comparada com PL na derme (fig. 3A; ****p < 0,0001; fig. 3B). A diferença no escore de imunomarcação nuclear para 5‐hmC foi estatisticamente significante com escores mais altos no grupo PL (média = 2,35, desvio padrão [DP = 0,50]) quando comparado à PCSM‐TCLPD (média = 1,33, DP = 0,47, p = 0,0014; fig. 3C). A maioria dos casos de PL (95%; 19/20) estava no grupo de alta expressão (fig. 3D).
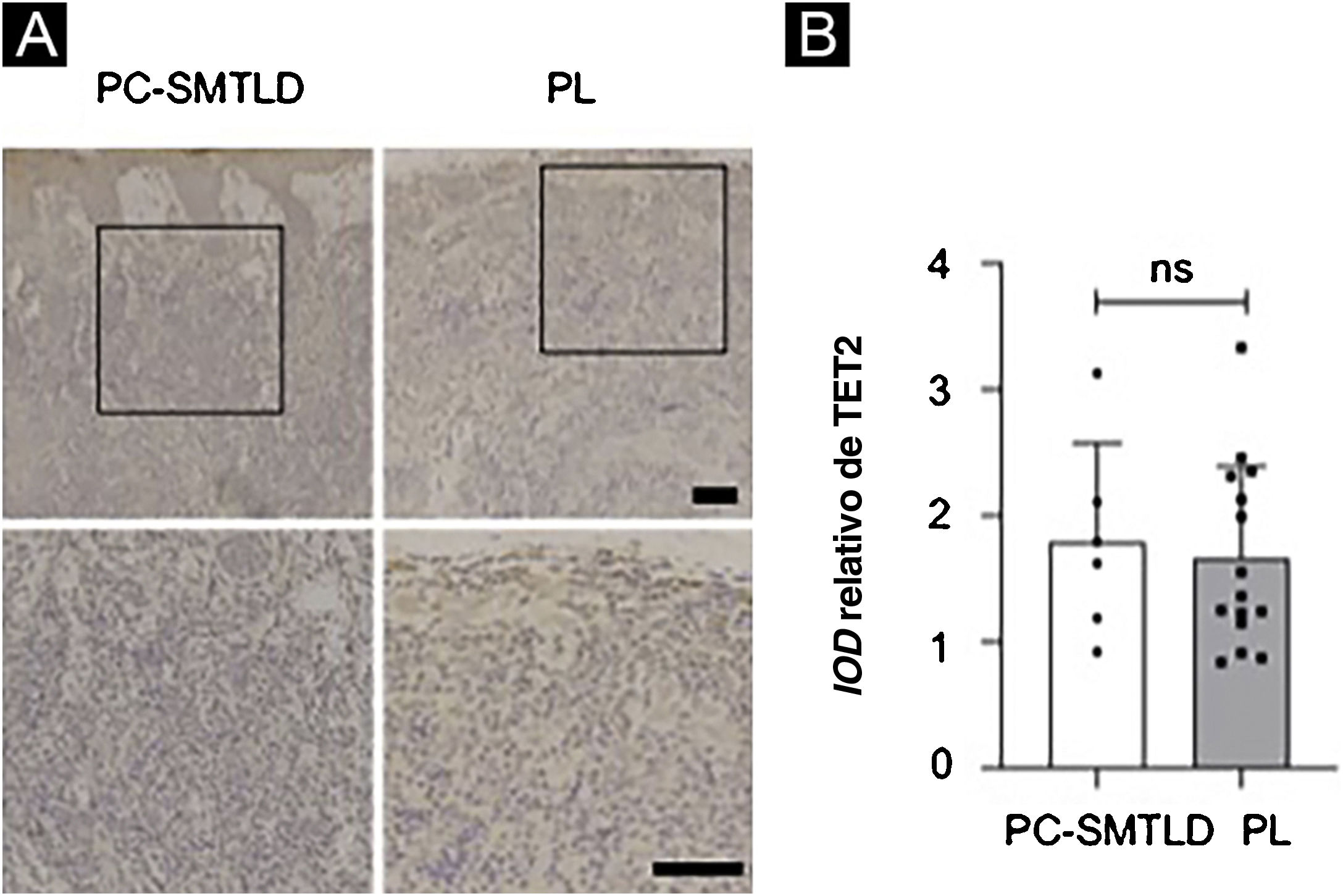
A pontuação de imunomarcação nuclear de 5‐hmC pode ser obtida de acordo com os padrões de pontuação de intensidade de imunomarcação e o método integral semiquantitativo mencionados anteriormente. A diferença na pontuação de imunomarcação nuclear para 5‐hmC foi estatisticamente significante, com pontuações mais altas no grupo PL (média = 2,35, DP = 0,50) em comparação com PCSM‐TCLPD (média = 1,33, DP = 0,47, p = 0,0014; fig. 3C). A maioria dos casos de PL (95%; 19/20) foi classificada como de alta expressão (fig. 3D). Nenhuma diferença significante na expressão de TET2 foi observada nos dois grupos (fig. 4).
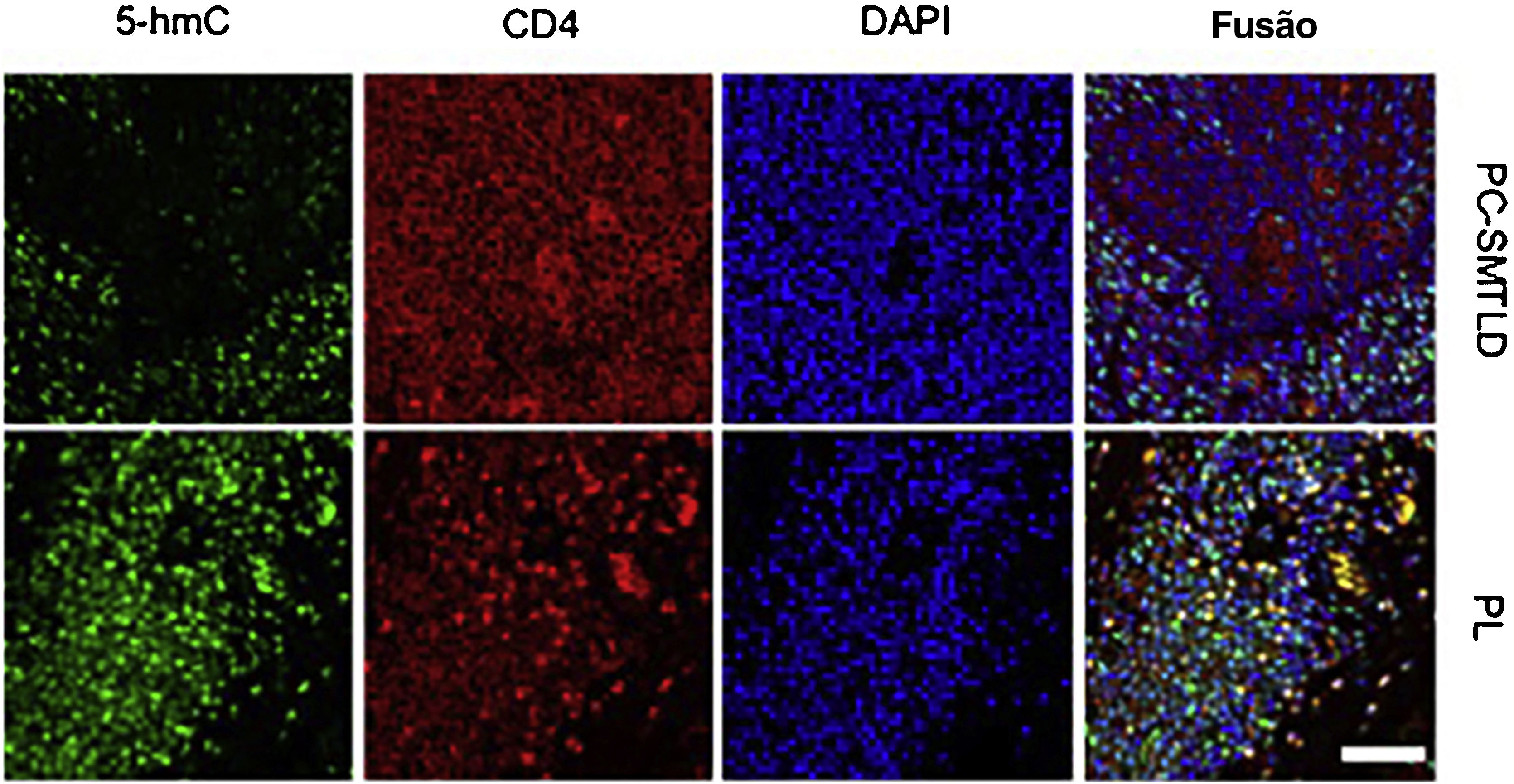
Análise de imunofluorescênciaConsiderando que os linfócitos infiltrados nas lesões consistem em células T neoplásicas e linfócitos reativos, foi realizada a imunofluorescência (IF) com dupla marcação de 5‐hmC e CD4 para avaliar a fonte celular de redução de 5‐hmC. Como esperado, a redução de 5‐hmC ocorreu nas células T CD4+ (fig. 5).
DiscussãoForam identificadas alterações no padrão epigenético relacionado à metilação do DNA nos casos de PCSM‐TCLPD. Especificamente, observou‐se que a expressão de 5‐hmC era altamente preservada em PL, enquanto houve diminuição significante da expressão de 5‐hmC em PCSM‐TCLPD. Em linfomas sistêmicos, a regulação negativa da expressão de 5‐hmC parece ser um evento chave para a tumorigênese.9,17 Especula‐se que esse também possa ser o caso em PCSM‐TCLPD. Alternativamente, a expressão diminuída de 5‐hmC pode representar um epifenômeno secundário a uma via distinta que leva à carcinogênese.18,19 Portanto, mais estudos serão fundamentais para esclarecer qual papel, se houver, a regulação negativa de 5‐hmC desempenha em doenças linfoproliferativos.
Do ponto de vista diagnóstico, tanto a reatividade quanto a apresentação atípica de linfócitos CD4+ durante o processo inflamatório podem ser diagnosticados erroneamente como pseudolinfoma. Os presentes dados mostraram que a ausência de coloração de 5‐hmC foi altamente sugestiva de PCSM‐TCLPD. Nesse caso, o uso da coloração de 5‐hmC pode ser um complemento útil para diferenciar PCSM‐TCLPD de PL. Isso é semelhante à melanocitopatia, na qual a expressão de 5‐hmC demonstrou ser um marcador potencial para diferenciar melanoma maligno de nevos benignos.12 Entretanto, com o aumento do tamanho da amostra, localização em todo o genoma e a aplicação de métodos de detecção de tecido com 5‐hmC, mais estudos do genoma, como sequenciamento de células únicas e sequenciamento de transcriptoma espacial, são necessários para esclarecer ainda mais o papel da 5‐hmC em doenças raras como distúrbios proliferativos linfoides.
Diversos estudos mostraram que a metilação do DNA está intimamente relacionada com a ocorrência de tumores diversos. A enzima TET e 5‐hmC desempenham papéis importantes na desmetilação da citosina do DNA. Estudos20 demonstraram que a metilação do DNA de genes supressores de tumor foi encontrada em vários tumores, como leucemia, câncer de cólon, câncer de pulmão, câncer de mama, câncer de vesícula biliar e câncer de próstata. Os níveis de proteína TET e 5‐hmC estavam significantemente reduzidos em tumores malignos, o que sugere que a 5‐hmC pode ser um marcador biológico do tumor. O nível de 5‐hmC está relacionado ao grau de diferenciação de alguns tumores e intimamente relacionado ao prognóstico dos mesmos.21 Embora diferentes mecanismos possam afetar a redução de 5‐hmC no câncer, a mutação da enzima TET2 é responsável pela redução dos níveis de 5‐hmC no linfoma de células T e tumores mieloproliferativos.8,9,22 A redução dos níveis de 5‐hmC em doenças linfoproliferativas CD4+ pode ser um indicador de mutações de TET2. Assim, foram avaliados os níveis de expressão de 5‐hmC e TET2 em PCSM‐TCLPD e PL através de imuno‐histoquímica, com o objetivo de explorar as alterações de 5‐hmC e da enzima TET2 que catalisa a oxidação de 5‐mC. Por fim, verificou‐se que o nível de expressão de 5‐hmC em PCSM‐TCLPD foi menor que em PL, enquanto a expressão de TET2 não foi diferente. Uma possível razão foi a alteração da atividade de TET2 em vez do nível de expressão.
Em algumas neoplasias malignas, a perda de 5‐hmC parece estar associada a um curso mais agressivo e pior prognóstico. Em contraste, PCSM‐TCLPD é um tipo de doença linfoproliferativa com potencial benigno ou maligno indeterminado, frequentemente com curso benigno e bom prognóstico. A redução de 5‐hmC na PCSM‐TCLPD sugere que a redução de 5‐hmC pode não se limitar a tumores malignos e invasivos, ou que pode haver outros mecanismos para neutralizar o efeito da redução de 5‐hmC, de modo que a doença apresenta caráter benigno.
Nas primeiras descrições essas entidades foram classificadas como linfoma periférico de células T, sem outra especificação (PTCL‐NOS, do inglês peripheral T‐cell lymphoma, not otherwise specified). Em 2008, a OMS classificou o PTCL‐NOS como “linfoma cutâneo primário de células T de tamanho pequeno/médio positivo para CD4”. Embora alguns casos tenham sido fatais, o prognóstico em muitos casos foi surpreendentemente bom, e alguns estudos confirmaram essa observação preliminar. Após oito anos de seguimento, descobriu‐se que esses linfomas eram de fato indolentes ou tinham potencial maligno indeterminado; portanto, é duvidoso que possam ser definidos como linfomas genuínos. Alterações foram feitas na nova classificação dos linfomas cutâneos da OMS de 2016, com o estabelecimento temporário de novas doenças designando condições com potencial metastático como linfomas e renomeando doenças com potencial maligno indeterminado como doenças linfoproliferativas (PCSM‐TCLPD). À medida que a experiência nessa área continua a crescer, espera‐se que novas doenças sejam desmembradas a partir das já existentes.
No Yale Cancer Center, pesquisadores observaram a heterogeneidade da PCSM‐TCLPD,23 sugerindo que é importante diferenciar casos indolentes de PCSM‐TCLPD de casos mais agressivos em virtude das grandes diferenças no prognóstico e tratamento entre esses grupos. Nos casos relatados, concorda‐se que pacientes com lesão única e as características histopatológicas e imunofenotípicas descritas anteriormente têm bom prognóstico, com taxa de sobrevida estimada em cinco anos de 75%. Portanto, devem ser conduzidas com tratamento local na maioria dos casos. No entanto, o estadiamento é essencial para eliminar os casos de envolvimento sistêmico. Nos casos raros em que as características invasivas são desconhecidas, a quimioterapia citotóxica e a radioterapia de campo envolvido podem ser usadas como no linfoma cutâneo primário inicial de células T. Nesse experimento, foi estudada a expressão de 5‐hmC em casos de PCSM‐TCLPD e PL. Em virtude da diferença na expressão de 5‐hmC, ela pode ser utilizada como um dos indicadores para o diagnóstico diferencial entre PCSM‐TCLPD e PL, também tornando a 5‐hmC um novo potencial marcador biológico para o diagnóstico de PCSM‐TCLPD. Isso também explica a razão pela qual parte dos casos de PCSM‐TCLPD tem potencial maligno, e permitindo diagnosticar PCSM‐TCLPD com tendência maligna na fase inicial, possibilitando uma intervenção precoce. Assim, a avaliação do estágio e o melhor tratamento podem ser alcançados.
ConclusãoOs autores estudaram o padrão de expressão de 5‐hmC em pseudolinfoma e doenças linfoproliferativas e verificaram que a 5‐hmC geralmente diminui em doenças linfoproliferativas na avaliação IHQ. Por fim, concluíram que esse biomarcador epigenético estava diminuído na maioria dos casos de doença linfoproliferativa, mas não em casos benignos (pseudolinfoma).
Suporte financeiroEste estudo recebeu suporte financeiro da The World‐Class Universities (Disciplines) and The Characteristic Development Guidance Funds for the Central Universities (Concessão n° PY3A0241001016), National Natural Science Foundation of China (Concessão n° 81372912).
Contribuição dos autoresJiahui Hu: Concepção do estudo; concepção e supervisão dos experimentos; obtenção, análise e interpretação dos dados; análise estatística; revisão crítica da literatura; redação e aprovação do manuscrito.
Sonemei Geng: Análise e interpretação dos dados; redação do manuscrito; revisão crítica da literatura e revisão crítica do manuscrito; aprovação da versão final do manuscrito.
Xingyue Zhang: Aprovação da versão final do manuscrito; obtenção, análise e interpretação dos dados; revisão crítica do manuscrito.
Lihong Zhao: Interpretação dos dados; redação do manuscrito; revisão crítica da literatura e revisão crítica do manuscrito; aprovação da versão final do manuscrito.
Qiang Zhao: Interpretação dos dados; revisão crítica do manuscrito; aprovação da versão final do manuscrito.
Conflito de interessesNenhum.
Como citar este artigo: Hu J, Zhang X, Zhao L, Zhao Q, Geng S. Decrease of 5‐hydroxymethylcytosine in primary cutaneous CD4+ small/medium sized pleomorphic T‐cell lymphoproliferative disorder. An Bras Dermatol. 2024;99:27–33.
Trabalho realizado no Second Affiliated Hospital, Escola de Medicina, Xian Jiaotong University, Xian, China.




![Expressão de 5‐hmC. Doença linfoproliferativa cutânea primária de células T CD4+ pleomórficas pequenas/médias (PCSM‐TCLPD) e pseudolinfoma (PL): diminuição significante da expressão de 5‐hmC foi observada em PCSM‐TCLPD quando comparada com PL na derme (fig. 3A; ****p < 0,0001; fig. 3B). A diferença no escore de imunomarcação nuclear para 5‐hmC foi estatisticamente significante com escores mais altos no grupo PL (média = 2,35, desvio padrão [DP = 0,50]) quando comparado à PCSM‐TCLPD (média = 1,33, DP = 0,47, p = 0,0014; fig. 3C). A maioria dos casos de PL (95%; 19/20) estava no grupo de alta expressão (fig. 3D). Expressão de 5‐hmC. Doença linfoproliferativa cutânea primária de células T CD4+ pleomórficas pequenas/médias (PCSM‐TCLPD) e pseudolinfoma (PL): diminuição significante da expressão de 5‐hmC foi observada em PCSM‐TCLPD quando comparada com PL na derme (fig. 3A; ****p < 0,0001; fig. 3B). A diferença no escore de imunomarcação nuclear para 5‐hmC foi estatisticamente significante com escores mais altos no grupo PL (média = 2,35, desvio padrão [DP = 0,50]) quando comparado à PCSM‐TCLPD (média = 1,33, DP = 0,47, p = 0,0014; fig. 3C). A maioria dos casos de PL (95%; 19/20) estava no grupo de alta expressão (fig. 3D).](https://static.elsevier.es/multimedia/26662752/0000009900000001/v1_202401040746/S2666275223002163/v1_202401040746/pt/main.assets/thumbnail/gr3.jpeg?xkr=ue/ImdikoIMrsJoerZ+w99UWGL/RPJZyNYV9edvxfE4=)



