A fisiopatogenia da urticária ainda é pouco conhecida. Estudos recentes demonstram que a ativação da coagulação está correlacionada com a atividade clínica da urticária crônica espontânea. Coagulação e inflamação estão fortemente ligadas.
ObjetivosCorrelacionar a gravidade e atividade da urticária crônica espontânea com os níveis de D‐dímero, proteína C‐reativa e teste do soro autólogo em pacientes com urticária crônica espontânea.
MétodosForam incluídos no estudo 55 pacientes com diagnóstico de urticária crônica espontânea. Os níveis de D‐dímero foram medidos por ensaio fluorescente ligado a enzima; a proteína C‐reativa, pelo método nefolemétrico; e foram realizados testes do soro autólogo nos pacientes que suspenderam a terapia anti‐histamínica. A gravidade da doença foi avaliada aplicando o escore de atividade da urticária.
ResultadosPacientes com urticária crônica espontânea grave e de difícil controle apresentavam níveis séricos elevados de D‐dímero e também resultado positivo para o teste do soro autólogo. Pouca correlação foi demonstrada entre a gravidade da urticária crônica espontânea e a proteína C‐reativa.
ConclusãoOs pacientes com urticária crônica espontânea grave apresentaram sinais de fibrinólise ativada. A maioria dos pacientes com altos escores clínicos apresenta valores elevados de D‐dímero. Pacientes com resultados positivos para o teste do soro autólogo também apresentaram urticária crônica espontânea mais grave e precisaram de mais medicamentos para o controle da doença. Finalmente, foi encontrada pouca correlação entre os níveis de proteína C‐reativa e a gravidade da doença.
Limitações do estudoA principal limitação foi a pequena amostra de pacientes. Em nossos pacientes, demonstramos que os níveis séricos do D‐dímero e o teste do soro autólogo podem se comportar como marcadores preditivos de gravidade e atividade da urticária crônica espontânea.
Estima‐se que a prevalência de urticária crônica (UC) na população em geral varie entre 0,5% e 5%. A incidência de UC foi estimada em 1,4% ao ano. Alguns pacientes com UC podem apresentar urticária e angioedema simultaneamente ou separadamente.1 A urticária crônica espontânea (UCE) afeta grandemente a qualidade de vida em decorrência de seus sintomas debilitantes e imprevisíveis.1
Nos últimos anos, alguns autores demonstraram a ativação do sistema de coagulação em pacientes com UC por geração de trombina, iniciada pelo aumento da expressão do fator tecidual (FT) da coagulação nos eosinófilos. Isso determina uma possível contribuição para o aumento da permeabilidade capilar. Esses pacientes geralmente apresentam marcadores séricos elevados de coagulação e fibrinólise, como o fragmento1+2 de protrombina e o D‐dímero, cujos níveis parecem correlacionar‐se com a gravidade da UC.2 Em modelos animais, a trombina gera aumento da permeabilidade capilar por ação direta no endotélio e também indiretamente, induzindo a liberação de mediadores pró‐inflamatórios pelos mastócitos, o que acarreta aumento de C5a na ausência de C3 sem ativação da primeira parte da cascata de complemento.2–4 É possível que os autoanticorpos e a cascata de coagulação ajam em sinergia em alguns pacientes com UC.2
Uma revisão sistemática conduzida por Rabelo‐Filardi et al., que envolveu 34 estudos publicados sobre UCE, concluiu que a gravidade clínica da UC pode prever a duração da doença e que parâmetros laboratoriais, como a elevação dos níveis séricos dos fragmentos1+2 de protrombina, de D‐dímero e proteína C‐reativa (ProtCR), também podem retratar a gravidade da doença e sua resistência ao tratamento convencional.5 Pacientes com sintomas mais graves podem ter cursos de doença mais persistentes. Depois disso, outros autores realizaram revisões mais extensas sobre vários biomarcadores na UCE.6–8
Coagulação e inflamação estão fortemente conectadas. Por exemplo, citocinas inflamatórias, como a interleucina‐6 (IL‐6) e o GM‐CSF, induzem a expressão de FT nos eosinófilos, enquanto o complexo fator VII+FT ativado liga‐se ao receptor 2 ativado por protease (PAR‐2) e regula a resposta inflamatória. Portanto, é factível que a ProtCR, um marcador de resposta inflamatória amplamente utilizado, esteja associada à atividade da UCE de maneira semelhante aos marcadores de coagulação sanguínea.4
Estudos envolvendo o comportamento dos níveis séricos de ProtCR, D‐dímero e/ou resultados de testes cutâneos do soro autólogo (TSA) em pacientes latino‐americanos que sofrem de UCE são raros na literatura indexada.9,10
O objetivo deste estudo é investigar os níveis plasmáticos de D‐dímero e ProtCR, bem como a positividade do TSA e a gravidade clínica da UCE em nossos pacientes e determinar quais desses exames complementares podem ser relevantes para a gravidade clínica dessa doença em pacientes brasileiros atendidos em um centro terciário.
MétodoTrata‐se de um estudo transversal em que foram avaliados 55 pacientes com diagnóstico de UCE, acompanhados no ambulatório de urticária da Disciplina de Dermatologia da Faculdade de Medicina do ABC.
Os critérios de inclusão foram: pacientes acompanhados ambulatorialmente com diagnóstico clínico de UCE e recorrência das urticas no mínimo quatro vezes por semana no momento da inclusão no estudo. Após obtenção do termo de consentimento, foi realizado o preenchimento da ficha padrão aplicada a todos os pacientes acompanhados no ambulatório. ProtCR e D‐dímero foram dosados em todos os pacientes na primeira consulta; já o TSA foi realizado na maioria deles, na consulta seguinte, visto que tinham que se submeter a um período sem uso de anti‐histamínicos, conforme já havia sido preconizado por Konstantinou et al.,11 impossibilitando sua realização em alguns pacientes. Todos os TSA foram realizados no período da manhã na segunda visita do paciente ao serviço. Os pacientes foram acompanhados em consultas mensais.
Os participantes do estudo foram instruídos a preencher o escore de atividade da urticária (UAS) em casa. Os valores do UAS no dia anterior do TSA foram relevantes para comparar a gravidade da UCE com os resultados desses testes. A atividade da doença foi avaliada pelo escore de atividade EAACI/GA2LEN/EDF1, que é composto por: escore de pápulas – nenhum=0, leve (< 20 lesões em 24 horas)=1, moderado (20‐50 lesões em 24 horas)=2, intenso (> 50 lesões em 24 horas)=3 – e escore de prurido – nenhum prurido=0, leve (presença, mas não irritante ou problemático)=1, moderado (problemático, mas não interfere nas atividades da vida diária ou no sono)=2 e intenso (prurido grave, interfere na atividade diária normal ou no sono)=3. A atividade da doença é pontuada de 0 a 6, de acordo com o consenso anterior publicado por Zurberbier et al., no período em que o estudo foi realizado.12 Tomando isso como base, a atividade da doença foi classificada da seguinte maneira: UAS pontuando 0 foi considerada urticária controlada; UAS de 1 a 3, classificada como pontuação baixa; e UAS de 4 a 6, pontuação alta.
Os critérios de exclusão foram presença de qualquer doença ou medicamento utilizado que pudesse alterar a cascata de coagulação (anticoagulantes orais ou parenterais, antifibrinolíticos, antiagregantes plaquetários), diagnóstico incerto de UCE (decorrente da presença de sinais ou sintomas como febre, artralgia, linfadenopatia aguda, doenças infecciosas crônicas, gravidez ou sinais cutâneos urticária vasculite durante exame físico), história atual ou pregressa de trombose.
A concentração sérica de ProtCR foi medida pelo método nefelométrico (Dade Behring Inc., Newark, DE, EUA) em nosso laboratório central. ProtCR sérica elevada foi definida como ≥ 5,0mg/L.
Os níveis de D‐dímero foram medidos em pacientes por meio de ensaio fluorescente ligado a enzima (ELFA) (equipamento BioMérieux, modelo VIDAS®), e os resultados apresentados em mg/L FEU (unidade equivalente a fibrinogênio). Os valores ≤ 0,50mg/L FEU foram considerados negativos, e os> 0,50 mg/L FEU, incluídos como positivos.
Todos os pacientes do estudo foram conduzidos com tratamento de primeira linha para a doença, baseado em medicamentos anti‐histamínicos (anti‐H1) de segunda geração em doses de simples a quadruplicadas. Para os pacientes classificados com UAS> 1 e não responsivos ao tratamento com dose quadruplicada de anti‐H1 diariamente e com duração mínima de um mês, adicionamos uma terapia adjuvante com um dos seguintes medicamentos de terceira linha: ciclosporina, dapsona, colchicina, hidroxicloroquina, montelucaste e prednisona oral durante sete dias nas crises de urticária e/ou angioedema.
Para quantificar a resposta de cada paciente ao tratamento estabelecido, foi criado um escore de resposta no momento da remissão da doença (UAS=0, por no mínimo 30 dias: grau 1, quando o paciente apresenta remissão da doença com apenas uma dose de medicamento anti‐H1; grau 2, se o paciente obteve controle da urticária com duas doses de anti‐H1; grau 3, se houve controle da urticária com três doses de anti‐H1; grau 4, se o controle da urticária se deu com quatro doses de anti‐H1; e grau 5, se o controle da doença ocorreu com cinco doses de anti‐H1 combinado com um medicamento adjuvante.
Pacientes com dificuldade no controle da UCE e necessidade de altas doses de medicamentos para tal foram considerados com baixo escore de resposta; já aqueles com remissão da doença usando poucas doses de remédios foram classificados com alto escore de resposta.
Variáveis qualitativas, tais como sexo, classificação da gravidade da UCE (baixo/alto), medicação adjuvante (sim/não) e positividade do TSA, foram representadas por frequências absolutas (n) e relativas (%). As variáveis contínuas quantitativas, normalmente distribuídas, tais como ProtCR e D‐dímero, foram calculadas usando valores médios± desvio padrão (DP), mediana, valores mínimos e máximos. Foi utilizado o teste t de Student para a comparação entre os valores médios do UAS com relação aos pacientes com TSA positivo versus negativo, para os valores médios de D‐dímero entre pacientes que precisavam ou não de medicação adjuvante, para os valores médios de D‐dímero entre pacientes com escore clínico alto versus baixo, e para os valores médios de D‐dímero nos pacientes com UCE com angioderma versus UCE sem angioderma. O coeficiente de correlação de Pearson foi utilizado para fornecer uma medida da força de associações lineares entre as variáveis D‐dímero e UAS, D‐dímero e número de medicamentos necessários para controlar a UCE, ProtCR versus UAS, ProtCR versus escore clínico (número de doses) e ProtCR versus número de anti‐H1.
A associação entre os pacientes com TSA positivo e negativo versus UAS alto e baixo foi realizada pelo teste exato de Fisher. Foi calculada a odds ratio da tabela. Os softwares Statistical Package for the Social Science (SPSS V17), Minitab 16 e Excel Office 2010 foram utilizados para a realização das análises estatísticas. O nível de significância considerado nas análises comparativas foi de 5% (p <0,05). O projeto foi aprovado no Comitê de Ética sob o parecer n° 2853158.
ResultadosDados demográficosDo total de 55 pacientes com UCE, 40 (72,72%) eram do sexo feminino e 15 (27,27%) do sexo masculino. Em relação à idade (18 a 72 anos), a média etária na consulta inicial foi de 41±14,02 anos (média±DP). Vinte e seis (47,22%) pacientes apresentaram urticária associada a angioedema.
Atividade da doença (gravidade)A gravidade da UCE (escore de atividade da urticária, UAS) foi avaliada de acordo com o escore adaptado de Zuberbier et al.1 Com o objetivo de encontrar uma relação entre os parâmetros laboratoriais e a gravidade da urticária, as variáveis TSA, D‐dímero e ProtCR foram relacionadas com a UAS do dia anterior dos exames. Para facilitar a análise, foram separados em dois grupos: baixo escore (UAS 1‐3) e alto escore (UAS 4‐6). Vinte e cinco pacientes foram classificados como baixo escore (45%) e 30 pacientes como alto escore (55%) (tabela 1).
Gravidade da UCE versus TSADos 55 pacientes, 29 puderam realizar o TSA. Os demais não puderam suspender a terapia anti‐H1 pelo período determinado pelo método (Konstantinou et al).11 Os resultados dos valores médios do UAS para pacientes com TSA positivo (4,79) foram significativamente maiores em comparação aos valores médios do UAS dos pacientes com resultados negativos de TSA (3,53) (teste t de Student; p <0,05).
Os resultados da tabela 2 indicam que houve associação significativa entre o TSA e UAS (teste exato de Fisher; p=0,017). Dos pacientes com TSA positivo, 61% atendem aos critérios de inclusão no grupo de escores altos de gravidade da UCE, enquanto 73% dos pacientes com TSA negativo estavam no grupo de escores baixos. A razão de probabilidade entre as variáveis indicou um resultado igual a 4,30 – ou seja, a chance de um paciente com TSA positivo ter alto escore de atividade urticária é 4,3 vezes maior em comparação ao paciente com TSA negativo.
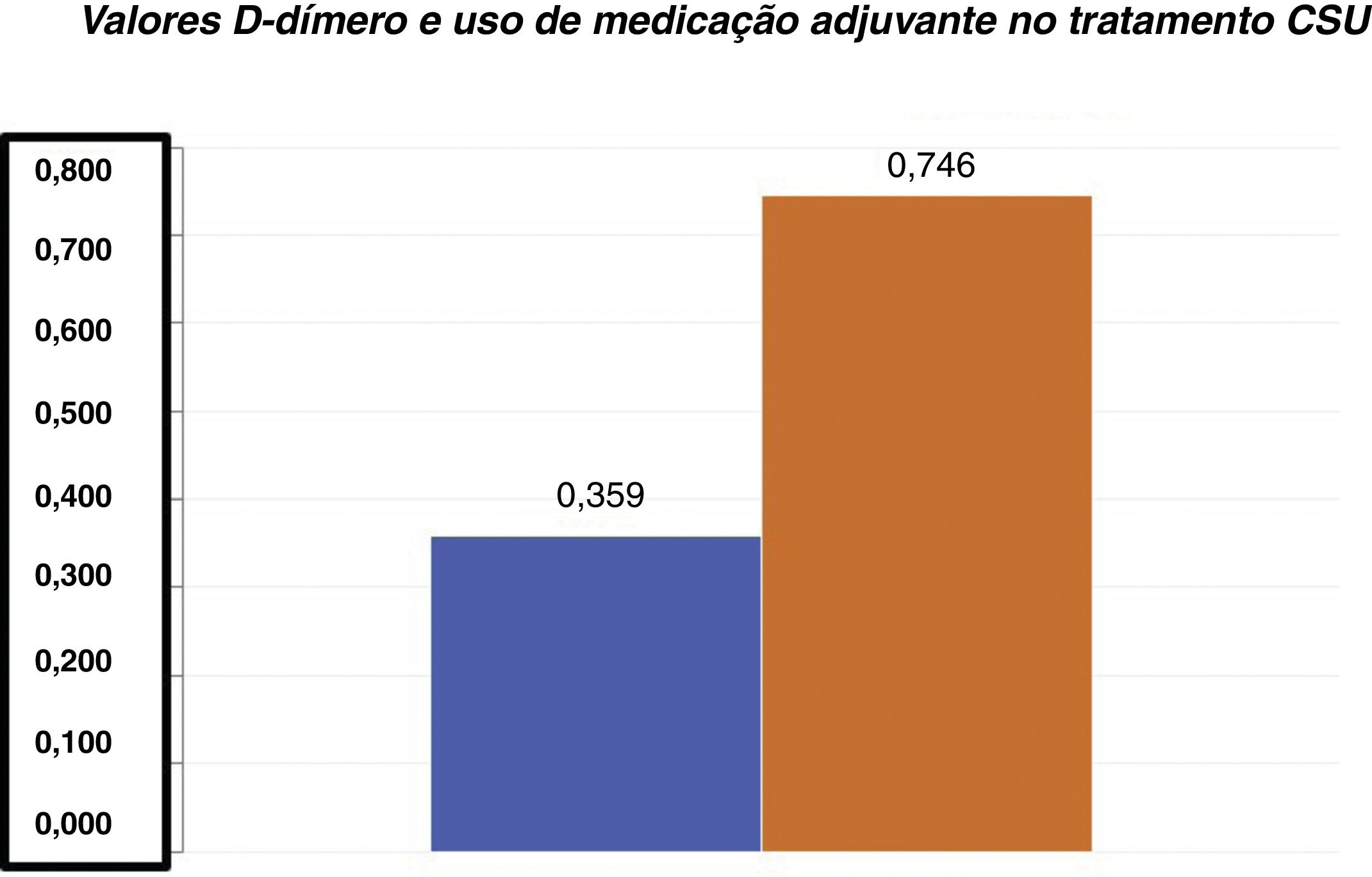
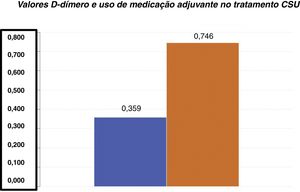
D‐dímero versus gravidade da UCEOs valores médios de D‐dímero em nossa amostra foram de 0,85±0,324mg/L FEU (média±DP). Entre os 55 pacientes com UCE, 22 demonstraram níveis plasmáticos elevados dessa variável (valores entre 0,55 e 1,48mg/L FEU). A média de D‐dímero para o grupo de pacientes que não precisaram de medicação adjuvante (0,359±0,206mg/L FEU) foi significativamente inferior em relação à média de D‐dímero do grupo de pacientes que precisaram de um medicamento adjuvante (0,746±0,444mg/L FEU) para o controle da urticária (teste t de Student; p <0,001 – fig. 1).
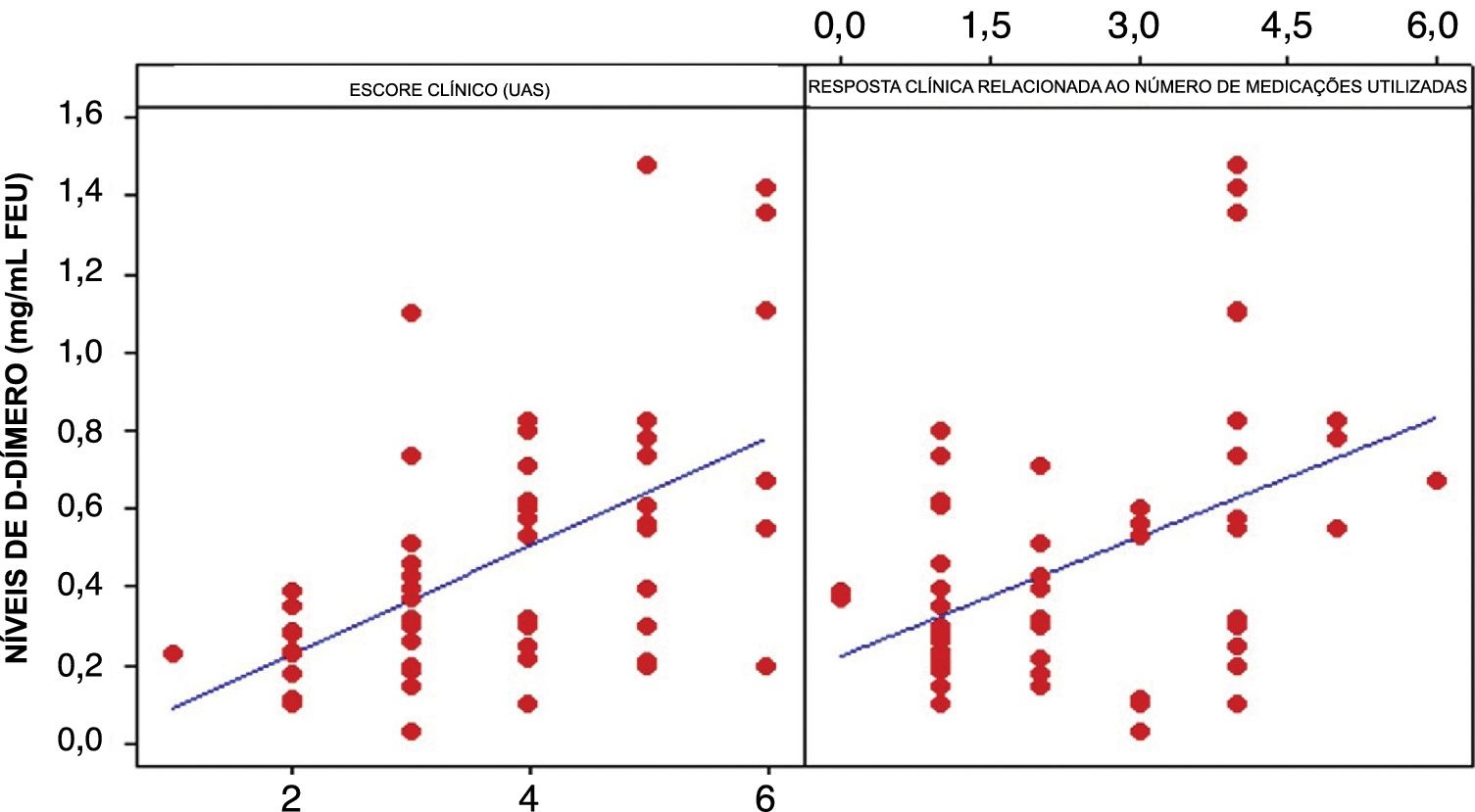
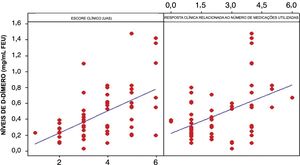
A análise estatística dos níveis do D‐dímero e do UAS mostrou que existe uma relação forte e positiva entre essas duas variáveis. Observou‐se uma correlação de 53,1% (fig. 2). Houve também uma correlação significativa entre o número de medicamentos necessários para controlar a UCE e os níveis plasmáticos elevados de D‐dímero (fig. 2). Ambas as correlações foram significativas (p <0,01).
Foi observado valor médio de D‐dímero significativamente inferior em pacientes com baixo escore clínico (0,321±0,221mg/L FEU) em relação aos pacientes com alto escore clínico (0,598±0,374mg/L FEU) (teste t de Student; p=0,002).
Vinte e dois pacientes apresentaram níveis séricos elevados de D‐dímero (> 0,5mg/mL FEU). Entre eles, 18 (81,81%) foram classificados como tendo uma UCE com alto escore de atividade e controle precário da doença (UAS 4‐6). Doze pacientes (54,5%) apresentaram alto escore de UAS (4‐6) e 32,7% desses pacientes precisaram de três ou mais medicamentos em associação para alcançar a remissão da UCE durante o acompanhamento.
No que diz respeito aos pacientes com UCE e angioedema ou UCE sem angioedema, não foi encontrada significância estatística em relação aos níveis plasmáticos de D‐dímero nos dois grupos (teste t de Student; p=0,061). Os valores médios e desvios padrão de D‐dímero foram, respectivamente, 0,563±0,369mg/mL FEU e 0,390±0,297mg/mL FEU. Apesar de a diferença não ter sido significativa, nota‐se uma tendência de maior resultado de D‐dímero para pacientes com UCE e angioderma.
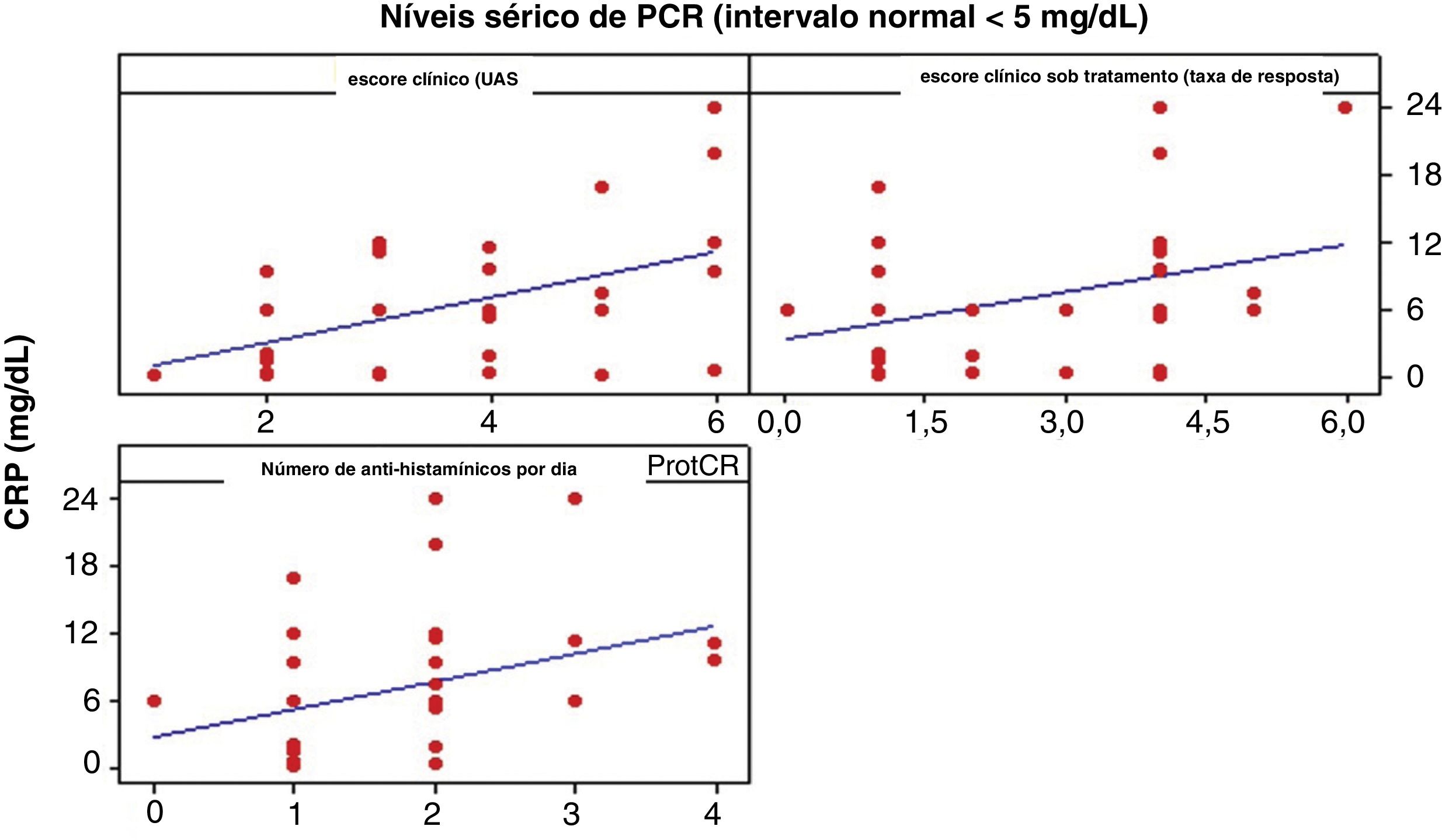
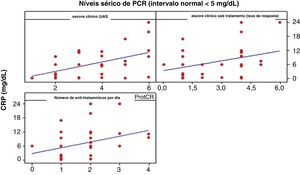
ProtCR versus UASA correlação entre ProtCR e UAS foi moderada e positiva, igual a 0,496 (p <0,01), indicando que um aumento nos níveis ProtCR é acompanhado por um aumento discreto no UAS (fig. 3).
DiscussãoNa última década, vários estudos foram realizados para avaliar o papel da ativação da coagulação na fisiopatologia da UCE. Os níveis plasmáticos de D‐dímero, que é um marcador para a formação de fibrina e sua posterior degradação, foram propostos como um biomarcador de atividade e gravidade na UCE. Essa questão foi amplamente revisada por Kolkhir et al.,6 Puxeddu et al.7 e Deza et al.,8 e esses autores concluíram que a ProtCR e o D‐dímero podem estar relacionados com a gravidade da UCE em alguns pacientes. No entanto, a revisão de literatura é composta por estudos distintos que aplicaram diferentes métodos (séries de casos, estudos não cegos, relatos de casos), dificultando uma conclusão final sobre essa questão, principalmente no que se refere à real utilidade desses exames complementares para prever a gravidade da UCE em diferentes coortes de pacientes.
Asero et al.13 publicaram, em 2007, um dos primeiros estudos que avaliou 37 pacientes com UC com dosagem de fragmentos1+2 de protrombina, D‐dímero, fator XIIa e fator VIIa. Nesse estudo, os autores encontraram níveis médios elevados de D‐dímero em pacientes com UC, em oposição ao grupo controle saudável, demonstrando também marcadores da ativação da fibrinólise em seus pacientes.13 Foi então comprovado pelos autores que a ativação da coagulação e, consequentemente, a presença do D‐dímero, podem se correlacionar com a gravidade da doença.13 Achados semelhantes relacionados aos níveis plasmáticos do D‐dímero e à gravidade da UCE foram obtidos em nosso estudo.
Acredita‐se que ocorra uma elevação nos níveis séricos de ProtCR, provavelmente devido à expressão cutânea de IL‐6, em pacientes com UCE grave.2 A correlação entre os níveis séricos de ProtCR e marcadores de coagulação sugere uma inter‐relação entre inflamação e coagulação na patogênese da UC. O papel exato desse fenômeno (ativação da coagulação e fibrinólise) atuando como peça central da fisiopatologia da doença ou epifenômeno atuando como um amplificador da inflamação, contudo, ainda não está esclarecido. Em nosso estudo, não houve um aumento estatisticamente significante da ProtCR.
Cugno et al.2 relataram que os eosinófilos, em biópsias, expressaram em estudo imuno‐histoquímico TF em pacientes com UC, que foram ativados provavelmente por IL‐6 e GM‐CSF nessas células, e o TF estava envolvido como iniciador da via extrínseca da cascata de coagulação, na milha da derme.2
Esses autores sugeriram que o D‐dímero é um biomarcador superior em termos de sensibilidade ao produto de degradação da fibrina (PDF) e à ProtCR, além de demonstrarem que o PDF, os níveis de D‐dímero e de ProtCR podem ser significativamente correlacionados com a atividade da doença em alguns pacientes com UC.2 Apesar disso, em nosso estudo a correlação entre os níveis séricos de ProtCR e a gravidade da UCE foi inconsistente. Esse fato pode ser justificado por algumas limitações em nosso estudo: menor diversidade étnica populacional em nosso país em comparação a Ásia e Europa, número pequeno de pacientes incluídos em nossa análise por tratar‐se de apenas um centro de urticária e período curto de análise (três anos).
No que se refere aos aspectos étnicos, no Brasil há uma frequente miscigenação racial, em oposição a outros países da América Latina. Esse fato pode exercer influência na predominância entre os sexos em pacientes com UCE, uma vez que encontramos uma frequência de 72,72% de pacientes do sexo feminino, moderadamente mais prevalente em relação aos pacientes atendidos em Buenos Aires. Nesta cidade, que é outra grande área urbana da América Latina, Parisi et al. encontraram 66,7% de pacientes do sexo feminino com UC em um estudo observacional realizado na mesma década.14
Kirchhof et al.15 publicaram dois relatos de caso, um sobre poliarterite nodosa cutânea (arterite cutânea) e outro de urticária recorrente atípica, nos quais foram avaliadas as mesmas variáveis que o presente trabalho: valores de ProtCR e D‐dímero durante a atividade da doença. Curiosamente, os níveis séricos de ProtCR não se correlacionaram com a atividade da doença, e os autores encontraram níveis dentro dos padrões da normalidade durante a doença clinicamente ativa.14 Nesses dois casos relatados, os níveis de ProtCR eram normais e os níveis de D‐dímero estavam elevados, indicando que a ProtCR, um marcador de inflamação aguda, pode ser menos sensível que os níveis do D‐dímero, um gerador de atividade fibrinolítica. Esse fato também foi observado em pacientes com UCE em nosso estudo. A remissão da UCE pode estar relacionada com o tratamento anti‐H1 e/ou medicamentos adjuvantes; no entanto, remissões espontâneas ocorrem em 30%‐50% dos pacientes dentro de um ano da evolução da doença e outros 20% em cinco anos.16 Cerca de 20% dos pacientes com UCE mantêm atividade da doença mesmo após cinco anos de evolução.16 Vários estudos demonstraram que pacientes com sintomas mais graves podem ter um curso mais persistente da doença. Quase metade dos pacientes com UCE com duração maior que seis meses provavelmente ainda terá manifestações clínicas 10 anos mais tarde.16 No presente estudo, encontramos relação entre a gravidade da UCE, níveis plasmáticos de D‐dímero, UAS e número de anti‐H1 e medicamentos adjuvantes necessários para obter o controle clínico da UCE.
Em um grande estudo retrospectivo observacional em Barcelona (Espanha), Curto‐Barredo et al.17 estudaram 549 pacientes com UCE e descobriram que mais de 75% deles eram refratários ao tratamento de primeira linha com doses licenciadas de anti‐H1. Esses autores demonstraram que o UAS basal era o único parâmetro capaz de prever a refratariedade aos anti‐H1. Em nosso estudo, houve concordância com Curto‐Barredo et al.,17 e observamos que os pacientes com alto escore para UCE necessitavam de mais medicamentos para o controle da doença.
LimitaçõesA amostra foi pequena em relação à prevalência da doença. Estudos maiores serão necessários para esclarecer a importância do uso de biomarcadores na UCE.
ConclusãoNeste estudo, demonstramos que pacientes com TSA positivo apresentaram alto escore de atividade da urticária, mostrando que pacientes com urticária autoimune/autorreativa apresentam uma UCE mais grave e de mais difícil tratamento.
Houve relação forte e diretamente proporcional entre os níveis plasmáticos de D‐dímero e o escore de atividade clínica, embora não pudéssemos encontrar essa mesma relação entre os níveis séricos de ProtCR e o escore clínico, indicando que o D‐dímero é uma variável mais confiável que a ProtCR como marcador de gravidade na UC.
Suporte financeiroNenhum.
Contribuição dos autoresRoberta Fachini Criado: Análise estatística; aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; revisão crítica do manuscrito.
Carolina Games Bensi: Concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura.
Paulo Ricardo Criado: Análise estatística; aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; revisão crítica do manuscrito.
Marina Teixeira Henriques: Concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; revisão crítica da literatura.
Beatriz Alessi Rodrigues de Espindola: Análise estatística; aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados.
Carlos D’Apparecida Machado Filho: Participação efetiva na orientação da pesquisa; revisão crítica do manuscrito.
Conflito de interessesNenhum.
Como citar este artigo: Criado RF, Bensi CG, Criado PR, Henriques MT, Espindola BAR, Machado Filho CD. Evaluation of serum levels of C‐reactive protein, D‐dimer, and autologous serum test in patients with spontaneous chronic urticaria in a Brazilian tertiary center: a cross‐sectional study. An Bras Dermatol. 2021;96:148–54.
Trabalho realizado na Disciplina de Dermatologia, Faculdade de Medicina do ABC, São Paulo, SP, Brasil.