Pioderma gangrenoso (PG) é doença crônica caracterizada por úlceras cutâneas recalcitrantes.
ObjetivoAvaliar as características demográficas e clínicas, os tratamentos e fatores que afetam as respostas ao tratamento de pacientes com PG.
MétodosFoi realizado estudo multicêntrico em 12 centros de atenção terciária. Foram analisados retrospectivamente os dados dos pacientes acompanhados com diagnóstico de PG entre os anos de 2012 a 2022.
ResultadosForam incluídos um total de 239 pacientes, dos quais 143 eram do gênero feminino e 96 do gênero masculino, com média de idade de 54,2±17,4 anos. O tratamento mais comum foram esteroides sistêmicos (n=181; 75,7%). Entre esses pacientes, 50,8% (n=92) utilizaram esteroides sistêmicos como única terapêutica, enquanto 49,2% (n=89) usaram pelo menos um agente imunossupressor adjuvante. Os fatores independentes determinados na análise de regressão que influenciaram positivamente a resposta aos esteroides sistêmicos foram idade de início da doença ≥ 30 anos, patergia negativa, ausência de leucocitose, cultura de lesão negativa, presença de lesão única e ausência de envolvimento dos membros superiores. Agentes biológicos foram utilizados em 18,4% (n=44) dos pacientes do presente estudo. Também foram analisados PG positivo para patergia e PG de início precoce (idade de início <30) separadamente em virtude de suas características clínicas distintas que foram reveladas durante a análise estatística.
Limitações do estudoNatureza retrospectiva do presente estudo.
ConclusõesA análise dos fatores que influenciam as respostas ao tratamento é abordada no presente estudo. Além disso, concluiu‐se que a investigação de doenças autoinflamatórias concomitantes com PG positivo para patergia e PG de início precoce é necessária, e os pacientes desses dois grupos são mais resistentes ao tratamento, necessitando de tratamentos mais complexos.
Pioderma gangrenoso (PG) é doença crônica caracterizada por úlceras cutâneas recorrentes. O PG foi descrito pela primeira vez por Brocq1 e nomeado por Brunsting et al.2 Ao contrário do seu nome, posteriormente entendeu‐se que se trata de dermatose neutrofílica asséptica.3 A incidência mundial de PG é estimada em 3‐10/1.000.000.4
Em sua etiopatogenia, acredita‐se que a disfunção de neutrófilos, a expansão clonal de células T, mediadores inflamatórios como interleucina (IL)‐17, IL‐23 e predisposição genética desempenhem papel relevante.5 O PG tem quatro subgrupos primários: clássico (ulcerativo), bolhoso, pustuloso e vegetante. Variantes mais raras incluem PG periestomal, PG pós‐operatório e PG induzido por medicamentos.6 No PG clássico, que é o tipo mais comum, as lesões começam como pústulas estéreis e pápulas eritematosas e se transformam em lesões ulcerativas dolorosas. Lesões com aparência violácea e bordas elevadas bem definidas são típicas do PG clássico. As lesões apresentam cicatrizes atróficas cribriformes ou em forma de peneira.7,8 Patergia, a resposta exagerada após pequenos traumas cutâneos, é observada em aproximadamente um terço dos pacientes.6 Como as investigações laboratoriais e os achados histopatológicos não são distintos no PG, o diagnóstico é feito excluindo‐se outras doenças inflamatórias da pele que causam ulceração.7 Su et al. sugeriram critérios diagnósticos para PG em 2004.9 De acordo com o consenso Delphi recentemente definido, a presença de infiltração de neutrófilos na histopatologia em biópsia retirada da borda da úlcera é um critério importante que deve ser atendido.10 O PG pode estar associado a outras condições em 50%‐75% dos pacientes.7 As associações mais comuns são doenças inflamatórias intestinais (DII), artrite e distúrbios hematológicos. Além disso, o PG pode estar associado a síndromes como PAPA (artrite piogênica, PG, acne), PASH (PG, acne, hidradenite supurativa [HS]), PASS (PG, acne conglobata, HS, espondiloartropatias soropositivas), PAPASH (artrite piogênica, PG, acne, HS) e PsAPASH (artrite psoriásica, PG, acne, HS).7 Não há tratamento de referência para o PG. O tratamento deve ser estruturado de acordo com o número de lesões, tamanho, localização, presença de doenças associadas e comorbidades do paciente. Os pilares fundamentais do tratamento incluem evitar fatores desencadeantes, cuidado adequado da lesão, controle da dor, terapias imunomoduladoras tópicas, sistêmicas e direcionadas.5,6
O objetivo do presente estudo foi avaliar as características demográficas e clínicas dos pacientes com PG, bem como os fatores que afetam as preferências e respostas ao tratamento.
Materiais e métodosFoi realizado estudo multicêntrico que incluiu 12 centros de cuidados terciários de oito províncias diferentes da Turquia. Foram avaliados retrospectivamente os pacientes acompanhados entre os anos de 2012 a 2022 com diagnóstico de PG de acordo com os critérios diagnósticos sugeridos por Su et al.,9 no qual dois critérios maiores (úlceras necrosantes dolorosas de rápida progressão com bordas irregulares vermelho‐violáceas elevadas e exclusão de outras causas de ulceração cutânea) e dois critérios menores (desenvolvimento de úlcera no local de trauma menor sugerindo presença de patergia ou achados clínicos de cicatrizes cribriformes, presença de doença sistêmica associada ao PG, achado histopatológico de infiltração estéril de neutrófilos na derme, resposta rápida à terapia sistêmica com esteroides) deveriam ser atendidos. Foram compilados dados de todos os pacientes com PG >18 anos dos centros de estudo.
A aprovação do Comitê de Ética n° E1‐22‐2782 foi obtida do Ankara Bilkent City Hospital antes do estudo (17.08.2022). O presente estudo foi conduzido de acordo com os princípios éticos da Declaração de Helsinque.
Para todos os tratamentos, a cicatrização de feridas ≥ 75% como parâmetro de desfecho foi avaliada como “boa resposta”. Benefício <75% foi avaliado como “resposta deficiente a moderada” no presente estudo.
Análise estatísticaOs dados foram analisados utilizando SPSS/IBM para Windows 23.0 (Chicago, IL, EUA). Estatísticas descritivas como número e porcentagem para variáveis categóricas e média, mediana, desvio padrão e intervalo interquartil (IIQ) para variáveis numéricas foram utilizadas para descrever a amostra. O teste de significância de qui‐quadrado ou teste exato de Fisher foi utilizado para comparar variáveis categóricas, e o teste t de Student ou teste U de Mann‐Whitney foi utilizado para comparar variáveis numéricas. Os testes de correlação de Pearson e Spearman foram utilizados para avaliar a correlação entre duas variáveis numéricas. Variáveis com valores de p>0,2 foram avaliadas posteriormente com análise de regressão logística multivariada para identificar preditores independentes de resposta ao tratamento. O ajuste do modelo foi avaliado pelo teste de Hosmer‐Lemeshow. O nível de significância estatística foi determinado como p<0,05 para todas as análises.
Durante a análise exploratória, verificou‐se que pacientes com PG positivo para patergia e pacientes com PG com idade de início <30 anos apresentavam características clínicas distintas e respostas ao tratamento significantes. A escolha do ponto de corte de idade de 30 anos foi baseada tanto em dados bibliográficos (a idade definida como o ponto de corte teórico entre a idade adulta emergente e a idade adulta estabelecida)11,12 quanto em evidências (melhor potencial na previsão de múltiplas doenças, endpoints específicos de pacientes e desfechos utilizando considerações de inferência estatística). Optou‐se por denominar o PG que se inicia antes dos 30 anos como PG de início precoce e ≥ 30 anos como PG de início tardio no presente estudo.
ResultadosO presente estudo incluiu 143 (59,8%) mulheres e 96 (40,2%) homens, totalizando 239 pacientes. A idade média dos pacientes foi de 54,2±17,4 anos. A média de idade de início da doença foi de 48,2±18,1 anos. A duração da doença foi determinada como valor mediano de 24 meses (IQR 6‐84; mín‐máx: 1‐366). Os dados demográficos dos pacientes e informações de hospitalização são apresentados na tabela 1. As características das lesões observadas nos pacientes são apresentadas na tabela 2. O número de pacientes com PG do tipo ulcerativo foi de 203 (85%), representando o subtipo mais frequente. Os subtipos de PG observados nos pacientes do presente estudo são mostrados na tabela 2.
Características demográficas dos pacientes e informações da hospitalização
| Total, n (%) | 239 | |||
| Feminino | 143 (59,8) | |||
| Masculino | 96 (40,2) | |||
| Média de idade±DP (anos) | 54,2±17,4 | |||
| Idade de início±DP (anos) | 48,2±18,1 | |||
| Duração da doença (meses) (IIQ) | 24 (6‐84) | |||
| Taxa de hospitalização, n (%) | 187 (78,2) | Número de hospitalizações | Uma vez | 89 (37,2) |
| Duas vezes | 46 (19,2) | |||
| Três vezes | 23 (9,6) | |||
| ≥ Quatro vezes | 29 (12,2) | |||
| Tempo total de hospitalização (dias)‐ Mediana (IIQ) (mín‐máx) | 20 (12‐39) (mín‐máx: 1‐113) | |||
| Menor período de hospitalização (dias)‐ Mediana (IIQ) | 10 (6‐14) | |||
| Maior período de hospitalização (dias)‐ Mediana (IIQ) | 15,5 (10‐23) | |||
DP, desvio‐padrão; IIQ, intervalo interquartil.
Dados relativos às características do pioderma gangrenoso
| Localização das lesões | n (%) |
| Extremidades inferiores | 189 (79,1) |
| Extremidades superiores | 31 (13) |
| Corpo | 70 (29,3) |
| Cabeça‐pescoço | 8 (3,3) |
| Outras (mucosa oral, região genital, região glútea) | 5 (2,1) |
| Maior tamanho de lesão (cm) | n (%) |
| 1‐5 | 104 (43,5) |
| 5‐10 | 86 (36) |
| 10‐15 | 29 (12,1) |
| 15‐20 | 12 (5) |
| >20 | 8 (3,3) |
| Número de lesões | n (%) |
| 1 lesão | 90 (37,7) |
| 2‐5 lesões | 108 (45,2) |
| 5‐10 lesões | 30 (12,6) |
| >10 lesões | 11 (4,6) |
| Tipos de pioderma gangrenoso | n (%) |
| Ulcerativo | 203 (84,9) |
| Bolhoso | 10 (4,2) |
| Pustuloso | 9 (3,8) |
| Pós‐operatório | 9 (3,8) |
| Vegetante | 5 (2,1) |
| Periestomal | 4 (1,7) |
| Comorbidades associadas com o pioderma | n (%) |
| Doença inflamatória intestinal | 38 (15,9) |
| Artrite inflamatória (artrite reumatoide, artrite psoriática, artrite gotosa) | 45 (18,8) |
| Doenças hematológicas | 16 (6,7) |
| Hidradenite supurativa | 16 (6,7) |
| Neoplasia maligna sólida | 14 (5,9) |
| Doenças autoinflamatórias (PAPA, PASH, PAPASH) | 9 (3,8) |
| Outras (doença de Behçet) | 9 (3,8) |
| Total | 51,5a |
O número de pacientes com pelo menos uma comorbidade associada ao PG foi 123 (51,5%). A idade de início da doença foi mais precoce em pacientes com comorbidade relacionada ao PG em comparação com aqueles sem comorbidade (45,9 vs. 50,7 anos, p=0,048). Artrite inflamatória foi observada em 45 (18,8%) pacientes. DII foi encontrada em 38 (15,9%) pacientes. A HS estava presente em 17 (7,1%) pacientes. A frequência de doença hematológica foi de 6,7% (n=16). As doenças hematológicas observadas nos pacientes foram MGUS (gamopatia monoclonal de significado indeterminado), síndrome mielodisplásica, linfoma e leucemia. Neoplasia maligna sólida estava presente em 14 (5,9%) pacientes. Síndromes autoinflamatórias foram encontradas em nove (3,8%) pacientes (PAPA, PASH, PAPASH). Em pacientes com doença autoinflamatória, as frequências do gênero masculino, história familiar de doença autoinflamatória, envolvimento de múltiplas regiões e envolvimento de membros superiores foram maiores, bem como a presença de diâmetro maior na lesão e maior número de hospitalizações em comparação com aqueles sem doença autoinflamatória (valores de p respectivamente 0,019, <0,001, <0,001, 0,004, 0,006 e 0,025). Além disso, esses pacientes eram mais jovens e a idade de início da doença era menor (ambos p <0,001). As comorbidades associadas ao PG são apresentadas na tabela 2.
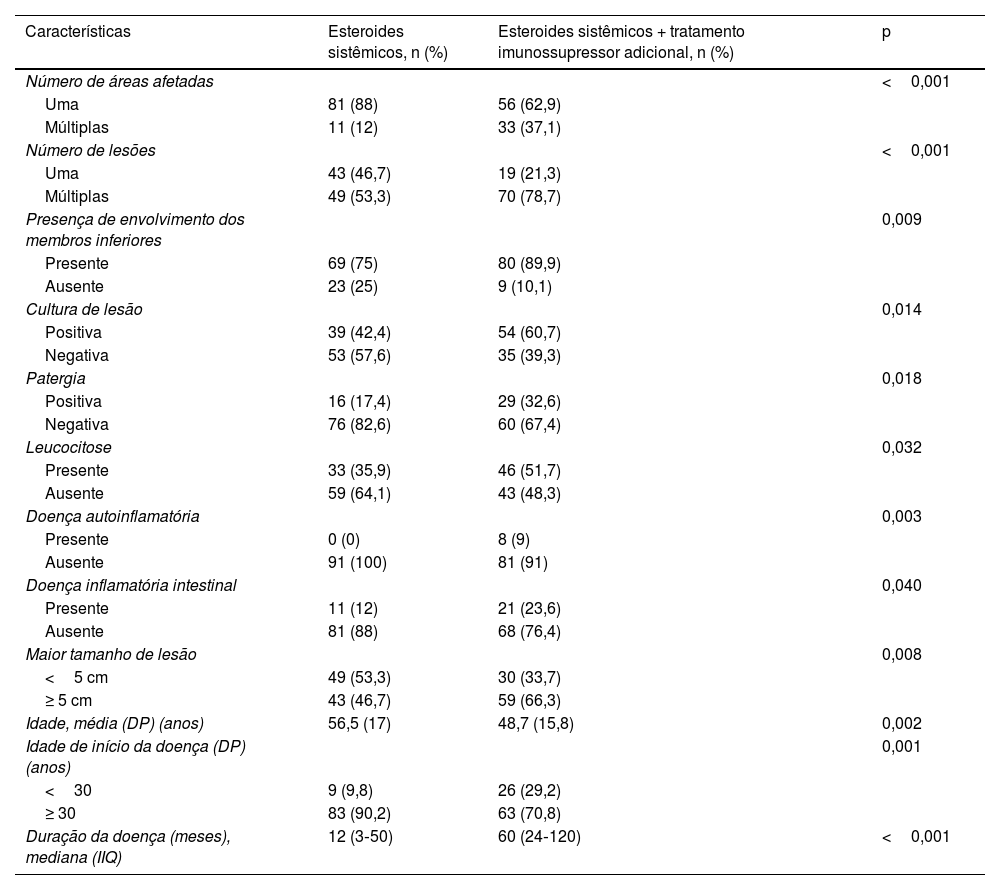
Patergia foi detectada em 55 (23%) pacientes e foi negativa em 140 (58,6%). Em 44 (18,4%) pacientes, o estado de patergia não foi relatado. Dor estava presente em 218 (91,2%) pacientes. Os achados laboratoriais e histopatológicos dos pacientes são apresentados na tabela 3.
Dados laboratoriais dos pacientes e outros dados relacionados à doença
| Achados laboratoriais | n (%) |
| Anemia | 124 (51,9) |
| Leucocitose | 93 (38,9) |
| Neutrofilia | 104 (43,5) |
| Nível elevado de PCRa | 166 (69,7) |
| Nível elevado de eritrossedimentação | 53 (22,2) |
| Distúrbio eletrolítico | 13 (5,4) |
| Anormalidade no teste de função hepática | 7 (2,9) |
| Cultura positiva de lesões | 111 (46,4) |
| Avaliação histopatológica | n (%) |
| Compatível com PG | 212 (88,7) |
| Incompatível com PG | 8 (3,3) |
| Biopsia não realizada | 19 (7,9) |
| Fenômeno de patergia | n (%) |
| Patergia positiva | 55 (23) |
| Patergia negativa | 140 (58,6) |
| Estado de patergia desconhecido | 44 (18,4) |
| Presença de dor | n (%) |
| 218 (91,2) |
PCR, proteína C‐reativa; PG, pioderma gangrenoso.
Todos os pacientes tiveram as lesões cuidadas. Os tratamentos tópicos mais utilizados foram esteroides (n=163; 68,2%), curativos sintéticos (n=73; 30,5%) e tacrolimus (n=40; 16,7%). Como a maioria dos pacientes que receberam tratamento tópico também recebeu tratamento sistêmico, as respostas aos tratamentos tópicos não puderam ser avaliadas no presente estudo.
O tempo médio entre o diagnóstico e o início do tratamento sistêmico foi de um mês (IIQ 0,5‐3).
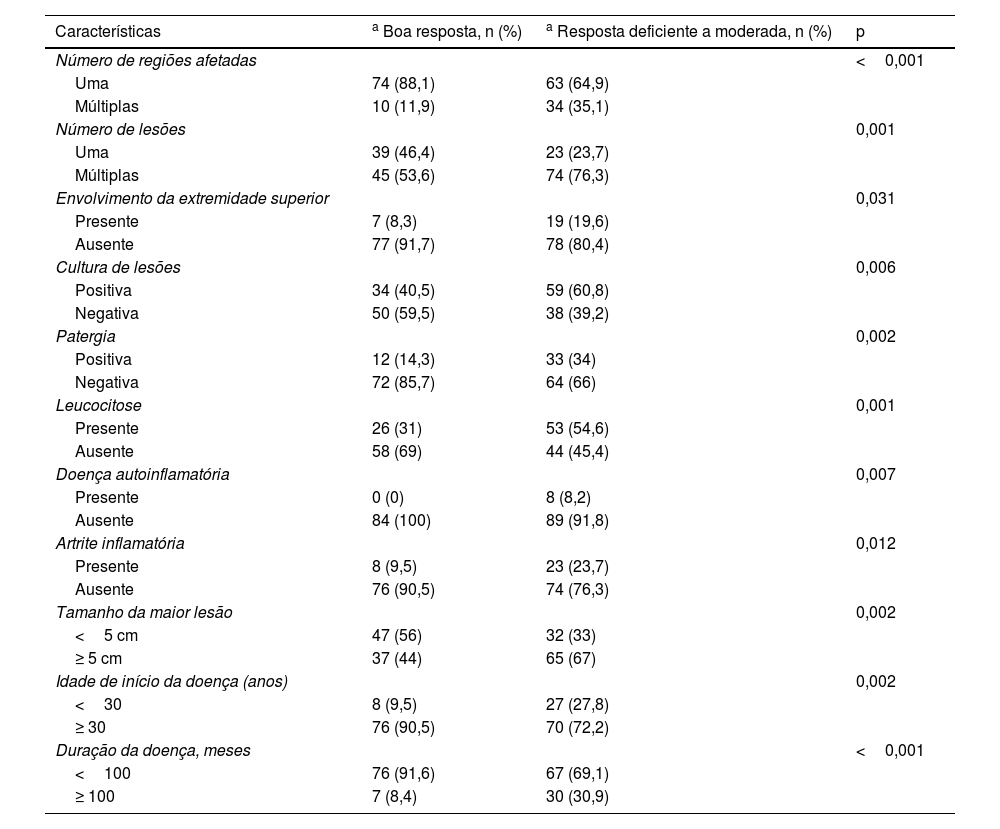
Tratamentos sistêmicosEsteroides sistêmicos foram o tratamento para 181 (75,7%) pacientes. Desses, 92 (50,8%) usaram esteroide sistêmico como agente sistêmico único, enquanto 89 (49,2%) usaram pelo menos um agente imunossupressor além dos esteroides. As características desses dois grupos são comparadas na tabela 4.
Comparação das características entre pacientes que receberam tratamento sistêmico com esteroides isoladamente e esteroides sistêmicos + tratamento imunossupressor adicional
| Características | Esteroides sistêmicos, n (%) | Esteroides sistêmicos + tratamento imunossupressor adicional, n (%) | p |
|---|---|---|---|
| Número de áreas afetadas | <0,001 | ||
| Uma | 81 (88) | 56 (62,9) | |
| Múltiplas | 11 (12) | 33 (37,1) | |
| Número de lesões | <0,001 | ||
| Uma | 43 (46,7) | 19 (21,3) | |
| Múltiplas | 49 (53,3) | 70 (78,7) | |
| Presença de envolvimento dos membros inferiores | 0,009 | ||
| Presente | 69 (75) | 80 (89,9) | |
| Ausente | 23 (25) | 9 (10,1) | |
| Cultura de lesão | 0,014 | ||
| Positiva | 39 (42,4) | 54 (60,7) | |
| Negativa | 53 (57,6) | 35 (39,3) | |
| Patergia | 0,018 | ||
| Positiva | 16 (17,4) | 29 (32,6) | |
| Negativa | 76 (82,6) | 60 (67,4) | |
| Leucocitose | 0,032 | ||
| Presente | 33 (35,9) | 46 (51,7) | |
| Ausente | 59 (64,1) | 43 (48,3) | |
| Doença autoinflamatória | 0,003 | ||
| Presente | 0 (0) | 8 (9) | |
| Ausente | 91 (100) | 81 (91) | |
| Doença inflamatória intestinal | 0,040 | ||
| Presente | 11 (12) | 21 (23,6) | |
| Ausente | 81 (88) | 68 (76,4) | |
| Maior tamanho de lesão | 0,008 | ||
| <5 cm | 49 (53,3) | 30 (33,7) | |
| ≥ 5 cm | 43 (46,7) | 59 (66,3) | |
| Idade, média (DP) (anos) | 56,5 (17) | 48,7 (15,8) | 0,002 |
| Idade de início da doença (DP) (anos) | 0,001 | ||
| <30 | 9 (9,8) | 26 (29,2) | |
| ≥ 30 | 83 (90,2) | 63 (70,8) | |
| Duração da doença (meses), mediana (IIQ) | 12 (3‐50) | 60 (24‐120) | <0,001 |
%, porcentagem válida; DP, desvio‐padrão; IIQ, intervalo interquartil.
A dose média de esteroides foi de 48mg (IIQ 40‐60) de equivalente de metilprednisolona. A duração média do tratamento foi de 60 dias (IIQ 30‐100). Não foi encontrada correlação entre a dose de esteroide e o benefício do tratamento (p=0,71). Boa resposta ao tratamento foi obtida em 46,4% dos pacientes. O intervalo de tempo entre o diagnóstico e o início do tratamento sistêmico correlacionou‐se inversamente com o benefício do tratamento (p=0,005; r=−0,21).
A análise univariada das características dos pacientes que responderam bem ao tratamento sistêmico com esteroides é mostrada na tabela 5. Uma análise de regressão logística multivariada adicional foi realizada (tabela 6). Ausência de envolvimento de membros superiores (p=0,041), presença de lesão única (p=0,019), idade de início da doença ≥ 30 (p=0,001), ausência de leucocitose (p=0,012), cultura negativa de lesão (p=0,002) e patergia negativa (p=0,005) foram determinados como os fatores independentes que influenciam as respostas ao tratamento sistêmico com esteroides na análise multivariada.
Análise univariada das características dos pacientes com boa resposta ou resposta deficiente a moderada aos esteroides sistêmicos
| Características | a Boa resposta, n (%) | a Resposta deficiente a moderada, n (%) | p |
|---|---|---|---|
| Número de regiões afetadas | <0,001 | ||
| Uma | 74 (88,1) | 63 (64,9) | |
| Múltiplas | 10 (11,9) | 34 (35,1) | |
| Número de lesões | 0,001 | ||
| Uma | 39 (46,4) | 23 (23,7) | |
| Múltiplas | 45 (53,6) | 74 (76,3) | |
| Envolvimento da extremidade superior | 0,031 | ||
| Presente | 7 (8,3) | 19 (19,6) | |
| Ausente | 77 (91,7) | 78 (80,4) | |
| Cultura de lesões | 0,006 | ||
| Positiva | 34 (40,5) | 59 (60,8) | |
| Negativa | 50 (59,5) | 38 (39,2) | |
| Patergia | 0,002 | ||
| Positiva | 12 (14,3) | 33 (34) | |
| Negativa | 72 (85,7) | 64 (66) | |
| Leucocitose | 0,001 | ||
| Presente | 26 (31) | 53 (54,6) | |
| Ausente | 58 (69) | 44 (45,4) | |
| Doença autoinflamatória | 0,007 | ||
| Presente | 0 (0) | 8 (8,2) | |
| Ausente | 84 (100) | 89 (91,8) | |
| Artrite inflamatória | 0,012 | ||
| Presente | 8 (9,5) | 23 (23,7) | |
| Ausente | 76 (90,5) | 74 (76,3) | |
| Tamanho da maior lesão | 0,002 | ||
| <5 cm | 47 (56) | 32 (33) | |
| ≥ 5 cm | 37 (44) | 65 (67) | |
| Idade de início da doença (anos) | 0,002 | ||
| <30 | 8 (9,5) | 27 (27,8) | |
| ≥ 30 | 76 (90,5) | 70 (72,2) | |
| Duração da doença, meses | <0,001 | ||
| <100 | 76 (91,6) | 67 (69,1) | |
| ≥ 100 | 7 (8,4) | 30 (30,9) |
Análise de regressão logística multivariada das características dos pacientes com boa resposta aos esteroides sistêmicos
| Características de pacientes com boa resposta aos esteroides sistêmicos | p‐valor | RR | IC 95% para RR | |
|---|---|---|---|---|
| Inferior | Superior | |||
| Ausência de envolvimento dos membros superiores | 0,041 | 3,14 | 1,05 | 9,37 |
| Presença de lesão única | 0,019 | 2,39 | 1,15 | 4,95 |
| Idade de início da doença ≥ 30 | 0,001 | 6,16 | 2,19 | 17,29 |
| Ausência de leucocitose | 0,012 | 2,45 | 1,22 | 4,93 |
| Cultura negativa de lesão | 0,002 | 3,28 | 1,58 | 6,84 |
| Patergia negativa | 0,005 | 3,55 | 1,46 | 8,66 |
RR, risco relativo; IC, intervalo de confiança.
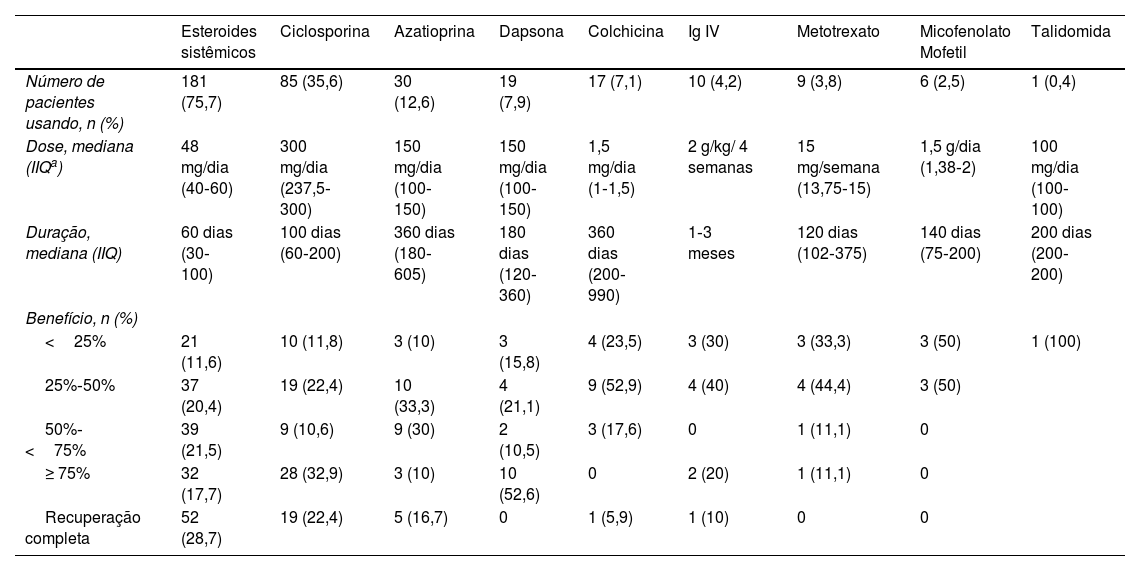
Oitenta e cinco (35,6%) pacientes usaram ciclosporina. A mediana da dose de ciclosporina foi de 300mg/dia (IIQ 237,5‐300). A duração média do tratamento foi de 100 dias (60‐200). Recuperação completa foi observada em 19 (22,4%) pacientes. Não foi observada correlação entre a dose de ciclosporina e o benefício do tratamento (p=0,61).
Dez pacientes receberam tratamento com imunoglobulina intravenosa (Ig IV), e três desses pacientes obtiveram boa resposta.
Os tratamentos sistêmicos convencionais e Ig IV recebidos pelos pacientes e o benefício relativo ao tratamento são mostrados na tabela 7. Como alguns dos pacientes usaram mais de um tratamento sistêmico convencional ou Ig IV simultaneamente, não foi possível fazer uma comparação direta em termos de eficácia entre esses tratamentos.
Dados relativos aos tratamentos convencionais e imunoglobulina intravenosa (Ig IV) utilizados pelos pacientes incluídos no estudo
| Esteroides sistêmicos | Ciclosporina | Azatioprina | Dapsona | Colchicina | Ig IV | Metotrexato | Micofenolato Mofetil | Talidomida | |
|---|---|---|---|---|---|---|---|---|---|
| Número de pacientes usando, n (%) | 181 (75,7) | 85 (35,6) | 30 (12,6) | 19 (7,9) | 17 (7,1) | 10 (4,2) | 9 (3,8) | 6 (2,5) | 1 (0,4) |
| Dose, mediana (IIQa) | 48 mg/dia (40‐60) | 300 mg/dia (237,5‐300) | 150 mg/dia (100‐150) | 150 mg/dia (100‐150) | 1,5 mg/dia (1‐1,5) | 2 g/kg/ 4 semanas | 15 mg/semana (13,75‐15) | 1,5 g/dia (1,38‐2) | 100 mg/dia (100‐100) |
| Duração, mediana (IIQ) | 60 dias (30‐100) | 100 dias (60‐200) | 360 dias (180‐605) | 180 dias (120‐360) | 360 dias (200‐990) | 1‐3 meses | 120 dias (102‐375) | 140 dias (75‐200) | 200 dias (200‐200) |
| Benefício, n (%) | |||||||||
| <25% | 21 (11,6) | 10 (11,8) | 3 (10) | 3 (15,8) | 4 (23,5) | 3 (30) | 3 (33,3) | 3 (50) | 1 (100) |
| 25%‐50% | 37 (20,4) | 19 (22,4) | 10 (33,3) | 4 (21,1) | 9 (52,9) | 4 (40) | 4 (44,4) | 3 (50) | |
| 50%‐<75% | 39 (21,5) | 9 (10,6) | 9 (30) | 2 (10,5) | 3 (17,6) | 0 | 1 (11,1) | 0 | |
| ≥ 75% | 32 (17,7) | 28 (32,9) | 3 (10) | 10 (52,6) | 0 | 2 (20) | 1 (11,1) | 0 | |
| Recuperação completa | 52 (28,7) | 19 (22,4) | 5 (16,7) | 0 | 1 (5,9) | 1 (10) | 0 | 0 |
IIQ, intervalo interquartil.
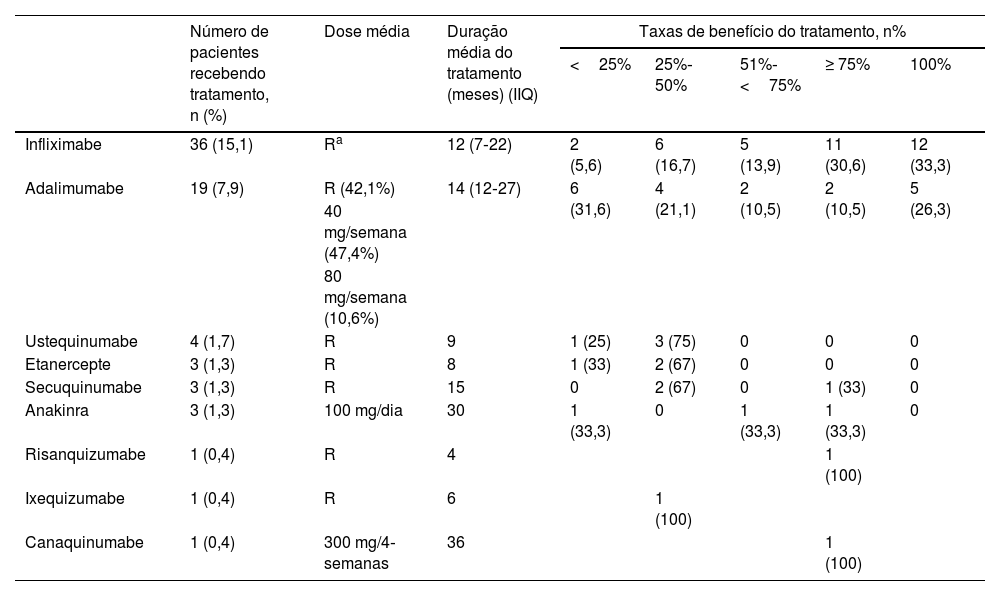
Agentes biológicos foram utilizados em 44 (18,4%) pacientes. O uso de agentes biológicos foi mais comum em homens do que em mulheres (p=0,005), em pacientes com histórico familiar de doenças autoinflamatórias (p=0,031) e naqueles com envolvimento multirregional (p<0,001), envolvimento de cabeça e pescoço (p=0,019), lesões múltiplas (p=0,024), comorbidades (p=0,002), cultura positiva de lesões (p=0,011), patergia positiva (p=0,006), DII (p<0,001), HS (p=0,012) e doenças autoinflamatórias (p<0,001). Os pacientes em uso de tratamentos biológicos eram mais jovens (p=0,006), tinham idade de início mais precoce (p<0,001), apresentavam mais lesões (p=0,006), mais hospitalizações (p=0,001) e maior tempo de hospitalização (p=0,001) em comparação com aqueles que não utilizaram tratamentos biológicos. A duração mediana entre o tratamento convencional e o tratamento biológico foi de 24 meses (IIQ 12‐60). Os agentes biológicos recebidos pelos pacientes e os dados da resposta obtida são mostrados na tabela 8.
Dados de tratamento com agentes biológicos e respostas dos pacientes do presente estudo
| Número de pacientes recebendo tratamento, n (%) | Dose média | Duração média do tratamento (meses) (IIQ) | Taxas de benefício do tratamento, n% | |||||
|---|---|---|---|---|---|---|---|---|
| <25% | 25%‐50% | 51%‐<75% | ≥ 75% | 100% | ||||
| Infliximabe | 36 (15,1) | Ra | 12 (7‐22) | 2 (5,6) | 6 (16,7) | 5 (13,9) | 11 (30,6) | 12 (33,3) |
| Adalimumabe | 19 (7,9) | R (42,1%) | 14 (12‐27) | 6 (31,6) | 4 (21,1) | 2 (10,5) | 2 (10,5) | 5 (26,3) |
| 40 mg/semana (47,4%) | ||||||||
| 80 mg/semana (10,6%) | ||||||||
| Ustequinumabe | 4 (1,7) | R | 9 | 1 (25) | 3 (75) | 0 | 0 | 0 |
| Etanercepte | 3 (1,3) | R | 8 | 1 (33) | 2 (67) | 0 | 0 | 0 |
| Secuquinumabe | 3 (1,3) | R | 15 | 0 | 2 (67) | 0 | 1 (33) | 0 |
| Anakinra | 3 (1,3) | 100 mg/dia | 30 | 1 (33,3) | 0 | 1 (33,3) | 1 (33,3) | 0 |
| Risanquizumabe | 1 (0,4) | R | 4 | 1 (100) | ||||
| Ixequizumabe | 1 (0,4) | R | 6 | 1 (100) | ||||
| Canaquinumabe | 1 (0,4) | 300 mg/4‐semanas | 36 | 1 (100) | ||||
IIQ, intervalo interquartil.
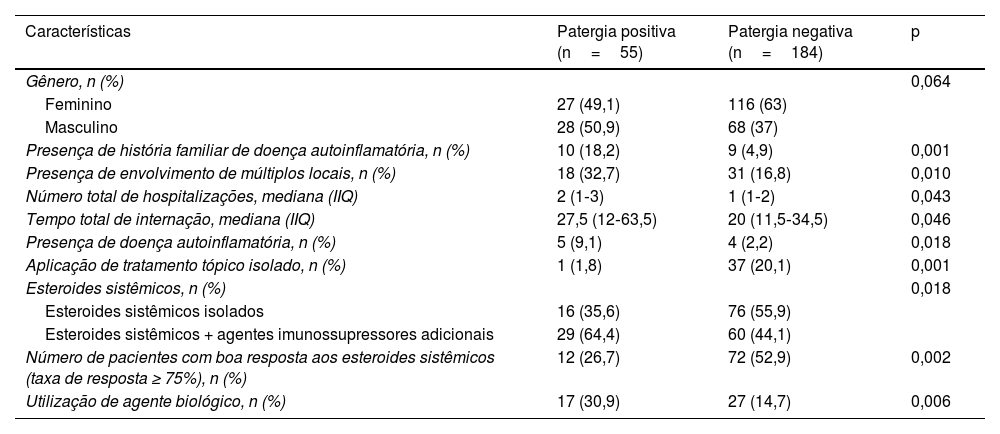
Além disso, foram analisados grupos com patergia positiva/negativa e pacientes com PG com idade de início <30/idade de início ≥ 30, que foram chamados de PG de início precoce e tardio no presente estudo. As características dos pacientes com patergia positiva e negativa são mostradas na tabela 9. As características dos pacientes com PG de início precoce são mostradas na tabela 10.
Comparação das características dos pacientes com PG com patergia positiva e negativa
| Características | Patergia positiva (n=55) | Patergia negativa (n=184) | p |
|---|---|---|---|
| Gênero, n (%) | 0,064 | ||
| Feminino | 27 (49,1) | 116 (63) | |
| Masculino | 28 (50,9) | 68 (37) | |
| Presença de história familiar de doença autoinflamatória, n (%) | 10 (18,2) | 9 (4,9) | 0,001 |
| Presença de envolvimento de múltiplos locais, n (%) | 18 (32,7) | 31 (16,8) | 0,010 |
| Número total de hospitalizações, mediana (IIQ) | 2 (1‐3) | 1 (1‐2) | 0,043 |
| Tempo total de internação, mediana (IIQ) | 27,5 (12‐63,5) | 20 (11,5‐34,5) | 0,046 |
| Presença de doença autoinflamatória, n (%) | 5 (9,1) | 4 (2,2) | 0,018 |
| Aplicação de tratamento tópico isolado, n (%) | 1 (1,8) | 37 (20,1) | 0,001 |
| Esteroides sistêmicos, n (%) | 0,018 | ||
| Esteroides sistêmicos isolados | 16 (35,6) | 76 (55,9) | |
| Esteroides sistêmicos + agentes imunossupressores adicionais | 29 (64,4) | 60 (44,1) | |
| Número de pacientes com boa resposta aos esteroides sistêmicos (taxa de resposta ≥ 75%), n (%) | 12 (26,7) | 72 (52,9) | 0,002 |
| Utilização de agente biológico, n (%) | 17 (30,9) | 27 (14,7) | 0,006 |
IIQ, intervalo interquartil; PG, pioderma gangrenoso.
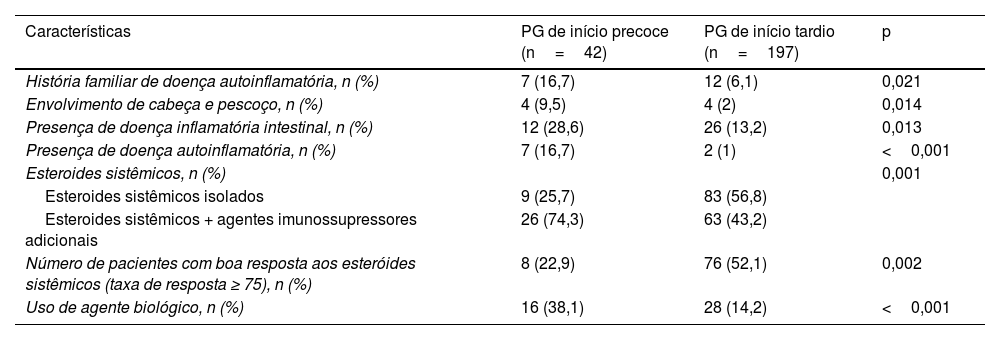
Comparação entre as características de pacientes com PG de início precoce (idade de início <30 anos) e PG de início tardio (idade de início ≥ 30 anos)
| Características | PG de início precoce (n=42) | PG de início tardio (n=197) | p |
|---|---|---|---|
| História familiar de doença autoinflamatória, n (%) | 7 (16,7) | 12 (6,1) | 0,021 |
| Envolvimento de cabeça e pescoço, n (%) | 4 (9,5) | 4 (2) | 0,014 |
| Presença de doença inflamatória intestinal, n (%) | 12 (28,6) | 26 (13,2) | 0,013 |
| Presença de doença autoinflamatória, n (%) | 7 (16,7) | 2 (1) | <0,001 |
| Esteroides sistêmicos, n (%) | 0,001 | ||
| Esteroides sistêmicos isolados | 9 (25,7) | 83 (56,8) | |
| Esteroides sistêmicos + agentes imunossupressores adicionais | 26 (74,3) | 63 (43,2) | |
| Número de pacientes com boa resposta aos esteróides sistêmicos (taxa de resposta ≥ 75), n (%) | 8 (22,9) | 76 (52,1) | 0,002 |
| Uso de agente biológico, n (%) | 16 (38,1) | 28 (14,2) | <0,001 |
PG, pioderma gangrenoso.
Ao examinar as comorbidades associadas ao PG, verificou‐se que 51,5% dos pacientes apresentavam pelo menos uma comorbidade. As comorbidades mais comuns nos pacientes foram artrite inflamatória, DII, HS, distúrbios hematológicos e neoplasias malignas sólidas, respectivamente. Da mesma maneira, em um estudo multicêntrico realizado por Ashchyan et al., foram examinados dados de 356 pacientes com PG e foi determinado que 66,9% dos pacientes tinham comorbidades associadas.13 DII foi encontrada em 41%, artrite inflamatória em 20,5%, neoplasias malignas de órgãos sólidos em 6,5%, neoplasias malignas hematológicas em 5,9%, outros distúrbios hematológicos em 4,8% e HS em 6,2%.13 No estudo de Langan et al., doenças associadas ao PG foram detectadas em 33% dos pacientes. A doença associada mais comum foi a DII, observada em 20,2% dos casos, seguida por artrite reumatoide (11,8%) e distúrbios hematológicos (3,9%).14 Síndromes autoinflamatórias (PAPA, PASH, PAPASH) foram encontradas em 3,8% dos nossos pacientes. Avaliando as características desses pacientes, notou‐se que geralmente eram jovens e masculinos, tinham idade de início da doença mais precoce e tinham histórico familiar de doenças autoinflamatórias.
O achado laboratorial mais comum em nossos pacientes foi a elevação dos níveis de proteína C‐reativa (PCR), observada em 69,7%. Anemia estava presente em 51,9% dos pacientes. Em um estudo, níveis elevados de PCR foram encontrados em 56,3% dos pacientes com PG;15 em outro estudo, anemia foi observada em 45,6%.16 A presença de crescimento microbiano em culturas de lesões em 46,4% dos pacientes do presente estudo sugere que as lesões do PG são propensas a infecções secundárias.
Patergia foi identificada em 23% dos nossos pacientes, enquanto não havia informação sobre patergia em 18,4%. Semelhante ao presente estudo, no estudo de Binus et al., a patergia foi registrada em 31,1%;17 no estudo de Ashchyan et al., a taxa foi de 28,1%.13
O subtipo de PG mais comum nos pacientes do presente estudo foi o ulcerativo, responsável por 85% dos casos, seguido por PG bolhoso (4,2%) e pustuloso (3,8%). No estudo de Schosler et al.,15 a distribuição dos subtipos de PG foi 85,9% ulcerativo, 3,1% bolhoso, 6,3% periestomal, 3,1% vegetante e 1,6% pustuloso, o que foi semelhante ao presente estudo.
Os pacientes do presente estudo que receberam tratamento sistêmico foram geralmente tratados de acordo com um algoritmo terapêutico. Em geral, os corticosteroides sistêmicos foram o tratamento inicial para os pacientes do presente estudo. Ciclosporina, azatioprina, dapsona, mofetil micofenolato e colchicina foram utilizados como agentes poupadores de esteroides ou como agentes de tratamento adjuvantes. Ig IV e medicamentos biológicos foram utilizados como tratamentos de terceira linha.
Em muitos estudos, os esteroides sistêmicos são os mais comumente utilizados como tratamento de primeira linha15,17,18, assim como no presente estudo. Entretanto, é necessário tratamento imunossupressor adicional para a maioria dos pacientes.18 Quando foram examinadas as principais características do grupo para o qual os esteroides sistêmicos por si só não foram suficientes e foi necessário tratamento imunossupressor adicional, observou‐se que a frequência de envolvimento de múltiplas regiões, múltiplas lesões, presença de DII, doenças autoinflamatórias e patergia positiva eram maiores (todos p<0,05) nesse grupo. Os resultados surpreendentes da análise de regressão multivariada que revelaram características dos pacientes que apresentaram boa resposta aos esteroides sistêmicos foram idade de início da doença ≥ 30 anos, patergia negativa, ausência de leucocitose e cultura negativa de lesões. No presente estudo, resposta completa foi alcançada em 28,7% dos pacientes que usaram esteroides sistêmicos, com mediana de dose de 48mg de equivalente de metilprednisolona e duração mediana de 60 dias. Em estudo multicêntrico, Herberger et al. avaliaram as respostas ao tratamento de 121 pacientes com PG.18 O tratamento inicial em 99% desses pacientes foi esteroides sistêmicos na dose média de 80mg. O tratamento médio com esteroides sistêmicos durou 4,3±4,6 meses. A resposta inicial aos esteroides sistêmicos foi obtida em 88%. Foi relatado que os pacientes que receberam tratamento para PG receberam em média dois tratamentos sistêmicos diferentes, e a importância dos regimes combinados de tratamento no PG foi enfatizada.18
Nos pacientes do presente estudo, outro agente de tratamento frequentemente utilizado foi a ciclosporina, administrada em média por 100 dias e na dose de 300mg. A ciclosporina utilizada em 35,6% dos pacientes do presente estudo obteve taxa de resposta completa de 22,4%. Em ensaio clínico randomizado multicêntrico comparando esteroides sistêmicos e ciclosporina no tratamento de PG, um grupo recebeu 0,75mg/kg/dia de prednisolona em monoterapia, enquanto outro grupo recebeu 4mg/kg/dia de ciclosporina.19 No final da 6ª semana, não foi observada diferença entre os dois grupos em relação a taxa de cura, resposta ao tratamento, dor e duração da recorrência. No entanto, no 6° mês, não foi observada cura em aproximadamente metade dos pacientes em ambos os grupos.19
Azatioprina foi utilizada em 12,6% dos pacientes do presente estudo. Entre esses pacientes, 16,7% tiveram cura completa. A azatioprina pode ser usada como agente poupador de esteroides no PG refratário ou como alternativa aos tratamentos de primeira linha. Também pode ser boa opção no PG acompanhado de DII. A azatioprina geralmente surge como opção de tratamento bem tolerada e eficaz.20 No presente estudo, o medicamento também foi geralmente utilizado em pacientes com DII.
Dapsona foi utilizada em 7,9% dos pacientes do presente estudo. Os dados referentes ao uso de dapsona no PG são baseados em relatos de casos e séries de casos. No estudo de Din et al., foram avaliadas as respostas ao tratamento de 27 pacientes que receberam terapia com dapsona para PG, com 16% dos pacientes apresentando resposta completa e 81% apresentando resposta parcial.21 No presente estudo, obteve‐se boa resposta em 52,6% dos pacientes.
Colchicina foi utilizada em 7,1% dos pacientes do presente estudo. Poucos casos foram relatados quanto ao uso de colchicina no PG. Kontochristopoulos et al. relataram rápida regressão em dois pacientes com PG refratário tratados com monoterapia com colchicina em baixas doses.22 Cura completa foi observada em 5,9% dos pacientes do presente estudo.
Nove de nossos pacientes foram tratados com metotrexato. Entre eles, 77,7% obtiveram resposta de cura abaixo de 50%. O metotrexato é um imunomodulador, e as informações sobre seu uso no PG baseiam‐se em relatos de casos.23
Mofetil micofenolato foi administrado em seis pacientes do presente estudo, com dose média de 1,5g/dia. Entretanto, todos os pacientes tiveram resposta ao tratamento inferior a 50%. O mofetil micofenolato é considerado agente poupador de esteroides de segunda linha em pacientes com PG.20
No presente estudo, dez pacientes receberam tratamento com Ig IV. Todos eles receberam um a três ciclos de tratamento na dose de 2g/kg/4 semanas. Resposta ao tratamento ≥ 75% foi alcançada em 30% desses pacientes. No estudo de Haag et al., os autores compilaram a eficácia do tratamento com Ig IV em casos refratários, identificando cura completa em 23 de 45 pacientes e resposta parcial ou não responsividade em 22 pacientes.24
Agentes biológicos foram utilizados em 18,4% dos pacientes no presente estudo. Descrevendo as características fundamentais do grupo que necessita de transição dos tratamentos convencionais para a terapia com agentes biológicos, verifica‐se que esses incluíam pacientes com início precoce da doença, pacientes jovens, masculinos, com doenças autoinflamatórias, com DII, pacientes apresentando HS e aqueles que apresentavam patergia positiva. A mediana do tempo de transição do tratamento convencional para o tratamento biológico nos pacientes do presente estudo foi de 24 meses. Infliximabe, o agente biológico mais utilizado, foi considerado para 15,1% desses pacientes. O infliximabe foi administrado aos pacientes na dose aprovada usada na psoríase. A mediana de duração do tratamento foi de 12 meses, e boa resposta foi obtida em 63,9% dos pacientes. Adalimumabe foi o segundo agente biológico mais utilizado nesses pacientes (7,9%), administrado em três doses diferentes: a dose aprovada utilizada na psoríase, 40mg/semana e 80mg/semana. A duração média do tratamento foi de 14 meses, e a taxa de pacientes que responderam com ≥ 75% foi de 5,2%. Três pacientes usaram etanercepte. Os pacientes utilizaram a dose aprovada durante média de oito meses, mas a resposta ao tratamento não excedeu 50%. Infliximabe é o único agente anti‐TNF cuja eficácia foi demonstrada no PG clássico por meio de um estudo randomizado duplo‐cego controlado. No estudo randomizado controlado por placebo conduzido por Brooklyn et al., resposta parcial foi alcançada em 48% e resposta completa em 21% ao final de seis semanas.25 Em um estudo de fase 3, aberto e multicêntrico, a eficácia e a segurança do adalimumabe no PG refratário foram investigadas e cura completa foi registrada em 54,5% após 26 semanas de tratamento.26 Abdallah et al. realizaram uma revisão semissistemática sobre o uso de inibidores de TNF‐α no PG. Nenhuma diferença foi encontrada entre infliximabe, adalimumabe e etanercepte em termos de taxas de resposta parcial e completa.27 Em especial, infliximabe e adalimumabe, dois antagonistas do TNF‐α parecem ser boa opção para casos resistentes ou para evitar os efeitos colaterais em longo prazo dos esteroides sistêmicos ou da ciclosporina.27
No presente estudo, houve quatro pacientes em uso de ustequinumabe, com taxa de resposta de 25%‐75%. Em uma revisão semissistemática, a taxa de resposta completa foi de 71% em pacientes tratados com ustequinumabe.28
Os inibidores de IL‐1 utilizados no tratamento do PG são anakinra e canaquinumabe. Três pacientes com doença autoinflamatória utilizaram anakinra no presente estudo. Apenas um desses pacientes obteve boa resposta. Um paciente utilizou canaquinumabe no presente estudo, o qual continuou o tratamento por 36 meses e respondeu ao tratamento com taxa de cura ≥ 75%. Na revisão semissistemática de Abdallah et al., resposta completa foi alcançada em 57% dos pacientes (IC 95% de 45%‐68%).28
Três pacientes utilizaram secuquinumabe no presente estudo. Enquanto dois pacientes responderam com taxa de cura de 25% a 50%, o outro paciente respondeu com taxa de cura ≥ 75%. Um paciente recebeu tratamento com risanquizumabe, e obteve resposta de cura de 75% ou mais ao final de quatro meses de tratamento. Um paciente recebeu tratamento com ixequizumabe, interrompido ao final de seis meses porque não foi possível obter resposta adequada ao tratamento. Há relatos de casos indicando que secuquinumabe, risanquizumabe e ixequizumabe são eficazes no PG resistente.29–31O presente estudo revelou dados convincentes sobre dois grupos específicos de pacientes. Naqueles com patergia positiva, havia maior taxa de história familiar de doença autoinflamatória, presença de envolvimento de múltiplas regiões, maior número total e duração total de hospitalizações e maior taxa de presença de doença autoinflamatória. O grupo com patergia positiva também diferiu significantemente do grupo com patergia negativa em relação ao tratamento e respostas ao tratamento. No grupo com patergia positiva, a taxa de resposta aos esteroides sistêmicos foi significantemente menor, a taxa de uso de imunossupressores sistêmicos adjuvantes foi alta e a taxa de uso de agentes biológicos foi alta. Outro grupo específico foi o PG de início precoce (idade de início <30), no qual a história familiar de doença autoinflamatória, o envolvimento da cabeça e pescoço, a presença de DII e de doença autoinflamatória foram mais frequentes. Além disso, no PG de início precoce, a taxa de pacientes que responderam aos esteroides sistêmicos foi baixa, e as taxas de uso de tratamentos imunossupressores adjuvantes e biológicos foram significantemente altas. Acredita‐se ser necessário considerar que pacientes com patergia positiva e PG de início precoce sejam mais resistentes ao tratamento, necessitando de tratamentos mais complexos. De fato, é crucial investigar a existência de doenças autoinflamatórias coexistentes no momento do diagnóstico em pacientes com patergia positiva e PG de início precoce.
Uma limitação do presente estudo é a ausência de critérios diagnósticos padrão para PG, o que torna incerto se o diagnóstico foi realizado com precisão em todos os casos. Além disso, acredita‐se que alguns dados possam ter sido perdidos, pois o presente estudo abrange pacientes dos últimos dez anos. Em virtude da falta de qualquer escala para pontuar a gravidade da doença, as taxas de resposta foram baseadas na avaliação dos médicos nos prontuários dos pacientes.
ConclusõesO PG é doença crônica rara acompanhada de muitas comorbidades. Embora os esteroides sistêmicos tenham sido suficientes em cerca de metade dos pacientes avaliados no presente estudo, foram necessários tratamentos imunossupressores adicionais na outra metade. Presença de múltiplas lesões, envolvimento de múltiplas regiões, doença autoinflamatória e DII foram características comuns dos pacientes que necessitaram de tratamento adicional com imunossupressores e biológicos. Além disso, acredita‐se que a presença de patergia positiva e PG de início precoce possam fornecer aos médicos informações sobre o curso e o prognóstico da doença, e a mudança para tratamentos avançados mais precocemente, nesses casos, pode ser benéfica. Acredita‐se que os dados compilados no presente estudo multicêntrico, com abrangência de dez anos em 12 hospitais terciários na Turquia, contribuirão para o conhecimento sobre essa doença.
Suporte financeiroNenhum.
Contribuição dos autoresFunda Erduran: Concepção e planejamento do estudo, obtenção, análise e interpretação de dados; elaboração e redação do manuscrito, revisão crítica do manuscrito, aprovação da versão final do manuscrito.
Esra Adışen: Concepção e planejamento do estudo, obtenção de dados, supervisão, revisão crítica e edição do manuscrito, aprovação da versão final do manuscrito.
Yıldız Hayran: Obtenção, análise e interpretação dos dados, aprovação da versão final do manuscrito.
Güneş Gür Aksoy: Obtenção de dados, edição, aprovação da versão final do manuscrito.
Erkan Alpsoy: Obtenção de dados, edição, aprovação da versão final do manuscrito.
Leyla Baykal Selçuk: Obtenção de dados, edição, aprovação da versão final do manuscrito.
Sibel Doğan Günaydın: Obtenção de dados, edição, aprovação da versão final do manuscrito.
Ayça Cordan Yazıcı: Obtenção de dados, edição, aprovação da versão final do manuscrito.
Ayşe Öktem: Obtenção de dados, edição, aprovação da versão final do manuscrito.
Malik Güngör: Obtenção de dados, edição, aprovação da versão final do manuscrito.
Elif Afacan: Obtenção de dados, edição, aprovação da versão final do manuscrito.
Deniz Devrim Kuşçu: Obtenção de dados, edição, aprovação da versão final do manuscrito.
Leyla Elmas: Obtenção de dados, edição, aprovação da versão final do manuscrito.
Kübra Aydoğan: Obtenção de dados, edição, aprovação da versão final do manuscrito.
Dilek Bayramgürler: Obtenção de dados, edição, aprovação da versão final do manuscrito.
Evren Odyakmaz Demirsoy: Obtenção de dados, edição, aprovação da versão final do manuscrito.
Melih Akyol: Obtenção de dados, edição, aprovação da versão final do manuscrito.
Rukiye Güner: Obtenção de dados, edição, aprovação da versão final do manuscrito.
Hilal Kaya Erdoğan: Obtenção de dados, edição, aprovação da versão final do manuscrito.
Ersoy Acer: Obtenção de dados, edição, aprovação da versão final do manuscrito.
Tulin Ergun, Savaş Yaylı: Obtenção de dados, edição, aprovação da versão final do manuscrito.
Ferhan Bulut: Obtenção de dados, edição, aprovação da versão final do manuscrito.
Esra Saraç: Obtenção de dados, edição, aprovação da versão final do manuscrito.
Akın Aktaş: Obtenção de dados, edição, aprovação da versão final do manuscrito.
Conflito de interessesNenhum.
Como citar este artigo: Erduran F, Adışen E, Hayran Y, Aksoy GG, Alpsoy E, Selçuk LB, et al. Analysis of clinical characteristics and factors affecting treatment responses in patients with pyoderma gangrenosum: a multicenter study of 239 patients. An Bras Dermatol. 2024;99:815–25.
Trabalho realizado no Ankara Bilkent City Hospital, Ankara, Turquia; Faculdade de Medicina, Gazi University, Ankara, Turquia; Faculdade de Medicina, Akdeniz University, Antalya, Turquia; Faculdade de Medicina, Karadeniz Technical University, Trabzon, Turquia; Faculdade de Medicina, Hacettepe University, Ankara, Turquia; Faculdade de Medicina, Mersin University, Mersin, Turquia; Faculdade de Medicina, Kocaeli University, Kocaeli, Turquia; Faculdade de Medicina, Sivas Cumhuriyet University, Sivas, Turquia; Faculdade de Medicina, Eskişehir Osmangazi University, Eskişehir, Turquia; Faculdade de Medicina, Marmara University, Istambul, Turquia e Faculdade de Medicina, Koç University, Istambul, Turquia.