O impacto da dermatite atópica (DA) aumenta com a gravidade da doença.
ObjetivoCaracterizar o impacto da DA na prática clinica no Brasil, México e Argentina.
MétodosO estudo MEASURE‐AD incluiu pacientes (≥ 12 anos) com DA moderada a grave recebendo ou candidatos a receber terapia sistêmica entre dezembro de 2019 e dezembro de 2020. As características dos pacientes, tratamentos e resultados foram registrados durante atendimento em consultório. Os desfechos primários analisados incluíram pior prurido/últimas 24 horas (Worst Pruritus Numerical Rating Scale [WP‐NRS]), qualidade de vida (QV, Dermatology Life Quality Index [DLQI] e Children's DLQI [CDLQI]).
ResultadosDe 180 pacientes (adultos, n=157; adolescentes, n=23), 52,2% eram masculinos. A média de idade (DP) era de 33,8 (17,0) anos e todos estavam recebendo tratamento para DA (65,6% terapia sistêmica). Prurido grave (WP‐NRS ≥ 7) foi relatado por 54,4% (adultos, 57,3%; adolescentes, 34,8%). Efeito muito/extremamente grande na QV (DLQI/CDLQI ≥ 11) foi relatado por 50,0% dos pacientes ≥ 16 anos e 42,9% dos pacientes de 12 a 15 anos. O Eczema Area Severity Index (EASI) médio foi de 17,0 (adultos, 17,7; adolescentes, 12,4); 3,9% dos pacientes tinham pele livre da doença (EASI 0) e 26,7% tinham DA grave (EASI 23 a 72). Nos seis meses anteriores, 0, 1−2, 3−4, 5−6 e >6 exacerbações foram relatadas por 8,3%, 27,2%, 31,1%, 11,7% e 15,6% dos pacientes, respectivamente. Em média, as exacerbações duraram 15,2 dias (adultos, 15,9 dias; adolescentes, 11,1 dias).
Limitações do estudoInformações autorrelatadas pelos pacientes e recordação durante atendimento em consultório.
ConclusõesApesar do tratamento, a gravidade da doença e o impacto na QV foram altos, sugerindo que a DA não é adequadamente controlada em todos os pacientes, destacando necessidade considerável não atendida de tratamentos eficazes para reduzir o impacto da DA.
Dermatite atópica (DA), também conhecida como eczema atópico, é doença de pele crônica, recidivante e inflamatória que frequentemente tem efeito físico, psicológico e socioeconômico negativo na vida dos pacientes.1,2 O impacto da DA aumenta com a gravidade da doença e com a ocorrência repetida de exacerbações da doença, afetando adversamente a qualidade de vida (QV) do paciente.2–4O tratamento da DA visa reduzir os sintomas (p. ex., prurido, dor, distúrbios do sono) e a inflamação, induzir o desaparecimento das lesões da pele, melhorar a QV e controlar a doença em longo prazo.1 A estratégia de tratamento varia de acordo com a gravidade da doença, idade do paciente e país, e pode ser influenciada pelo acesso ao tratamento e recomendações locais, bem como diferenças nos recursos de saúde entre países e regiões geográficas.5–9Poucos estudos relataram a gravidade da DA e os esquemas de tratamento na América Latina. A prevalência geral da DA entre crianças e adolescentes na América Latina foi relatada como variando de 2,8% a 24,6% entre os países,10,11 enquanto, geralmente, uma prevalência menor foi relatada entre adultos (Argentina, 3%–5%;12,13 Brasil, México e Colômbia, 2%–10%).13,14 Em três estudos conduzidos no Brasil e na Colômbia, aproximadamente 2/3 dos pacientes foram relatados como tendo doença moderada a grave (65%–87% segundo os estudos e métodos de avaliação).15–17 Nos mesmos estudos, os tratamentos mais comuns incluíram corticosteroides tópicos e anti‐histamínicos orais seguidos por corticosteroides sistêmicos.15–17 O uso de terapias biológicas permaneceu baixo (aproximadamente 10% dos pacientes).16,17 Impacto negativo na QV, produtividade no trabalho e custos diretos e indiretos também foram relatados.15,16,18,19 Entretanto, ainda existem lacunas em relação à compreensão do efeito da DA na vida de pacientes com doença moderada a grave na América Latina.
O objetivo do estudo MEASURE‐AD foi avaliar o impacto físico, psicológico e socioeconômico da doença, esquemas de tratamento e utilização de recursos de saúde (HCRU, do inglês healthcare resource utilization) em pacientes adolescentes e adultos com DA moderada a grave na América Latina que estavam recebendo ou eram candidatos a receber terapia sistêmica.
MétodosDesenho do estudo e participantesO MEASURE‐AD foi um estudo de coorte observacional, multicêntrico e transversal conduzido em 28 países na Europa Ocidental/Canadá, Ásia/Australásia, Europa Oriental/Oriente Médio e América Latina.20 Aqui são relatados os resultados para pacientes inscritos no MEASURE‐AD em três países latino‐americanos (Brasil, México e Argentina).
O desenho do estudo foi relatado anteriormente.20 De modo resumido, o MEASURE‐AD incluiu adultos (≥ 18 anos) e adolescentes (12–17 anos) com DA atendidos em consulta de rotina em clínica dermatológica ou consultório, entre dezembro de 2019 e dezembro de 2020. Pacientes com diagnóstico de DA confirmado por médico, que tinham doença moderada a grave avaliada por médico e eram candidatos atuais para terapia sistêmica para DA de acordo com o profissional de saúde ou estavam atualmente recebendo terapia sistêmica para DA foram incluídos no estudo. Além disso, seis meses de histórico de medicação eram necessários. Os pacientes precisavam das consentimento informado para divulgar suas informações pessoais de saúde (com apoio dos pais, conforme necessário). Notificações/submissões aos comitês de ética responsáveis, instituições de saúde e/ou autoridades competentes foram realizadas conforme exigido pelas leis e regulamentos locais aplicáveis. Os pacientes foram excluídos se estivessem participando de ensaio clínico intervencionista (a participação em outro estudo ou registro não intervencionista não foi critério de exclusão).
DesfechosOs desfechos primários foram o pior prurido nas últimas 24 horas avaliado pela Escala Numérica de Avaliação do Pior Prurido (WP‐NRS, do inglês Worst Pruritus Numeric Rating Scale; escore variou de 0 a 10) e a QV usando o Índice de Qualidade de Vida em Dermatologia (DLQI, do inglês Dermatology Life Quality Index; avaliado em pacientes com idade ≥ 16 anos; intervalo de escore de 0 a 30) ou DLQI Infantil (CDLQI, do inglês Children's DLQI; avaliado em pacientes com idade de 12 a 15 anos; intervalo de escore de 0 a 30); o escore mais alto indica maior prurido ou menor QV.
Além disso, os seguintes desfechos secundários foram avaliados: Patient Oriented Eczema Measurement (POEM; intervalo de escore de 0 a 28), controle da doença avaliado pelo paciente (usando o Inadequately Controlled AD Questionnaire com base na declaração “Eu sinto que meus tratamentos atuais são eficazes no controle da minha dermatite atópica”, em uma escala de 5 pontos variando de “discordo totalmente” a “concordo totalmente”), SCORing Atopic Dermatitis (SCORAD; intervalo de escore de 0 a 103), Validated Investigator Global Assessment for Atopic Dermatitis (vIGA‐AD; intervalo de escore de 0 a 4), envolvimento da área da superfície corporal (intervalo de escore de 0% a 100%) e o Eczema Area and Severity Index (EASI; intervalo de escore de 0 a 72). A frequência e a duração das exacerbações da doença nos últimos seis meses foram avaliadas com base no autorrelato do paciente (exacerbação foi definida como piora repentina da DA com necessidade de intensificação do tratamento ou necessidade de consultar um profissional de saúde em virtude da piora da DA). O efeito da DA no sono também foi avaliado (durante a semana anterior: horas de sono por noite, minutos até adormecer e sono interferindo na função diária).
Outros desfechos relatados pelos pacientes incluíram 5D‐Pruritus (faixa de escore de 5 a 25), Atopic Dermatitis Impact Scale (ADerm‐IS), Atopic Dermatitis Symptom Scale (ADerm‐SS), Hospital Anxiety and Depression Scale (HADS), incluindo subescalas de ansiedade HADS (HADS‐A; faixa de escore de 0 a 21) e depressão HADS (HADS‐D; faixa de escore de 0 a 21), e Short Form‐12 Health Survey (SF‐12; faixa de escore de 0 a 100) para adultos e Short Form‐10 Health Survey (SF‐10; faixa de escore de 0 a 100) para adolescentes. Além disso, foram avaliados a produtividade no trabalho e o comprometimento da atividade em decorrência da DA (WPAI‐AD, do inglês Work Productivity and Activity Impairment due to AD) e HCRU (número de visitas para assistência médica e número de visitas para cuidados agudos nos últimos seis meses em virtude da DA e despesas diretas para aspectos de assistência médica específicos para DA).
Análises estatísticasOs dados foram coletados durante uma única visita. Além disso, foram relatados dados retrospectivos coletados anteriormente de provedores de assistência médica. Todas as análises foram baseadas nos dados observados. Os dados contínuos foram caracterizados de maneira descritiva utilizando média, desvio padrão (DP) e mediana e intervalo interquartil (IIQ). Os dados categóricos foram caracterizados de maneira descritiva utilizando distribuições de frequência (isto é, número e porcentagem de pacientes).
Análises de subgrupos por níveis de gravidade da doença EASI (livre da doença, 0; pequena, 0,1–5,9; moderada, 6,0–22,9; e acentuada, 23,0–72,0),21 uso de terapia sistêmica (sim/não), uso de dupilumabe (sim/outro medicamento sistêmico), níveis de efeito DLQI (sem efeito, 0–1; pequeno, 2–5; moderado, 6–10; muito grande, 11–20; e extremamente grande, 21–30), níveis de gravidade da doença POEM (livre ou quase livre, 0–2; pequena, 3–7; moderada, 8–16; grave, 17–24; e muito acentuada, 25–28),22 e categoria de escore da AD Symptom Scale Total Symptom Score–7 (ADerm‐SS TSS‐7; <28 vs. ≥ 28) foram conduzidas.
As diferenças entre os subgrupos foram comparadas estatisticamente; o teste de Kruskal‐Wallis foi usado para variáveis contínuas e o teste de Qui‐Quadrado para variáveis categóricas. Todas as análises estatísticas foram realizadas utilizando‐se o pacote SAS® versão 9.4 (SAS, Cary, NC, EUA).
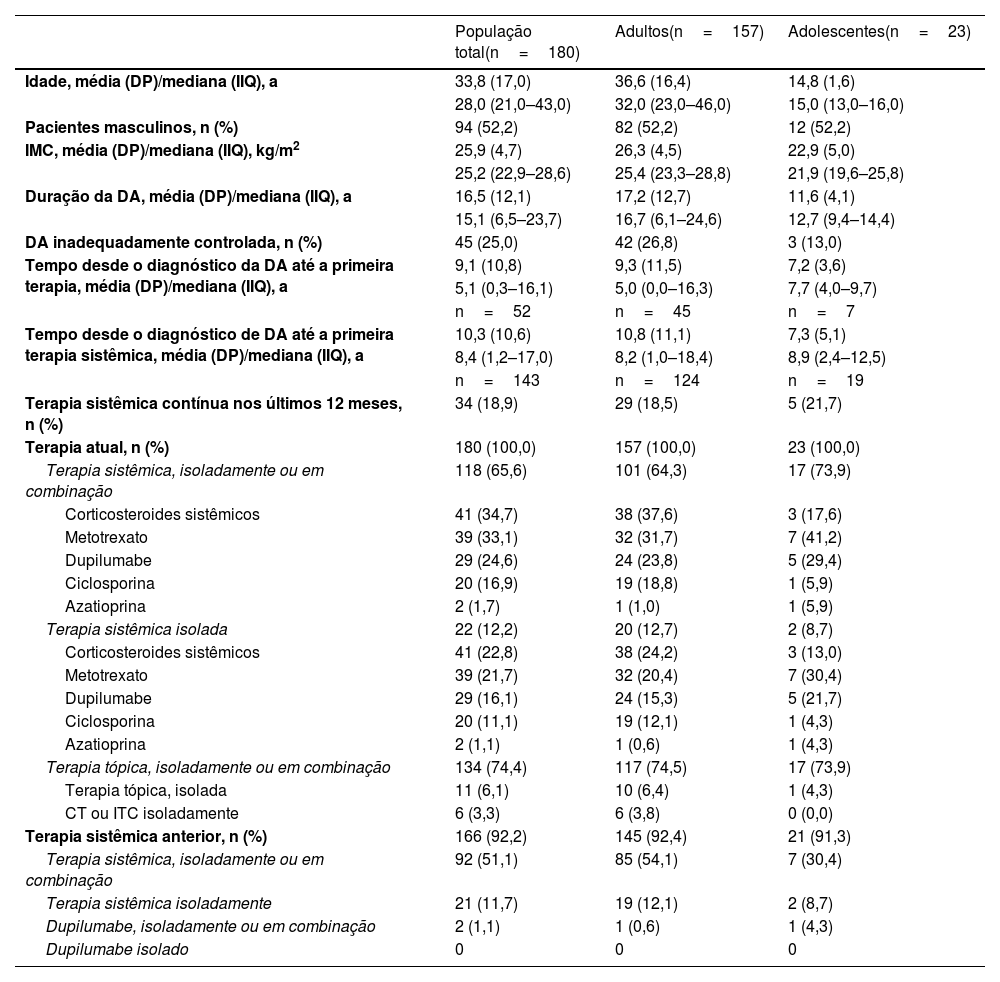
ResultadosA população latino‐americana do MEASURE‐AD (Brasil, México e Argentina) consistiu em 180 pacientes (adultos, n=157; adolescentes, n=23). A média de idade (DP) foi de 33,8 (17,0) anos, e 52,2% dos pacientes eram masculinos (tabela 1). No momento da visita do estudo, os pacientes tinham histórico de DA com média de 16,5 anos (adultos, 17,2 anos; adolescentes, 11,6 anos).
Dados demográficos e características basais em pacientes do Brasil, México e Argentina
| População total(n=180) | Adultos(n=157) | Adolescentes(n=23) | |
|---|---|---|---|
| Idade, média (DP)/mediana (IIQ), a | 33,8 (17,0) | 36,6 (16,4) | 14,8 (1,6) |
| 28,0 (21,0–43,0) | 32,0 (23,0–46,0) | 15,0 (13,0–16,0) | |
| Pacientes masculinos, n (%) | 94 (52,2) | 82 (52,2) | 12 (52,2) |
| IMC, média (DP)/mediana (IIQ), kg/m2 | 25,9 (4,7) | 26,3 (4,5) | 22,9 (5,0) |
| 25,2 (22,9–28,6) | 25,4 (23,3–28,8) | 21,9 (19,6–25,8) | |
| Duração da DA, média (DP)/mediana (IIQ), a | 16,5 (12,1) | 17,2 (12,7) | 11,6 (4,1) |
| 15,1 (6,5–23,7) | 16,7 (6,1–24,6) | 12,7 (9,4–14,4) | |
| DA inadequadamente controlada, n (%) | 45 (25,0) | 42 (26,8) | 3 (13,0) |
| Tempo desde o diagnóstico da DA até a primeira terapia, média (DP)/mediana (IIQ), a | 9,1 (10,8) | 9,3 (11,5) | 7,2 (3,6) |
| 5,1 (0,3–16,1) | 5,0 (0,0–16,3) | 7,7 (4,0–9,7) | |
| n=52 | n=45 | n=7 | |
| Tempo desde o diagnóstico de DA até a primeira terapia sistêmica, média (DP)/mediana (IIQ), a | 10,3 (10,6) | 10,8 (11,1) | 7,3 (5,1) |
| 8,4 (1,2–17,0) | 8,2 (1,0–18,4) | 8,9 (2,4–12,5) | |
| n=143 | n=124 | n=19 | |
| Terapia sistêmica contínua nos últimos 12 meses, n (%) | 34 (18,9) | 29 (18,5) | 5 (21,7) |
| Terapia atual, n (%) | 180 (100,0) | 157 (100,0) | 23 (100,0) |
| Terapia sistêmica, isoladamente ou em combinação | 118 (65,6) | 101 (64,3) | 17 (73,9) |
| Corticosteroides sistêmicos | 41 (34,7) | 38 (37,6) | 3 (17,6) |
| Metotrexato | 39 (33,1) | 32 (31,7) | 7 (41,2) |
| Dupilumabe | 29 (24,6) | 24 (23,8) | 5 (29,4) |
| Ciclosporina | 20 (16,9) | 19 (18,8) | 1 (5,9) |
| Azatioprina | 2 (1,7) | 1 (1,0) | 1 (5,9) |
| Terapia sistêmica isolada | 22 (12,2) | 20 (12,7) | 2 (8,7) |
| Corticosteroides sistêmicos | 41 (22,8) | 38 (24,2) | 3 (13,0) |
| Metotrexato | 39 (21,7) | 32 (20,4) | 7 (30,4) |
| Dupilumabe | 29 (16,1) | 24 (15,3) | 5 (21,7) |
| Ciclosporina | 20 (11,1) | 19 (12,1) | 1 (4,3) |
| Azatioprina | 2 (1,1) | 1 (0,6) | 1 (4,3) |
| Terapia tópica, isoladamente ou em combinação | 134 (74,4) | 117 (74,5) | 17 (73,9) |
| Terapia tópica, isolada | 11 (6,1) | 10 (6,4) | 1 (4,3) |
| CT ou ITC isoladamente | 6 (3,3) | 6 (3,8) | 0 (0,0) |
| Terapia sistêmica anterior, n (%) | 166 (92,2) | 145 (92,4) | 21 (91,3) |
| Terapia sistêmica, isoladamente ou em combinação | 92 (51,1) | 85 (54,1) | 7 (30,4) |
| Terapia sistêmica isoladamente | 21 (11,7) | 19 (12,1) | 2 (8,7) |
| Dupilumabe, isoladamente ou em combinação | 2 (1,1) | 1 (0,6) | 1 (4,3) |
| Dupilumabe isolado | 0 | 0 | 0 |
DA, dermatite atópica; IMC, índice de massa corporal; IIQ, intervalo interquartil; DP, desvio padrão; ITC, inibidor tópico de calcineurina; CT, corticosteroide tópico.
Todos os pacientes estavam recebendo tratamento para DA, incluindo 74,4% recebendo terapia tópica isoladamente ou combinada (6,1% terapia tópica isoladamente). Embora todos os pacientes fossem elegíveis para tratamento sistêmico, apenas 65,6% estavam recebendo terapia sistêmica isoladamente ou combinada, e 12,2% estavam recebendo terapia sistêmica isoladamente; 18,9% dos pacientes haviam feito uso de terapia sistêmica contínua nos 12 meses anteriores (tabela 1).
Entre os 118 pacientes que receberam terapias sistêmicas, as mais comuns foram corticosteroides sistêmicos (34,7%), metotrexato (33,1%), dupilumabe (24,6%) e ciclosporina (16,9%). Entre todos os 180 pacientes, 22,8% usavam corticosteroides sistêmicos, 21,7% metotrexato, 16,1% dupilumabe (15,3% entre os adultos) e 11,1% ciclosporina. O tempo médio (DP) entre o diagnóstico de DA e a primeira administração do tratamento sistêmico foi de 10,3 (10,6) anos (adultos, 10,81,11 anos; adolescentes, 7,31,5 anos). Aproximadamente 25% dos pacientes em geral (26,8% na população adulta e 13,0% na população adolescente) relataram que tinham a doença inadequadamente controlada.
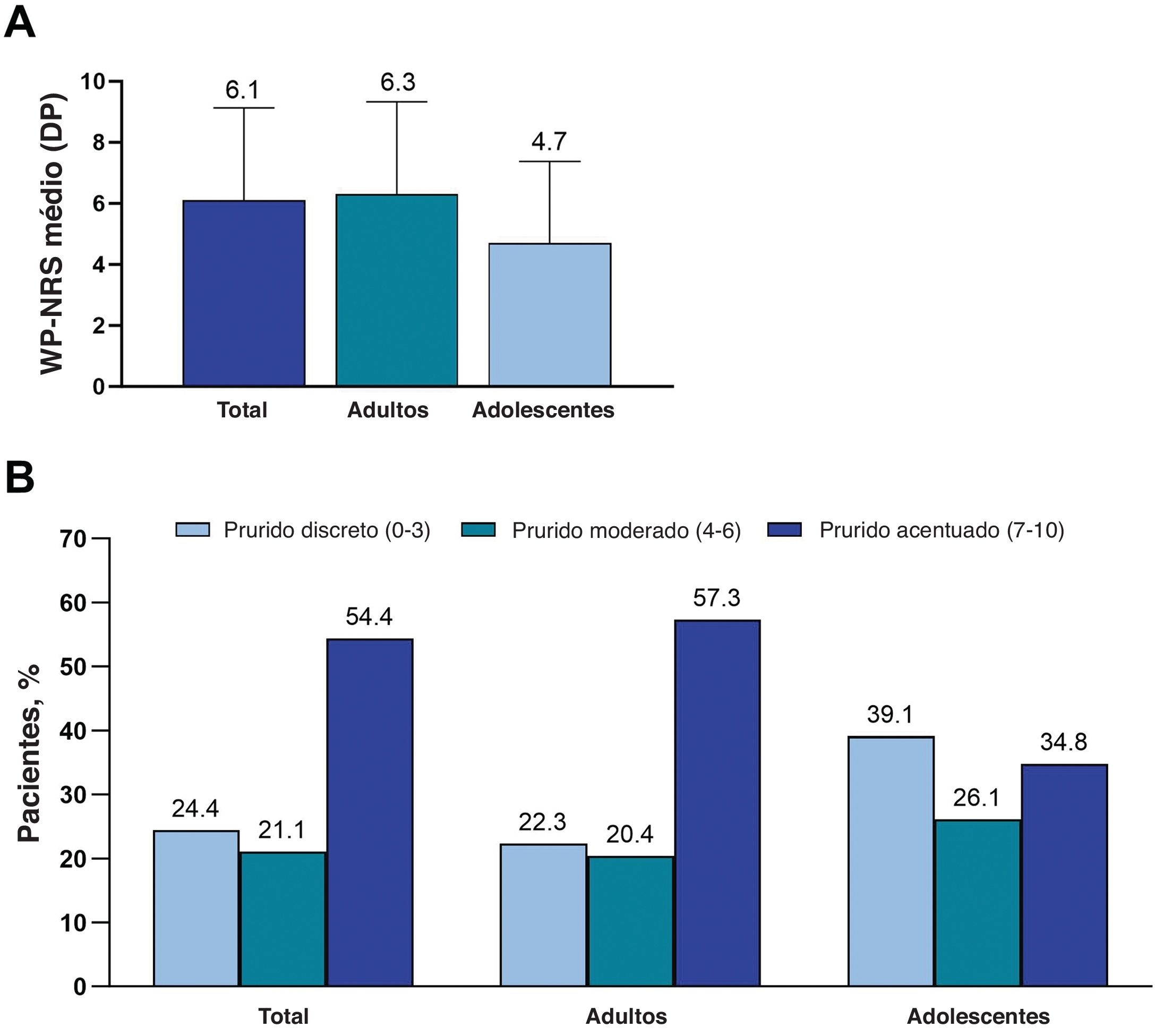
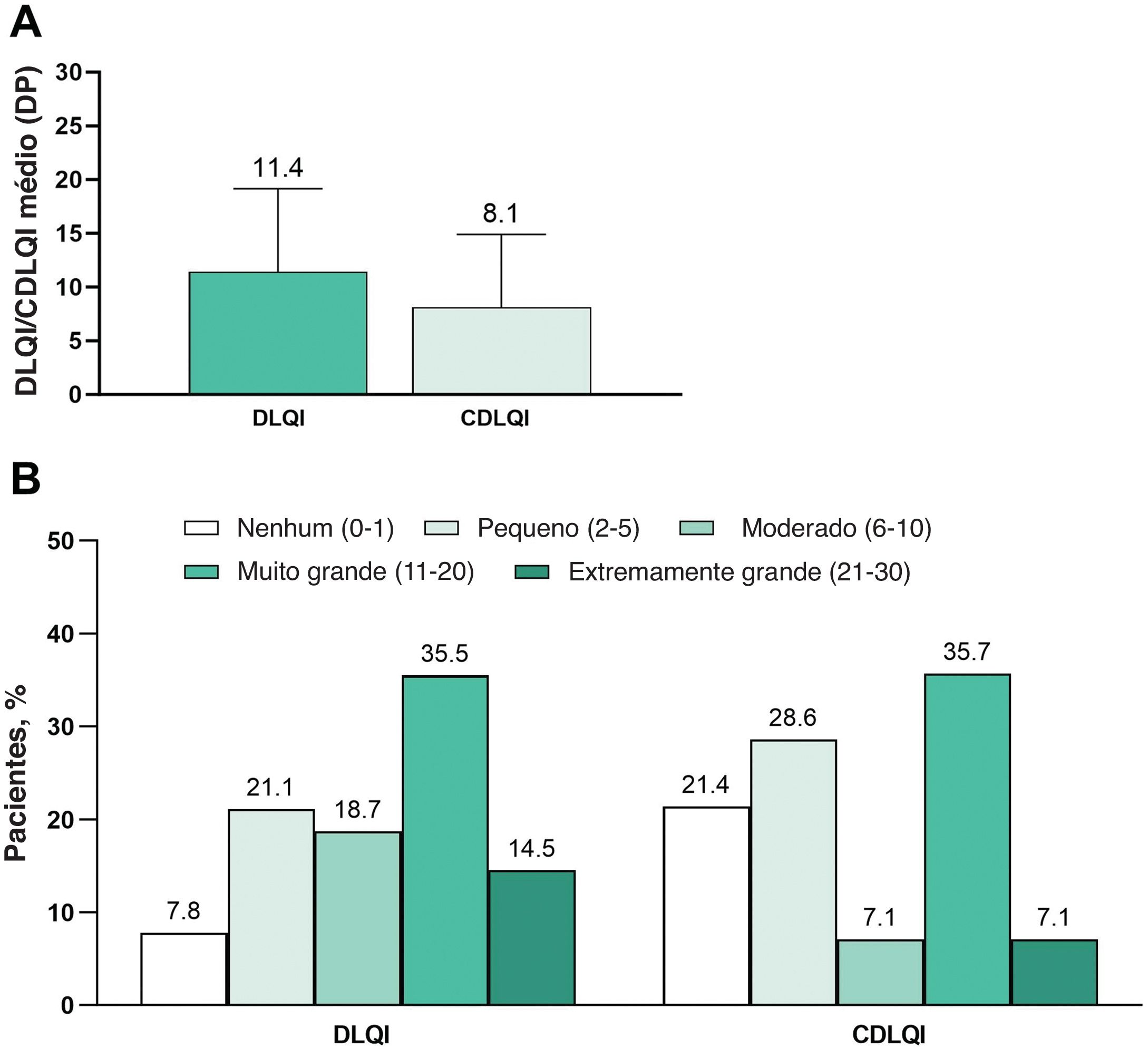
Desfechos primários: Prurido e QVO escore médio do WP‐NRS foi 6,1, e a mediana do escore foi 7 (adultos, 6,3 e 7, respectivamente; adolescentes, 4,7 e 5; fig. 1A). Prurido grave (WP‐NRS ≥ 7) foi relatado por 54,4% dos pacientes (adultos, 57,3%; adolescentes, 34,8%; fig. 1B). O DLQI médio foi 11,4, e o CDLQI médio foi 8,1 (fig. 2A). Efeito muito grande ou extremamente grande na QV (DLQI ou CDLQI ≥ 11) foi relatado por 50,0% dos pacientes ≥ 16 anos e 42,9% dos pacientes de 12 a 15 anos (fig. 2B).
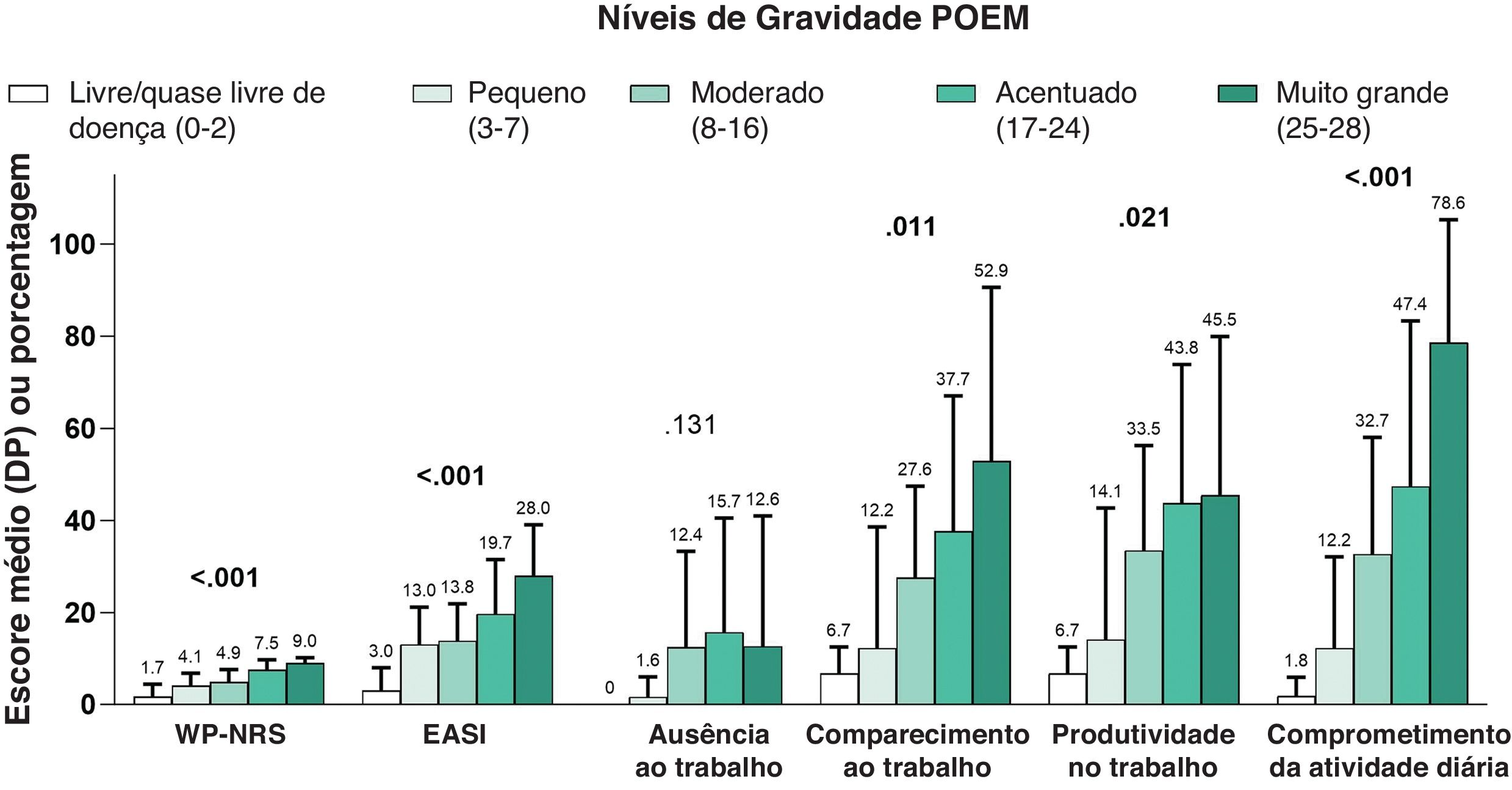
Os desfechos secundários mostraram impacto da doença semelhante nas populações adulta e adolescente (tabela 2). O POEM médio foi de 15,7 (adultos, 16,3; adolescentes, 11,4). A população total relatou média de 6,1 horas de sono por noite. No geral, 48,3% dos pacientes relataram problemas de sono que interferiram “um pouco a muito” nas atividades diárias na semana anterior. O escore médio do SCORAD foi de 52,5 e foi maior entre adultos (54,3) em comparação com adolescentes (40,8). Um total de 9,4% dos pacientes tinham DA discreta (SCORAD <25), 31,7% DA moderada (SCORAD 25–50) e 58,3% DA acentuada (SCORAD >50).
Impacto clínico da dermatite atópica
| População total(n=180) | Adultos(n=157) | Adolescentes(n=23) | |
|---|---|---|---|
| POEM, média (DP)/mediana (IIQ) | 15,7 (7,4) | 16,3 (7,3) | 11,4 (7,0) |
| 17,0 (10,0–21,0) | 17,0 (11,0–22,0) | 11,0 (6,0–11,0) | |
| Média de horas de sono por noite na última semana, média (DP)/mediana (IIQ) | 6,1 (1,9) | 5,9 (1,9) | 7,4 (1,4) |
| 6,0 (5,0–8,0) | 6,0 (5,0–7,0) | 8,0 (6,0–8,0) | |
| Média de minutos necessários para adormecer por noite na última semana, média (DP)/mediana (IIQ) | 43,2 (50,3) | 43,5 (49,1) | 41,4 (58,8) |
| 30,0 (17,5–60,0) | 30,0 (20,0–60,0) | 20,0 (10,0–60,0) | |
| Problemas de sono interferindo na função diária na última semana, n (%) | |||
| Não tenho problemas de sono | 14 (7,8) | 11 (7,0) | 3 (13,0) |
| De modo algum | 48 (26,7) | 37 (23,6) | 11 (47,8) |
| Um pouco | 31 (17,2) | 26 (16,6) | 5 (21,7) |
| Bastante | 28 (15,6) | 28 (17,8) | 0 (0,0) |
| Muito | 31 (17,2) | 30 (19,1) | 1 (4,3) |
| Muitíssimo | 28 (15,6) | 25 (15,9) | 3 (13,0) |
| SCORAD, média (DP)/mediana (IIQ) | 52,5 (20,7) | 54,3 (19,9) | 40,8 (22,5) |
| 55,3 (40,5–67,1) | 55,9 (43,2–68,8) | 44,0 (30,8–60,9) | |
| n=179 | n=156 | ||
| Categorias SORAD, n (%) | |||
| Pequeno (< 25,0) | 17 (9,4) | 12 (7,6) | 5 (21,7) |
| Moderado (25,0–50,0) | 57 (31,7) | 49 (31,2) | 8 (34,8) |
| Acentuado (> 50,0) | 105 (58,3) | 95 (60,5) | 10 (43,5) |
| vIGA‐AD, média (DP)/mediana (IIQ) | 2,9 (1,0) | 3,0 (0,9) | 2,5 (1,3) |
| 3,0 (3,0–4,0) | 3,0 (3,0–4,0) | 3,0 (1,0–3,0) | |
| vIGA‐AD categorias, n (%) | |||
| Livre de doença (0) | 6 (3,3) | 4 (2,5) | 2 (8,7) |
| Quase livre de doença (1) | 12 (6,7) | 8 (5,1) | 4 (17,4) |
| Pequeno (2) | 17 (9,4) | 15 (9,6) | 2 (8,7) |
| Moderado (3) | 98 (54,4) | 88 (56,1) | 10 (43,5) |
| Acentuado (4) | 47 (26,1) | 42 (26,8) | 5 (21,7) |
| Área de superfície corporal, média (DP)/mediana (IIQ), % | 26,5 (21,3) | 27,2 (21,5) | 21,4 (19,0) |
| 21,5 (10,0–40,0) | 22,0 (10,0–40,0) | 20,0 (6,0–35,0) | |
| EASI, média (DP)/mediana (IIQ) | 17,0 (11,5) | 17,7 (11,4) | 12,4 (10,7) |
| 15,0 (8,9–23,6) | 15,9 (9,2–24,6) | 9,8 (4,4–18,0) | |
| Categorias EASI, n (%) | |||
| Livre de doença (0) | 7 (3,9) | 4 (2,5) | 3 (13,0) |
| Pequeno (0,1–5,9) | 18 (10,0) | 14 (8,9) | 4 (17,4) |
| Moderado (6,0–22,9) | 107 (59,4) | 95 (60,5) | 12 (52,2) |
| Acentuado (23,0–72,0) | 48 (26,7) | 44 (28,0) | 4 (17,4) |
| Número de exacerbações nos últimos seis meses, média (intervalo)/mediana (IIQ) | 5,0 (0–50) | 4,9 (0–50) | 5,8 (0–30) |
| 3,0 (2,0–6,0) | 3,0 (2,0–6,0) | 3,0 (2,0–4,0) | |
| n=169 | n=148 | n=21 | |
| Número de exacerbações nos últimos seis meses, n (%) | |||
| 0 | 15 (8,3) | 12 (7,6) | 3 (13,0) |
| 1–2 | 49 (27,2) | 44 (28,0) | 5 (21,7) |
| 3–4 | 56 (31,1) | 48 (30,6) | 8 (34,8) |
| 5–6 | 21 (11,7) | 20 (12,7) | 1 (4,3) |
| >6 | 28 (15,6) | 24 (15,3) | 4 (17,4) |
| Sem informações | 11 (6,1) | 9 (5,7) | 2 (8,7) |
| Duração média das exacerbações nos últimos seis meses, média (intervalo)/mediana (IIQ), d | 15,2 (0–180) | 15,9 (0–180) | 11,1 (0–90) |
| 7,0 (4,0–15,0) | 10,0 (5,0–15,0) | 7,0 (3,0–8,0) | |
| n=172 | n=149 | ||
| Duração média das exacerbações nos últimos seis meses, n (%), d | |||
| ≤ 2 | 28 (15,6) | 23 (14,6) | 5 (21,7) |
| 3–7 | 60 (33,3) | 48 (30,6) | 12 (52,2) |
| 8–14 | 26 (14,4) | 24 (15,3) | 2 (8,7) |
| ≥ 15 | 58 (32,2) | 54 (34,4) | 4 (17,4) |
| Sem informações | 8 (4,4) | 8 (5,1) | 0 |
| 5D‐Pruritus score, média (DP)/mediana (IIQ) | 16,2 (4,5) | 16,5 (4,3) | 13,9 (4,6) |
| 17,0 (13,0–20,0) | 17,0 (13,0–20,0) | 12,5 (11,0–15,0) | |
| n=176 | n=154 | n=22 | |
| ADerm‐IS total, média (DP)/mediana (IIQ) | 42,3 (30,7) | 45,0 (30,4) | 23,5 (26,7) |
| 40,0 (13,0–69,0) | 43,0 (18,0–71,0) | 11,0 (6,0–34,0) | |
| n=177 | n=155 | n=22 | |
| Questões do sono ADerm‐IS, média (DP)/mediana (IIQ) | 13,5 (10,6) | 14,3 (10,6) | 8,0 (9,3) |
| 13,0 (2,0–24,0) | 15,0 (4,0–24,0) | 3,0 (0,0–15,0) | |
| n=179 | n=22 | ||
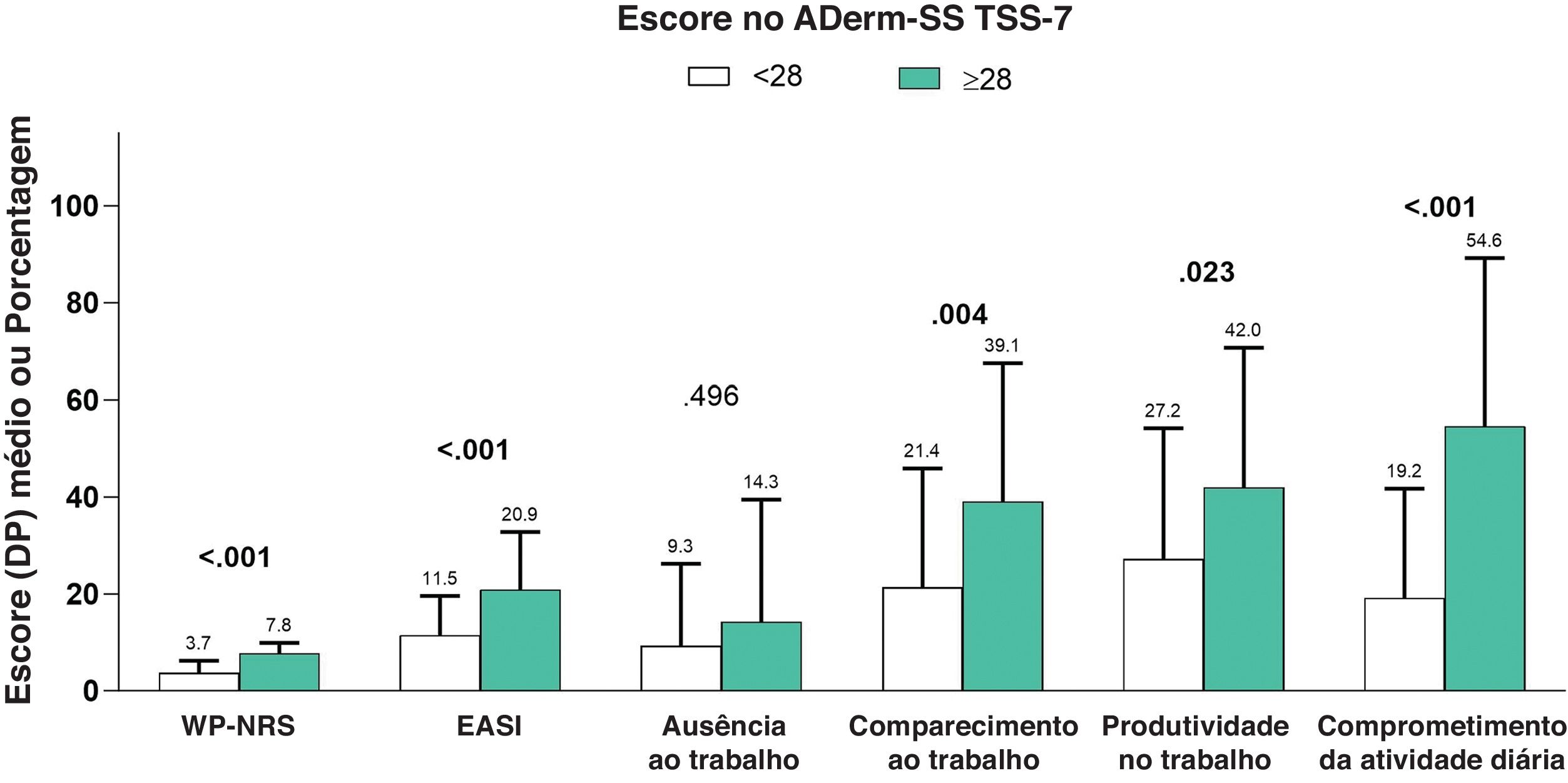
| ADerm‐SS TSS‐7, média (DP)/mediana (IIQ) | 34,2 (21,1) | 36,2 (20,7) | 20,3 (18,9) |
| 31,0 (17,5–53,0) | 35,0 (20,0–54,0) | 14,0 (6,0–26,0) | |
| ADerm‐SS TSS‐11, média (DP)/mediana (IIQ) | 49,2 (31,6) | 51,8 (31,1) | 31,3 (29,3) |
| 44,0 (24,0–76,0) | 49,0 (29,0–77,0) | 26,0 (9,0–44,0) | |
| n=177 | n=154 | ||
| ADerm‐SS Dor na pele, média (DP)/mediana (IIQ) | 4,4 (3,7) | 4,6 (3,8) | 2,9 (3,1) |
| 4,0 (1,0–8,0) | 5,0 (1,0–8,0) | 2,0 (0,0–5,0) | |
| SF‐12 PCS, média (DP)/mediana (IIQ) | ND | 48,6 (9,0) | ND |
| 50,4 (42,9–55,1) | |||
| n=154 | |||
| SF‐10 PHS, média (DP)/mediana (IIQ) | ND | ND | 38,0 (14,5) |
| 42,0 (32,5–48,4) |
ADerm‐IS, Atopic Dermatitis Impact Scale; ADerm‐SS, Atopic Dermatitis Symptom Scale; ADerm‐SS TSS‐7, Atopic Dermatitis Symptom Scale Total Symptom Score‐7; EASI, Eczema Area and Severity Index; IIQ, intervalo interquartil; POEM, Patient Oriented Eczema Measurement; SCORAD, SCORing Atopic Dermatitis; SF‐12 PCS, 12‐item Short‐Form Health Survey Physical Component Summary (adultos); SF‐10 PHS, 10‐item Short‐Form Health Survey Physical Health Score (adolescents); vIGA‐AD, Validated Investigator Global Assessment for Atopic Dermatitis.
A média do vIGA‐AD foi de 2,9 (adultos, 3,0; adolescentes, 2,5), e o escore médio do EASI foi de 17,0 (adultos, 17,7; adolescentes, 12,4). Em geral, 3,9% dos pacientes tinham pele livre da doença (EASI=0) e 26,7% tinham DA grave (EASI 23–72).
A média do ADerm‐SS Skin Pain foi de 4,4, indicando doença moderada (tabela 2). Os escores médios do ADerm‐SS TSS‐7 e TSS‐11 (34,2 e 49,2, respectivamente) indicando igualmente a quantidade moderada de sintomas (tabela 2).
Exacerbações recorrentes foi relatada por 169 pacientes. Frequências de 0, 1 a 2, 3 a 4, 5 a 6 e >6 exacerbações nos seis meses anteriores foram relatadas por 8,3%, 27,2%, 31,1%, 11,7% e 15,6% dos pacientes, respectivamente. Em média, as exacerbações duraram 15,2 dias (adultos, 15,9 dias; adolescentes, 11,1 dias).
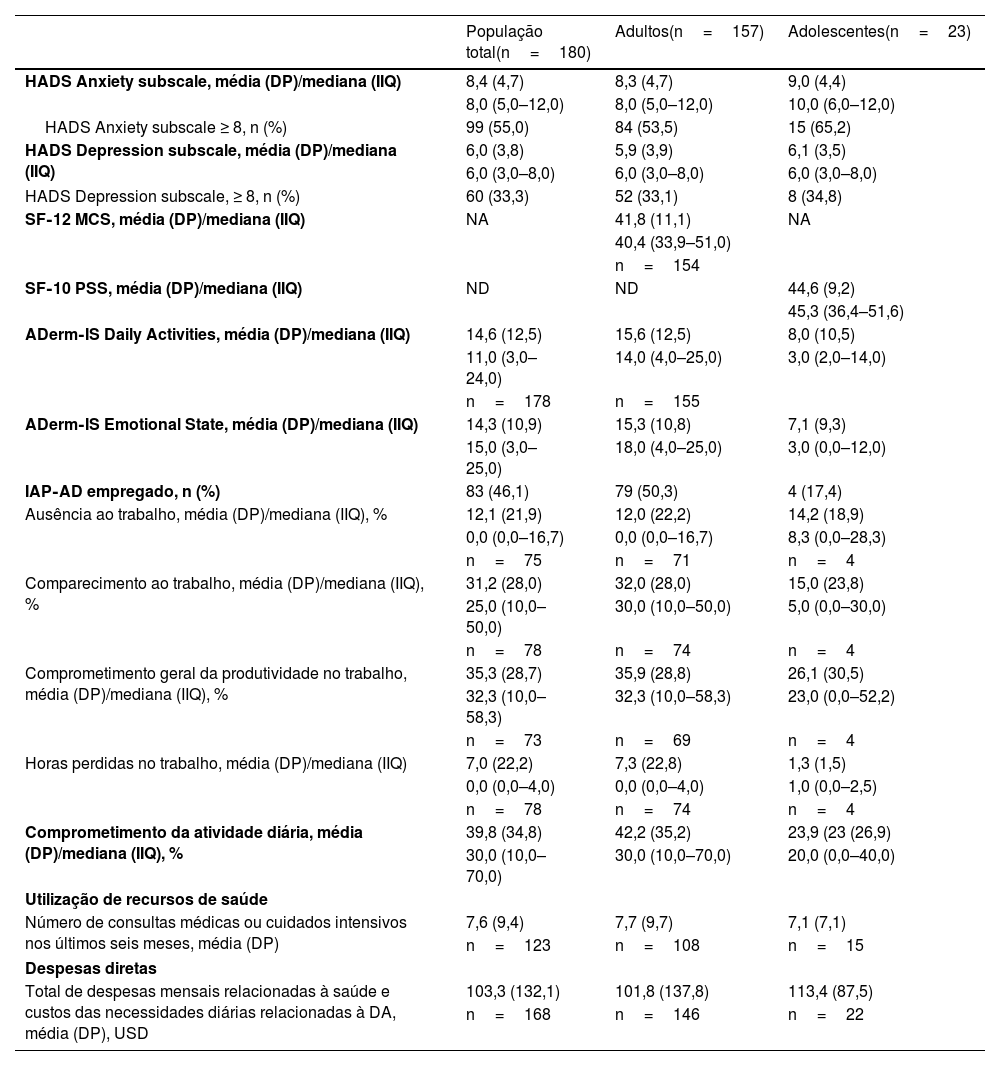
Ansiedade anormal limítrofe a anormal (HADS‐A ≥ 8) e depressão (HADS‐D ≥ 8) foram relatadas por 55,0% e 33,3% dos pacientes na população total; uma taxa ligeiramente maior de ansiedade foi relatada entre adolescentes (65,2%) em comparação com adultos (53,5%; tabela 3). O escore médio do resumo do componente mental do SF‐12 foi de 41,8 para adultos, e o escore médio do resumo do componente psicossocial do SF‐10 foi de 44,6 para adolescentes (tabela 3). Média de perda de produtividade no trabalho de 35,9% foi observada entre adultos empregados (tabela 3). Efeitos semelhantes da DA impactaram os escores do ADerm‐IS Emotional State (média, 14,3) e da ADerm‐IS Daily Activities (média, 14,6), indicando doença moderada (tabela 3). O número médio de consultas médicas ou de cuidados agudos durante os seis meses anteriores foi de 7,6, dado semelhante para adultos (7,7) e adolescentes (7,1; tabela 3). As despesas médias mensais relacionadas à saúde e os custos das necessidades diárias relacionadas à DA (convertidos para dólares americanos [USD]) de 2021 foram de 103,3 USD na população total (adultos, 101,8 USD; adolescentes 113,4 USD).
Impacto psicossocioeconômico da dermatite atópica
| População total(n=180) | Adultos(n=157) | Adolescentes(n=23) | |
|---|---|---|---|
| HADS Anxiety subscale, média (DP)/mediana (IIQ) | 8,4 (4,7) | 8,3 (4,7) | 9,0 (4,4) |
| 8,0 (5,0–12,0) | 8,0 (5,0–12,0) | 10,0 (6,0–12,0) | |
| HADS Anxiety subscale ≥ 8, n (%) | 99 (55,0) | 84 (53,5) | 15 (65,2) |
| HADS Depression subscale, média (DP)/mediana (IIQ) | 6,0 (3,8) | 5,9 (3,9) | 6,1 (3,5) |
| 6,0 (3,0–8,0) | 6,0 (3,0–8,0) | 6,0 (3,0–8,0) | |
| HADS Depression subscale, ≥ 8, n (%) | 60 (33,3) | 52 (33,1) | 8 (34,8) |
| SF‐12 MCS, média (DP)/mediana (IIQ) | NA | 41,8 (11,1) | NA |
| 40,4 (33,9–51,0) | |||
| n=154 | |||
| SF‐10 PSS, média (DP)/mediana (IIQ) | ND | ND | 44,6 (9,2) |
| 45,3 (36,4–51,6) | |||
| ADerm‐IS Daily Activities, média (DP)/mediana (IIQ) | 14,6 (12,5) | 15,6 (12,5) | 8,0 (10,5) |
| 11,0 (3,0–24,0) | 14,0 (4,0–25,0) | 3,0 (2,0–14,0) | |
| n=178 | n=155 | ||
| ADerm‐IS Emotional State, média (DP)/mediana (IIQ) | 14,3 (10,9) | 15,3 (10,8) | 7,1 (9,3) |
| 15,0 (3,0–25,0) | 18,0 (4,0–25,0) | 3,0 (0,0–12,0) | |
| IAP‐AD empregado, n (%) | 83 (46,1) | 79 (50,3) | 4 (17,4) |
| Ausência ao trabalho, média (DP)/mediana (IIQ), % | 12,1 (21,9) | 12,0 (22,2) | 14,2 (18,9) |
| 0,0 (0,0–16,7) | 0,0 (0,0–16,7) | 8,3 (0,0–28,3) | |
| n=75 | n=71 | n=4 | |
| Comparecimento ao trabalho, média (DP)/mediana (IIQ), % | 31,2 (28,0) | 32,0 (28,0) | 15,0 (23,8) |
| 25,0 (10,0–50,0) | 30,0 (10,0–50,0) | 5,0 (0,0–30,0) | |
| n=78 | n=74 | n=4 | |
| Comprometimento geral da produtividade no trabalho, média (DP)/mediana (IIQ), % | 35,3 (28,7) | 35,9 (28,8) | 26,1 (30,5) |
| 32,3 (10,0–58,3) | 32,3 (10,0–58,3) | 23,0 (0,0–52,2) | |
| n=73 | n=69 | n=4 | |
| Horas perdidas no trabalho, média (DP)/mediana (IIQ) | 7,0 (22,2) | 7,3 (22,8) | 1,3 (1,5) |
| 0,0 (0,0–4,0) | 0,0 (0,0–4,0) | 1,0 (0,0–2,5) | |
| n=78 | n=74 | n=4 | |
| Comprometimento da atividade diária, média (DP)/mediana (IIQ), % | 39,8 (34,8) | 42,2 (35,2) | 23,9 (23 (26,9) |
| 30,0 (10,0–70,0) | 30,0 (10,0–70,0) | 20,0 (0,0–40,0) | |
| Utilização de recursos de saúde | |||
| Número de consultas médicas ou cuidados intensivos nos últimos seis meses, média (DP) | 7,6 (9,4) | 7,7 (9,7) | 7,1 (7,1) |
| n=123 | n=108 | n=15 | |
| Despesas diretas | |||
| Total de despesas mensais relacionadas à saúde e custos das necessidades diárias relacionadas à DA, média (DP), USD | 103,3 (132,1) | 101,8 (137,8) | 113,4 (87,5) |
| n=168 | n=146 | n=22 |
DA, dermatite atópica; ADerm‐IS, Atopic Dermatitis Impact Scale; ADerm‐SS, Atopic Dermatitis Symptom Scale; HADS, Hospital Anxiety and Depression Scale; IIQ, intervalo interquartil; DP, desvio padrão; SF‐12 MCS, 12‐item Short‐Form Health Survey Mental Component Summary (adultos); SF‐10 PSS, 10‐item Short‐Form Health Survey Psychosocial Summary Score (adolescentes); USD, dólares americanos; WPAI‐AD, Work Productivity and Activity Impairment‐Atopic Dermatitis.
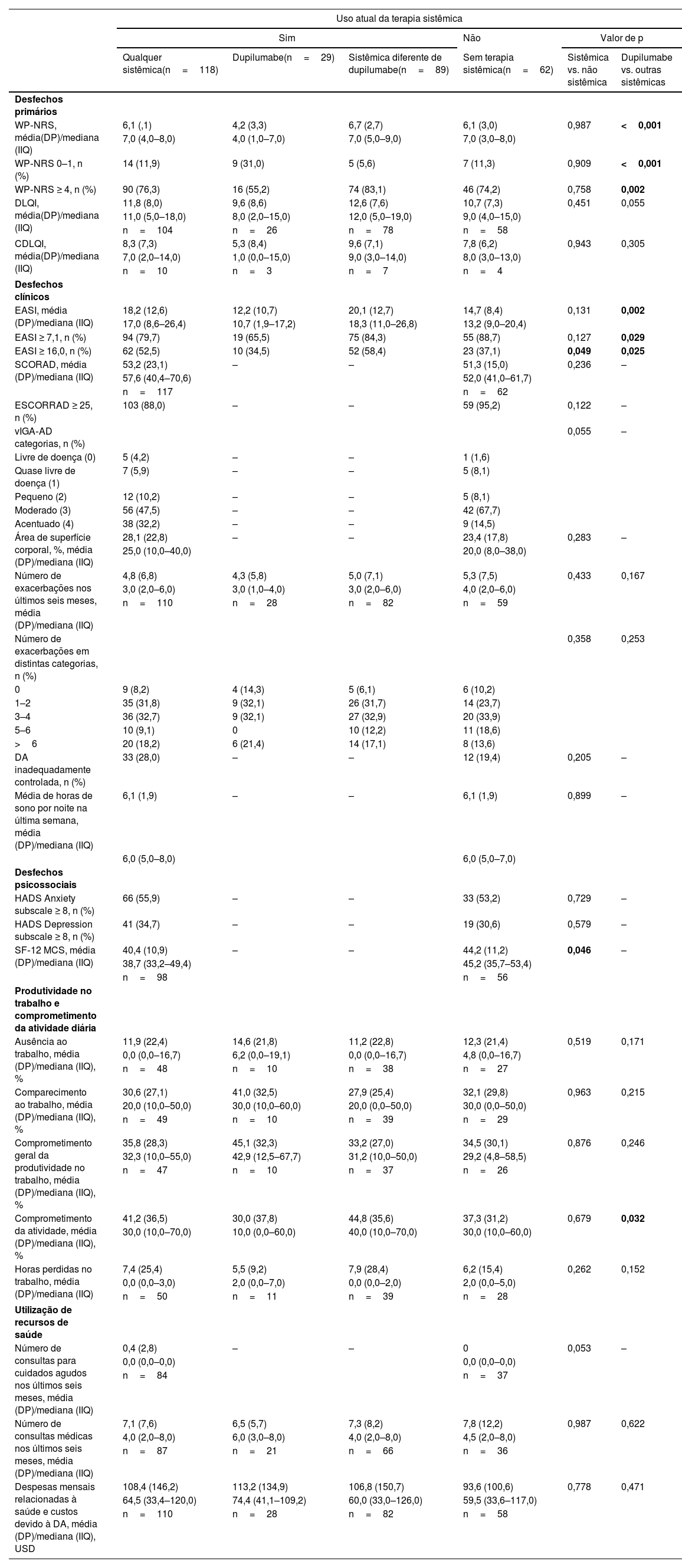
Em uma análise de subgrupos quanto ao uso atual de terapia sistêmica (sim, n=118; não, n=62), nenhuma diferença significante nos desfechos primários ou secundários foi observada entre os grupos (tabela 4). As únicas exceções foram escore médio ligeiramente maior do resumo do componente mental do SF‐12 (pior saúde mental) e maior proporção de pacientes com EASI ≥ 16,0 entre usuários de terapia sistêmica versus usuários de terapia não sistêmica (tabela 4). Foi observada impacto substancial da doença entre pacientes que estavam e que não estavam recebendo terapia sistêmica, com base na média do WP‐NRS (6,1 e 6,1), média do DLQI (11,8 e 10,7), média do EASI (18,1 e 14,7), média do SCORAD (53,2 e 51,3) e média do número de exacerbações nos últimos seis meses (4,8 e 5,3, respectivamente; tabela 4).
Impacto clínico, psicossocial e econômico da dermatite atópica em uso de terapia sistêmica
| Uso atual da terapia sistêmica | ||||||
|---|---|---|---|---|---|---|
| Sim | Não | Valor de p | ||||
| Qualquer sistêmica(n=118) | Dupilumabe(n=29) | Sistêmica diferente de dupilumabe(n=89) | Sem terapia sistêmica(n=62) | Sistêmica vs. não sistêmica | Dupilumabe vs. outras sistêmicas | |
| Desfechos primários | ||||||
| WP‐NRS, média(DP)/mediana (IIQ) | 6,1 (,1) | 4,2 (3,3) | 6,7 (2,7) | 6,1 (3,0) | 0,987 | <0,001 |
| 7,0 (4,0–8,0) | 4,0 (1,0–7,0) | 7,0 (5,0–9,0) | 7,0 (3,0–8,0) | |||
| WP‐NRS 0–1, n (%) | 14 (11,9) | 9 (31,0) | 5 (5,6) | 7 (11,3) | 0,909 | <0,001 |
| WP‐NRS ≥ 4, n (%) | 90 (76,3) | 16 (55,2) | 74 (83,1) | 46 (74,2) | 0,758 | 0,002 |
| DLQI, média(DP)/mediana (IIQ) | 11,8 (8,0) | 9,6 (8,6) | 12,6 (7,6) | 10,7 (7,3) | 0,451 | 0,055 |
| 11,0 (5,0–18,0) | 8,0 (2,0–15,0) | 12,0 (5,0–19,0) | 9,0 (4,0–15,0) | |||
| n=104 | n=26 | n=78 | n=58 | |||
| CDLQI, média(DP)/mediana (IIQ) | 8,3 (7,3) | 5,3 (8,4) | 9,6 (7,1) | 7,8 (6,2) | 0,943 | 0,305 |
| 7,0 (2,0–14,0) | 1,0 (0,0–15,0) | 9,0 (3,0–14,0) | 8,0 (3,0–13,0) | |||
| n=10 | n=3 | n=7 | n=4 | |||
| Desfechos clínicos | ||||||
| EASI, média (DP)/mediana (IIQ) | 18,2 (12,6) | 12,2 (10,7) | 20,1 (12,7) | 14,7 (8,4) | 0,131 | 0,002 |
| 17,0 (8,6–26,4) | 10,7 (1,9–17,2) | 18,3 (11,0–26,8) | 13,2 (9,0–20,4) | |||
| EASI ≥ 7,1, n (%) | 94 (79,7) | 19 (65,5) | 75 (84,3) | 55 (88,7) | 0,127 | 0,029 |
| EASI ≥ 16,0, n (%) | 62 (52,5) | 10 (34,5) | 52 (58,4) | 23 (37,1) | 0,049 | 0,025 |
| SCORAD, média (DP)/mediana (IIQ) | 53,2 (23,1) | – | – | 51,3 (15,0) | 0,236 | – |
| 57,6 (40,4–70,6) | 52,0 (41,0–61,7) | |||||
| n=117 | n=62 | |||||
| ESCORRAD ≥ 25, n (%) | 103 (88,0) | – | – | 59 (95,2) | 0,122 | – |
| vIGA‐AD categorias, n (%) | 0,055 | – | ||||
| Livre de doença (0) | 5 (4,2) | – | – | 1 (1,6) | ||
| Quase livre de doença (1) | 7 (5,9) | – | – | 5 (8,1) | ||
| Pequeno (2) | 12 (10,2) | – | – | 5 (8,1) | ||
| Moderado (3) | 56 (47,5) | – | – | 42 (67,7) | ||
| Acentuado (4) | 38 (32,2) | – | – | 9 (14,5) | ||
| Área de superfície corporal, %, média (DP)/mediana (IIQ) | 28,1 (22,8) | – | – | 23,4 (17,8) | 0,283 | – |
| 25,0 (10,0–40,0) | 20,0 (8,0–38,0) | |||||
| Número de exacerbações nos últimos seis meses, média (DP)/mediana (IIQ) | 4,8 (6,8) | 4,3 (5,8) | 5,0 (7,1) | 5,3 (7,5) | 0,433 | 0,167 |
| 3,0 (2,0–6,0) | 3,0 (1,0–4,0) | 3,0 (2,0–6,0) | 4,0 (2,0–6,0) | |||
| n=110 | n=28 | n=82 | n=59 | |||
| Número de exacerbações em distintas categorias, n (%) | 0,358 | 0,253 | ||||
| 0 | 9 (8,2) | 4 (14,3) | 5 (6,1) | 6 (10,2) | ||
| 1–2 | 35 (31,8) | 9 (32,1) | 26 (31,7) | 14 (23,7) | ||
| 3–4 | 36 (32,7) | 9 (32,1) | 27 (32,9) | 20 (33,9) | ||
| 5–6 | 10 (9,1) | 0 | 10 (12,2) | 11 (18,6) | ||
| >6 | 20 (18,2) | 6 (21,4) | 14 (17,1) | 8 (13,6) | ||
| DA inadequadamente controlada, n (%) | 33 (28,0) | – | – | 12 (19,4) | 0,205 | – |
| Média de horas de sono por noite na última semana, média (DP)/mediana (IIQ) | 6,1 (1,9) | – | – | 6,1 (1,9) | 0,899 | – |
| 6,0 (5,0–8,0) | 6,0 (5,0–7,0) | |||||
| Desfechos psicossociais | ||||||
| HADS Anxiety subscale ≥ 8, n (%) | 66 (55,9) | – | – | 33 (53,2) | 0,729 | – |
| HADS Depression subscale ≥ 8, n (%) | 41 (34,7) | – | – | 19 (30,6) | 0,579 | – |
| SF‐12 MCS, média (DP)/mediana (IIQ) | 40,4 (10,9) | – | – | 44,2 (11,2) | 0,046 | – |
| 38,7 (33,2–49,4) | 45,2 (35,7–53,4) | |||||
| n=98 | n=56 | |||||
| Produtividade no trabalho e comprometimento da atividade diária | ||||||
| Ausência ao trabalho, média (DP)/mediana (IIQ), % | 11,9 (22,4) | 14,6 (21,8) | 11,2 (22,8) | 12,3 (21,4) | 0,519 | 0,171 |
| 0,0 (0,0–16,7) | 6,2 (0,0–19,1) | 0,0 (0,0–16,7) | 4,8 (0,0–16,7) | |||
| n=48 | n=10 | n=38 | n=27 | |||
| Comparecimento ao trabalho, média (DP)/mediana (IIQ), % | 30,6 (27,1) | 41,0 (32,5) | 27,9 (25,4) | 32,1 (29,8) | 0,963 | 0,215 |
| 20,0 (10,0–50,0) | 30,0 (10,0–60,0) | 20,0 (0,0–50,0) | 30,0 (0,0–50,0) | |||
| n=49 | n=10 | n=39 | n=29 | |||
| Comprometimento geral da produtividade no trabalho, média (DP)/mediana (IIQ), % | 35,8 (28,3) | 45,1 (32,3) | 33,2 (27,0) | 34,5 (30,1) | 0,876 | 0,246 |
| 32,3 (10,0–55,0) | 42,9 (12,5–67,7) | 31,2 (10,0–50,0) | 29,2 (4,8–58,5) | |||
| n=47 | n=10 | n=37 | n=26 | |||
| Comprometimento da atividade, média (DP)/mediana (IIQ), % | 41,2 (36,5) | 30,0 (37,8) | 44,8 (35,6) | 37,3 (31,2) | 0,679 | 0,032 |
| 30,0 (10,0–70,0) | 10,0 (0,0–60,0) | 40,0 (10,0–70,0) | 30,0 (10,0–60,0) | |||
| Horas perdidas no trabalho, média (DP)/mediana (IIQ) | 7,4 (25,4) | 5,5 (9,2) | 7,9 (28,4) | 6,2 (15,4) | 0,262 | 0,152 |
| 0,0 (0,0–3,0) | 2,0 (0,0–7,0) | 0,0 (0,0–2,0) | 2,0 (0,0–5,0) | |||
| n=50 | n=11 | n=39 | n=28 | |||
| Utilização de recursos de saúde | ||||||
| Número de consultas para cuidados agudos nos últimos seis meses, média (DP)/mediana (IIQ) | 0,4 (2,8) | – | – | 0 | 0,053 | – |
| 0,0 (0,0–0,0) | 0,0 (0,0–0,0) | |||||
| n=84 | n=37 | |||||
| Número de consultas médicas nos últimos seis meses, média (DP)/mediana (IIQ) | 7,1 (7,6) | 6,5 (5,7) | 7,3 (8,2) | 7,8 (12,2) | 0,987 | 0,622 |
| 4,0 (2,0–8,0) | 6,0 (3,0–8,0) | 4,0 (2,0–8,0) | 4,5 (2,0–8,0) | |||
| n=87 | n=21 | n=66 | n=36 | |||
| Despesas mensais relacionadas à saúde e custos devido à DA, média (DP)/mediana (IIQ), USD | 108,4 (146,2) | 113,2 (134,9) | 106,8 (150,7) | 93,6 (100,6) | 0,778 | 0,471 |
| 64,5 (33,4–120,0) | 74,4 (41,1–109,2) | 60,0 (33,0–126,0) | 59,5 (33,6–117,0) | |||
| n=110 | n=28 | n=82 | n=58 | |||
DA, dermatite atópica; CDLQI, Children's Dermatology Life Quality Index; DLQI, Dermatology Life Quality Index; EASI, Eczema Area and Severity Index; HADS, Hospital Anxiety and Depression Scale; IIQ, intervalo interquartil; SCORAD, SCORing Atopic Dermatitis; SF‐12 MCS, 12‐item Short‐Form Health Survey Mental Component Summary; USD, dólares americanos; vIGA‐AD, Validated Investigator Global Assessment for Atopic Dermatitis; WP‐NRS, Worst Pruritus Numeric Rating Scale.
Na comparação de dupilumabe (monoterapia ou em combinação, n=29) versus outra terapia sistêmica (n=89), os pacientes que receberam dupilumabe geralmente apresentaram menor gravidade da doença e comprometimento da atividade, mas as diferenças foram significantes apenas para o escore EASI médio (p=0,002), WP‐NRS médio (p <0,001) e comprometimento da atividade (p=0,032) e para proporções de pacientes com EASI ≥ 7,1 (p=0,029), EASI ≥ 16,0 (p=0,025), WP‐NRS 0–1 (p<0,001) e WP‐NRS ≥ 4 (p=0,002; tabela 4). Impacto substancial da doença também foi observado entre pacientes recebendo dupilumabe com base na média do WP‐NRS (4,2), média do DLQI (9,6), média do EASI (12,2) e número médio de exacerbações nos últimos seis meses (4,3; tabela 4).
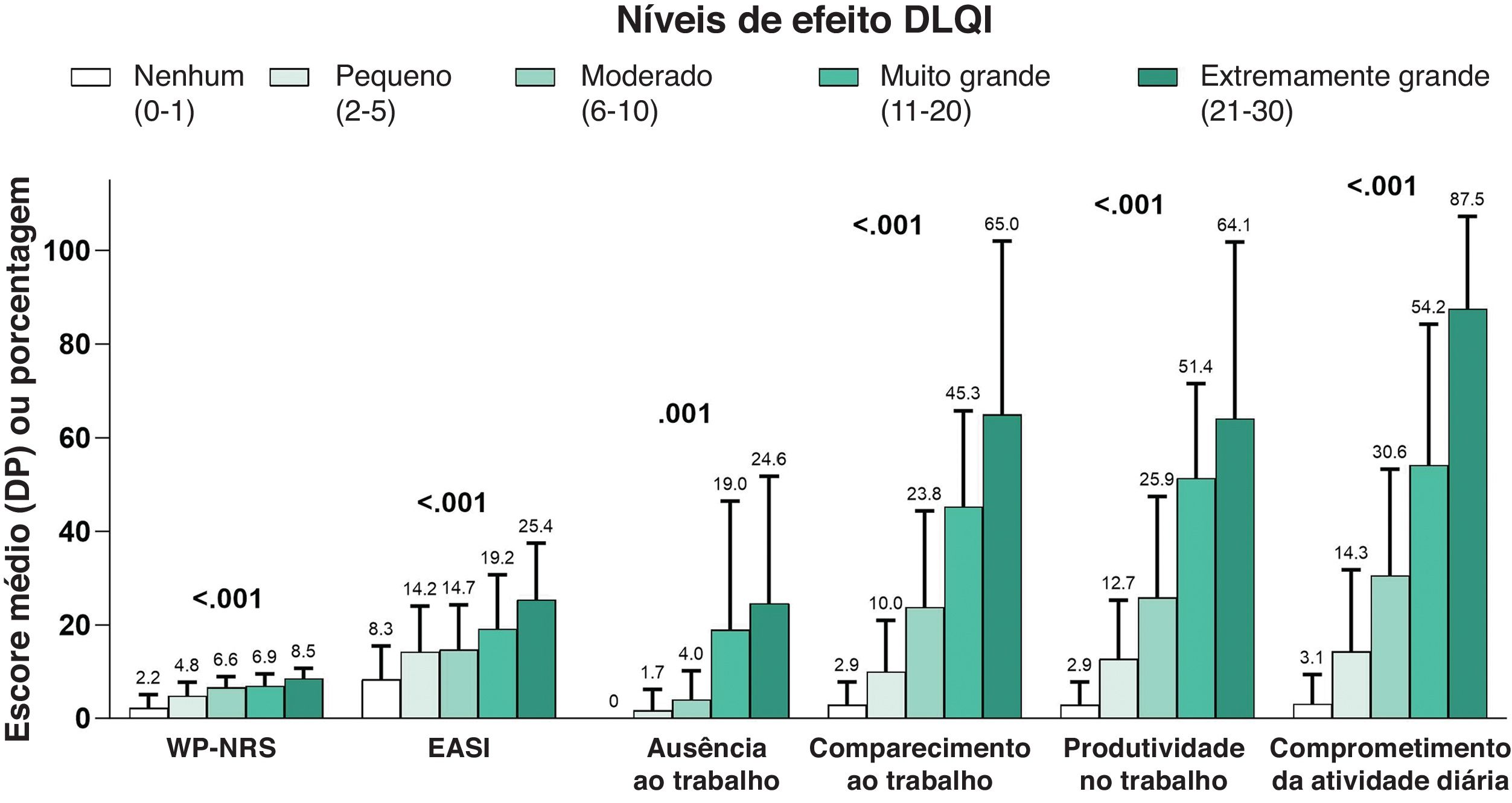
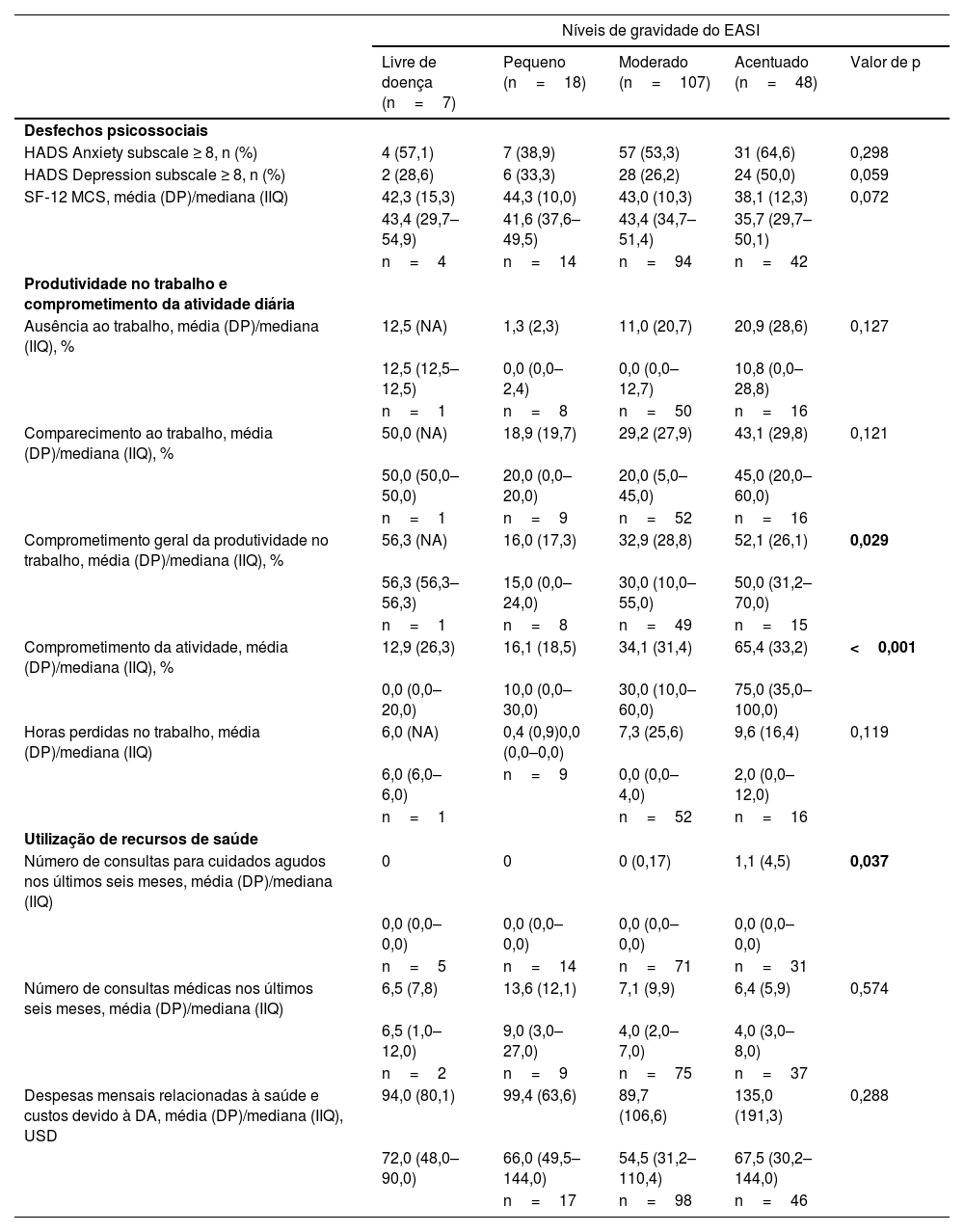
Em uma análise de subgrupo quanto à gravidade do EASI, o comprometimento geral da produtividade do trabalho, o comprometimento da atividade e o número geral de consultas para cuidados agudos foram significantemente associados ao aumento da gravidade da doença (tabela 5). Da mesma maneira, maior DLQI (fig. 3), POEM mais grave (fig. 4) e maior escore ADerm‐SS TSS‐7 (fig. 5) foram associados a gravidade significantemente maior da doença, gravidade do prurido e comprometimentos da produtividade no trabalho e nas atividades diárias.
Impacto psicossocial e econômico da dermatite atópica por nível de gravidade da doença do EASI
| Níveis de gravidade do EASI | |||||
|---|---|---|---|---|---|
| Livre de doença (n=7) | Pequeno (n=18) | Moderado (n=107) | Acentuado (n=48) | Valor de p | |
| Desfechos psicossociais | |||||
| HADS Anxiety subscale ≥ 8, n (%) | 4 (57,1) | 7 (38,9) | 57 (53,3) | 31 (64,6) | 0,298 |
| HADS Depression subscale ≥ 8, n (%) | 2 (28,6) | 6 (33,3) | 28 (26,2) | 24 (50,0) | 0,059 |
| SF‐12 MCS, média (DP)/mediana (IIQ) | 42,3 (15,3) | 44,3 (10,0) | 43,0 (10,3) | 38,1 (12,3) | 0,072 |
| 43,4 (29,7–54,9) | 41,6 (37,6–49,5) | 43,4 (34,7–51,4) | 35,7 (29,7–50,1) | ||
| n=4 | n=14 | n=94 | n=42 | ||
| Produtividade no trabalho e comprometimento da atividade diária | |||||
| Ausência ao trabalho, média (DP)/mediana (IIQ), % | 12,5 (NA) | 1,3 (2,3) | 11,0 (20,7) | 20,9 (28,6) | 0,127 |
| 12,5 (12,5–12,5) | 0,0 (0,0–2,4) | 0,0 (0,0–12,7) | 10,8 (0,0–28,8) | ||
| n=1 | n=8 | n=50 | n=16 | ||
| Comparecimento ao trabalho, média (DP)/mediana (IIQ), % | 50,0 (NA) | 18,9 (19,7) | 29,2 (27,9) | 43,1 (29,8) | 0,121 |
| 50,0 (50,0–50,0) | 20,0 (0,0–20,0) | 20,0 (5,0–45,0) | 45,0 (20,0–60,0) | ||
| n=1 | n=9 | n=52 | n=16 | ||
| Comprometimento geral da produtividade no trabalho, média (DP)/mediana (IIQ), % | 56,3 (NA) | 16,0 (17,3) | 32,9 (28,8) | 52,1 (26,1) | 0,029 |
| 56,3 (56,3–56,3) | 15,0 (0,0–24,0) | 30,0 (10,0–55,0) | 50,0 (31,2–70,0) | ||
| n=1 | n=8 | n=49 | n=15 | ||
| Comprometimento da atividade, média (DP)/mediana (IIQ), % | 12,9 (26,3) | 16,1 (18,5) | 34,1 (31,4) | 65,4 (33,2) | <0,001 |
| 0,0 (0,0–20,0) | 10,0 (0,0–30,0) | 30,0 (10,0–60,0) | 75,0 (35,0–100,0) | ||
| Horas perdidas no trabalho, média (DP)/mediana (IIQ) | 6,0 (NA) | 0,4 (0,9)0,0 (0,0–0,0) | 7,3 (25,6) | 9,6 (16,4) | 0,119 |
| 6,0 (6,0–6,0) | n=9 | 0,0 (0,0–4,0) | 2,0 (0,0–12,0) | ||
| n=1 | n=52 | n=16 | |||
| Utilização de recursos de saúde | |||||
| Número de consultas para cuidados agudos nos últimos seis meses, média (DP)/mediana (IIQ) | 0 | 0 | 0 (0,17) | 1,1 (4,5) | 0,037 |
| 0,0 (0,0–0,0) | 0,0 (0,0–0,0) | 0,0 (0,0–0,0) | 0,0 (0,0–0,0) | ||
| n=5 | n=14 | n=71 | n=31 | ||
| Número de consultas médicas nos últimos seis meses, média (DP)/mediana (IIQ) | 6,5 (7,8) | 13,6 (12,1) | 7,1 (9,9) | 6,4 (5,9) | 0,574 |
| 6,5 (1,0–12,0) | 9,0 (3,0–27,0) | 4,0 (2,0–7,0) | 4,0 (3,0–8,0) | ||
| n=2 | n=9 | n=75 | n=37 | ||
| Despesas mensais relacionadas à saúde e custos devido à DA, média (DP)/mediana (IIQ), USD | 94,0 (80,1) | 99,4 (63,6) | 89,7 (106,6) | 135,0 (191,3) | 0,288 |
| 72,0 (48,0–90,0) | 66,0 (49,5–144,0) | 54,5 (31,2–110,4) | 67,5 (30,2–144,0) | ||
| n=17 | n=98 | n=46 | |||
DA, dermatite atópica; EASI, Eczema Area and Severity Index; HADS, Hospital Anxiety and Depression Scale; IIQ, intervalo interquartil; DP, desvio padrão; SF‐12 MCS, 12‐item Short‐Form Health Survey Mental Component Summary; USD, dólares americanos.
Esta análise de 180 adultos e adolescentes com DA de três países latino‐americanos demonstrou considerável impacto clínico, psicossocial e econômico da doença. Mais da metade dos pacientes adultos (57%) e 35% dos pacientes adolescentes relataram prurido acentuado. Efeito muito grande ou extremamente grande na QV foi relatado por 50% dos adultos e 43% dos adolescentes. Além disso, ansiedade, depressão e problemas de sono foram prevalentes, com 54% dos adultos relatando HADS‐A ≥ 8 (65% dos adolescentes), 33% relatando HADS‐D ≥ 8 (35% dos adolescentes) e 53% relatando distúrbios relacionados ao sono ocorrendo de um pouco a muito (17% dos adolescentes).
Embora todos os pacientes tenham recebido tratamento e 2/3 tenham recebido terapias sistêmicas, doença moderada a grave foi relatada por 90% e 86% dos pacientes com base nos escores SCORAD e EASI, respectivamente, sugerindo doença inadequadamente controlada. Em análise de subgrupo para uso de terapia sistêmica, nenhuma diferença no impacto carga da doença foi observada entre pacientes recebendo terapia sistêmica versus pacientes não recebendo terapia sistêmica. O impacto da doença (incluindo número de exacerbações, impacto na QV e carga econômica) permaneceu elevado em ambos os grupos. Entretanto, entre os pacientes recebendo a terapia biológica com dupilumabe, uma tendência para menor gravidade da doença, melhor QV e menor comprometimento da atividade foi observada em comparação com pacientes recebendo outras terapias sistêmicas convencionais ou pacientes não recebendo terapia sistêmica. Entretanto, impacto substancial da doença ainda foi observado entre os pacientes recebendo dupilumabe, indicando necessidade persistente não atendida de terapias eficazes para a DA.
Em geral, os resultados na população latino‐americana do MEASURE‐AD indicaram que um impacto considerável da doença ainda existe entre os pacientes com DA, independente do tratamento atual, incluindo terapia sistêmica.
Esses resultados também estão alinhados com estudos anteriores da América Latina. Em estudo retrospectivo baseado em registro conduzido no Brasil entre 2016 e 2017, 87% (85/98) dos pacientes apresentaram doença moderada a grave, quando avaliada pelo SCORAD, e 75% (24/32), quando avaliada pelo EASI.17 O uso de corticosteroides orais (33%; 61/187) foi ligeiramente maior nessa população do que na população da América Latina do MEASURE‐AD (23%; 41/180).17 Em outro estudo observacional na Colômbia que incluiu pacientes atendidos entre 2019 e 2020, 76% (SCORAD) e 61% (EASI) dos pacientes apresentavam doença moderada a grave, com 63% (133/212) usando corticosteroides orais e 7% (14/212) usando dupilumabe (vs. 23%; 41/180 e 16% 29/180, respectivamente, no MEASURE‐AD América Latina).16 Resultados semelhantes foram demonstrados em outros estudos na América Latina.15,23 Além disso, os efeitos psicológicos, de convívio social e econômicos também são relevantes entre os pacientes na América Latina.15,18 Em pesquisa baseada na web envolvendo 1.650 pacientes adultos e pediátricos com DA na Argentina, 86,5% dos pacientes relataram impacto negativo na QV, com frustração, raiva, alterações de humor, estresse, alterações do sono e rotina, dor e impacto econômico estando entre os domínios com classificação mais alta.18 Os tratamentos tópicos foram usados com frequência, incluindo 60% dos pacientes que receberam corticosteroides tópicos; no entanto, 21,7% dos pacientes relataram satisfação moderada com o tratamento e 40,5% estavam insatisfeitos com seu regime de tratamento. Outro achado importante do estudo foi o retardo no diagnóstico, mais evidente nas províncias distantes de Buenos Aires, e a falta de conhecimento sobre o diagnóstico da doença entre os especialistas.18
Os resultados de estudos em crianças e adolescentes com DA também mostram alto impacto da doença. No estudo internacional PEDISTAD, com 732 crianças (23% da América Latina), impacto significante da DA moderada a grave no prurido, sono, QV e família foi demonstrado em crianças e seus cuidadores. Isso pode ser explicado pelo pequeno uso de terapias sistêmicas (23%).24 Do mesmo modo, um estudo com 50 crianças e adolescentes com DA no Brasil demonstrou efeito negativo moderado a alto da DA na QV em 72% dos pacientes e 74% das famílias.25 Esses resultados são consistentes com os achados do estudo MEASURE‐AD, que demonstrou considerável impacto da doença (incluindo prurido) e comprometimento do sono e da QV entre adolescentes latino‐americanos, dos quais apenas 22% usaram tratamento sistêmico continuamente nos 12 meses anteriores.
Impacto da doença ligeiramente maior foi relatado na população latino‐americana em comparação com a população global do MEASURE‐AD, na qual prurido intenso foi relatado por 42% dos pacientes, efeito muito grande ou extremamente grande na QV foi relatado por 46% dos adultos e 32% dos adolescentes, e doença moderada a grave foi relatada por 69% (EASI ≥ 6) e 76% (SCORAD ≥ 25) dos pacientes.20
Curiosamente, o tempo para início da primeira terapia sistêmica foi maior na população global do MEASURE‐AD (17 anos) em comparação com a população latino‐americana (10 anos), o que pode indicar que os pacientes latino‐americanos com DA buscaram tratamento mais tarde no curso da doença e passaram para a terapia sistêmica mais rapidamente do que a população global. Embora o uso de terapias sistêmicas tenha sido ligeiramente maior na população latino‐americana em comparação à população global (66% vs. 56%), o uso de terapia biológica (dupilumabe) entre usuários de terapia sistêmica foi consideravelmente menor na América Latina (25% vs. 56%, respectivamente), o que poderia explicar o maior impacto da doença. Em contraste, o uso de corticosteroides sistêmicos (35% vs. 18%) e metotrexato (33% vs. 16%) entre usuários de terapia sistêmica foi maior na população latino‐americana em comparação à população global. Entre todos os pacientes adultos inscritos no MEASURE‐AD (n=1434), o uso de terapia biológica (dupilumabe) foi muito menor na América Latina (15%; 24/157) em comparação com outras regiões geográficas, como Arábia Saudita, Kuwait e Emirados Árabes Unidos (62%; 26/42), Itália (57%; 67/118), Alemanha (46%; 96/210), Canadá (44%; 88/200), Suíça e Áustria (46%; 43/94) e Espanha (42%; 38/91). Na América Latina, o custo da medicação sistêmica afeta as escolhas de tratamento, além do acesso ao tratamento. Tanto o metotrexato quanto os corticosteroides orais são mais baratos e mais fáceis de administrar, o que pode explicar sua maior utilização em comparação ao dupilumabe. Vale ressaltar que a pandemia de COVID‐19 estava em andamento no momento do estudo, o que pode ter afetado o acesso ao dupilumabe e reduzido seu uso. Em geral, esses achados podem ser explicados por diferenças de acesso ao mercado entre os países e indicam que nem todos os pacientes da América Latina têm acesso a medicamentos sistêmicos e permanecem subtratados.26
É importante notar que o dupilumabe era a única terapia biológica aprovada para DA no momento do estudo MEASURE‐AD. O número de opções de tratamento para DA aumentou desde então com a aprovação de inibidores da Janus quinase (baricitinibe, upadacitinibe e abrocitinibe) e biológicos (como traloquinumabe) em alguns países. Portanto, estudos futuros são necessários para avaliar o efeito da aprovação dessas terapias no impacto da DA.
Os pontos fortes deste estudo incluíram o relato de ampla variedade de resultados por médicos e pacientes, incluindo QV. Além disso, este foi o maior estudo avaliando o impacto multidimensional da DA (clínico, psicológico, socioeconômico) e o impacto dos tratamentos sistêmicos disponíveis para a doença na América Latina. As limitações deste estudo incluíram confiar em informações autorrelatadas pelos pacientes e recordação durante uma única consulta médica e o fato de que apenas pacientes que estavam recebendo ou eram candidatos à terapia sistêmica foram incluídos. Além disso, o dupilumabe era a única terapia biológica aprovada no momento do estudo, que foi conduzido antes da disponibilização dos inibidores da Janus quinase. Ademais, o status de aprovação regulatória local e as políticas de acesso ao mercado/reembolso variaram entre os países, e alguns pacientes tiveram acesso limitado a tratamentos inovadores.
ConclusãoPacientes com DA moderada a grave no Brasil, México e Argentina continuam a experimentar impacto multidimensional substancial da doença e doença não controlada. Embora a maioria dos pacientes tenha usado tratamentos tópicos, 2/3 estavam recebendo tratamentos sistêmicos (principalmente corticosteroides ou metotrexato) isoladamente ou em combinação. Estudos futuros precisam analisar o efeito de terapias mais recentes e eficazes no impacto da doença. Em geral, uma necessidade significante de tratamentos eficazes permanece não atendida para melhorar os resultados psicossociais e clínicos dos pacientes e reduzir o impacto econômico da DA.
Suporte financeiroA AbbVie Inc. financiou os estudos e participou do desenho do estudo, pesquisa, análises, obtenção e interpretação dos dados, revisão e aprovação da publicação. Nenhum honorário ou pagamento foi feito pela autoria. Todos os autores tiveram acesso a dados relevantes e participaram da elaboração, revisão e aprovação desta publicação.
Contribuição dos autoresCatalina Rincón Pérez: Aprovação da versão final do manuscrito; revisão crítica da literatura; obtenção, análise e interpretação dos dados; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; participação efetiva na orientação da pesquisa; análise e interpretação dos dados; revisão crítica do manuscrito; elaboração e redação do manuscrito.
Valeria Aoki: Aprovação da versão final do manuscrito; revisão crítica da literatura; obtenção, análise e interpretação dos dados; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; participação efetiva na orientação da pesquisa; análise e interpretação dos dados; revisão crítica do manuscrito; elaboração e redação do manuscrito.
Roberta F. Criado: Aprovação da versão final do manuscrito; obtenção, análise e interpretação dos dados; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; participação efetiva na orientação da pesquisa; análise e interpretação dos dados; revisão crítica do manuscrito; elaboração e redação do manuscrito.
Martti Antila: Aprovação da versão final do manuscrito; revisão crítica da literatura; obtenção, análise e interpretação dos dados; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; participação efetiva na orientação da pesquisa; análise e interpretação dos dados; revisão crítica do manuscrito; elaboração e redação do manuscrito.
Maria Valeria Angles: Aprovação da versão final do manuscrito; obtenção, análise e interpretação dos dados; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; participação efetiva na orientação da pesquisa; análise e interpretação dos dados; revisão crítica do manuscrito; elaboração e redação do manuscrito.
Tania Ferreira Cestari: Aprovação da versão final do manuscrito; obtenção, análise e interpretação dos dados; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; participação efetiva na orientação da pesquisa; análise e interpretação dos dados; revisão crítica do manuscrito; elaboração e redação do manuscrito.
Delfina Guadalupe Villanueva Quintero: Aprovação da versão final do manuscrito; obtenção, análise e interpretação dos dados; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; participação efetiva na orientação da pesquisa; análise e interpretação dos dados; revisão crítica do manuscrito; elaboração e redação do manuscrito.
Gabriel Magariños: Aprovação da versão final do manuscrito; obtenção, análise e interpretação dos dados; participação intelectual em condução propedêutica e/ou terapêutica de casos estudados; participação efetiva na orientação da pesquisa; análise e interpretação dos dados; revisão crítica do manuscrito; elaboração e redação do manuscrito.
Carla Castro: Aprovação da versão final do manuscrito; obtenção, análise e interpretação dos dados; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; participação efetiva na orientação da pesquisa; análise e interpretação dos dados; revisão crítica do manuscrito; elaboração e redação do manuscrito.
Adriana López Tello‐Santillán: Aprovação da versão final do manuscrito; obtenção, análise e interpretação dos dados; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; participação efetiva na orientação da pesquisa; análise e interpretação dos dados; revisão crítica do manuscrito; elaboração e redação do manuscrito.
Magda Weber: Aprovação da versão final do manuscrito; obtenção, análise e interpretação dos dados; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; participação efetiva na orientação da pesquisa; análise e interpretação dos dados; revisão crítica do manuscrito; elaboração e redação do manuscrito.
Daniel Lorenzini: Aprovação da versão final do manuscrito; obtenção, análise e interpretação dos dados; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; participação efetiva na orientação da pesquisa; análise e interpretação dos dados; revisão crítica do manuscrito; elaboração e redação do manuscrito.
Caio Cesar Silva de Castro: Aprovação da versão final do manuscrito; obtenção, análise e interpretação dos dados; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; participação efetiva na orientação da pesquisa, análise e interpretação dos dados; revisão crítica do manuscrito; elaboração e redação do manuscrito.
Jorge Maspero: Aprovação da versão final do manuscrito; revisão crítica da literatura; obtenção, análise e interpretação dos dados; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; participação efetiva na orientação da pesquisa; análise e interpretação dos dados; revisão crítica do manuscrito; elaboração e redação do manuscrito.
Linda García‐Hidalgo: Aprovação da versão final do manuscrito; obtenção, análise e interpretação dos dados; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; participação efetiva na orientação da pesquisa; análise e interpretação dos dados; revisão crítica do manuscrito; elaboração e redação do manuscrito.
Limei Zhou: Aprovação da versão final do manuscrito; obtenção, análise e interpretação dos dados; análise e interpretação dos dados; revisão crítica do manuscrito; elaboração e redação do manuscrito; análise estatística; concepção e planejamento do estudo.
Shereen Hammad: Aprovação da versão final do manuscrito; revisão crítica da literatura; obtenção, análise e interpretação dos dados; análise e interpretação dos dados; revisão crítica do manuscrito; elaboração e redação do manuscrito; concepção e planejamento do estudo.
Lucila de Campos: Aprovação da versão final do manuscrito; revisão crítica da literatura; obtenção, análise e interpretação dos dados; análise e interpretação dos dados; revisão crítica do manuscrito; elaboração e redação do manuscrito; concepção e planejamento do estudo.
Tatiane Cristina Rodrigues: Aprovação da versão final do manuscrito; revisão crítica da literatura; obtenção, análise e interpretação dos dados; análise e interpretação dos dados; revisão crítica do manuscrito; elaboração e redação do manuscrito; concepção e planejamento do estudo.
Carolina Arzelán: Aprovação da versão final do manuscrito; revisão crítica da literatura; obtenção, análise e interpretação dos dados; análise e interpretação dos dados; revisão crítica do manuscrito; elaboração e redação do manuscrito; concepção e planejamento do estudo.
Paula C. Luna: Aprovação da versão final do manuscrito; obtenção, análise e interpretação dos dados; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; participação efetiva na orientação da pesquisa; análise e interpretação dos dados; revisão crítica do manuscrito; elaboração e redação do manuscrito.
Trabalho realizado em 14 locais na Argentina, Brasil e MéxicoArgentinaFundación Cidea Allergy and Respiratory Research Unit, Buenos Aires; Hospital Italiano de Buenos Aires, Ciudad Autónoma de Buenos Aires; Instituto de Neumonologia y Dermatologia, Hospital Alemán, Ciudad Autónoma de Buenos Aires; Psoriahue Medicina Interdisciplinaria, Ciudad Autónoma de Buenos Aires.
BrasilCentro Universitário Saúde ABC, Santo André, SP; Clínica de Alergía, Sorocaba, SP; Pontifícia Universidade Católica do Paraná, Curitiba, PR; Santa Casa de Misericordia de Porto Alegre, Porto Alegre, RS; University of Rio Grande do Sul ‐ Hospital de Clínicas de Porto Alegre, Porto Alegre, RS; University of São Paulo School of Medicine, São Paulo, SP.
MéxicoGA2LEN Atopic Dermatitis Center of Reference and Excellence, Secretaria de la Defensa Nacional, Ciudad de México; Grupo Clínico CATEI (Centro de Atención en Enfermedades Inflamatorias) Sociedad Civil, Guadalajara, Jal; Instituto Nacional de Ciencias Médicas y Nutrición Salvador Zubirán, Ciudad de México; NEKI Servicios Médicos, Vicente Guerreo, Toluca, Méx.
Conflito de interessesCatalina Rincón Pérez foi pesquisadora, palestrante e/ou consultora da AbbVie e palestrante e/ou consultora da Janssen, Leo, Lilly, Novartis, Pfizer e Sanofi Genzyme.
Valéria Aoki recebeu bolsas de pesquisa como pesquisadora da Lilly e Sanofi Laboratories (os fundos foram administrados por sua instituição) e atuou como consultora/palestrante da AbbVie, LEO Pharma e Pfizer.
Roberta F. Criado atuou como consultora e/ou palestrante da AbbVie, Mantecorp, Novartis e Sanofi.
Martti Antila atuou como palestrante/consultor da Abbott, AbbVie, Aché, AstraZeneca, Chiesi, Eurofarma, IPI ASAC e Sanofi e recebeu suporte de pesquisa da AbbVie, AstraZeneca, EMS, Eurofarma, GSK, Humanigen, Janssen, Novartis, Sanofi e Veru.
Maria Valeria Angles recebeu honorários ou pagamentos por atuar em conselhos consultivos, como palestrante e como consultora; bolsas como pesquisadora da AbbVie, L’Oréal, Pfizer, Raffo e Sanofi; e bolsas/suporte de pesquisa (pagos à instituição) ou participação em ensaios clínicos para a AbbVie e a Sanofi.
Tania Ferreira Cestari recebeu bolsas de pesquisa como pesquisadora da AbbVie (incluindo para o estudo MEASURE‐AD), Janssen Cilag, Lilly, Pfizer e Vichy Laboratories; os fundos foram administrados por sua instituição (Hospital de Clínicas de Porto Alegre).
Delfina Guadalupe Villanueva Quintero atuou como palestrante, consultora e pesquisadora principal para a AbbVie, Amgen, BI, BMS, Janssen, Lilly, Novartis, Sanofi e Teva.
Gabriel Magariños declara honorários de consultoria da AbbVie, BI, BMS, Janssen, Lilly, Novartis, Pfizer e Sanofi, e bolsas de pesquisa da AbbVie, BI, BMS, Janssen, Lilly, Merck, MSD, Novartis e Pfizer.
Carla Castro recebeu honorários de consultoria e/ou bolsas de pesquisa da AbbVie, Amgen, BI, Biogen, Galderma, Isdin, Janssen, Knight, Lilly, L’Oréal, Merck, Novartis, Pfizer e Sanofi.
Adriana López Tello‐Santillán atuou como palestrante, pesquisadora e consultora da AbbVie, Janssen, LEO, Lilly, Novartis, Pfizer e UCB.
Magda Weber foi pesquisadora, palestrante e/ou consultora da AbbVie e recebeu fundos da ISCMPA.
Daniel Lorenzini foi pesquisador, palestrante e/ou consultor da AbbVie, Galderma, LEO, Lilly, Pfizer e Sanofi‐Genzyme.
Caio Cesar Silva de Castro atuou como palestrante ou consultor da AbbVie, Aché, Janssen, Knight, LEO, Novartis, Sanofi e Sun Pharma.
Jorge Maspero foi pesquisador, recebeu bolsas ou honorários de palestrante ou foi consultor da AbbVie, AstraZeneca, GSK, Inmunotek, Menarini, MSD, Novartis, Sanofi‐Genzyme e Uriach.
Linda García‐Hidalgo atuou como palestrante e consultora da AbbVie, Eucerin, Janssen, Novartis, Novo Nordisk e Sanofi.
Limei Zhou, Shereen Hammad, Lucila de Campos, Tatiane Cristina Rodrigues e Carolina Arzelán são funcionárias assalariadas em tempo integral da AbbVie e podem ter ações ou opções de ações da AbbVie.
Paula C. Luna recebeu honorários ou pagamentos por atuar em conselhos consultivos, como palestrante ou consultora, e bolsas como pesquisadora da AbbVie, Amgen, BI, Lilly, Janssen, Pfizer, Novartis, Raffo e Sanofi. Atua como médica no Hospital Aleman, que recebe fundos de pesquisa da AbbVie, BI e Pfizer.
O suporte para redação médica foi fornecido por Maria Hovenden, PhD, e Janet E. Matsuura, PhD, da ICON (Blue Bell, PA) e foi financiado pela AbbVie.
Como citar este artigo: Pérez CR, Aoki V, Criado RF, Antila M, Angles MV, Cestari TF, et al. The real‐world burden of atopic dermatitis: MEASURE‐AD results from Brazil, Mexico, and Argentina. An Bras Dermatol. 2025;100.
Trabalho realizado em 14 locais na Argentina, Brasil e México.