O carcinoma de células escamosas ou espinocelular cutâneo (CECc) inclui CECc in situ (doença de Bowen [DB]) e CECc invasivo. Em contraste, o ceratoacantoma (KA) é um CECc bem diferenciado com tendência à autorresolução. A dermatoscopia auxilia na avaliação de alterações vasculares e do padrão de queratinização para diagnosticar e rastrear a invasão do CECc.
ObjetivosExaminar os achados dermatoscópicos do CECc de acordo com a diferenciação histopatológica e as características morfológicas clínicas.
MétodosImagens clínicas e dermatoscópicas de 118 CECc foram examinadas retrospectivamente.
ResultadosComparado a outros subtipos de CECc, a DB apresentou‐se mais frequentemente com pigmentação (p=0,028) e um padrão vascular aglomerado (p=0,042) ou serpiginoso (p=0,006). Tampões centrais de queratina foram mais comuns em CECcs invasivos bem diferenciados (p=0,021), enquanto círculos brancos ao redor dos folículos (p<0,001), ulceração/sangramento (p=0,001) e fundo vermelho (p=0,004) foram observados mais frequentemente em CECcs invasivos mal diferenciados. Tampões centrais de queratina (87,5%) e padrão vascular ramificado (75%) foram observados em pacientes com KA nodular, ambos estatisticamente mais frequentes do que em CECc invasivo (p<0,001, p=0,040, respectivamente). Halos brancos ao redor dos vasos (p=0,004) e padrão vascular aglomerado (p=0,037) foram mais comuns em CECc invasivos nodulares em comparação com KA nodular.
Limitações do estudoO número de lesões examinadas nos subgrupos foi relativamente pequeno.
ConclusõesA dermatoscopia auxilia na distinção entre CECcs invasivos bem diferenciados e CECcs invasivos mal diferenciados, na diferenciação entre KA nodular e CECc invasivo nodular e no diagnóstico da DB. Mais estudos são necessários para identificar achados dermatoscópicos que possam distinguir o CECc invasivo moderadamente diferenciado de outros CECcs invasivos.
O carcinoma de células escamosas ou espinocelular cutâneo (CECc) é responsável por 20% a 30% das neoplasias malignas de pele não melanoma.1 O CECc abrange um amplo espectro de lesões clínicas que variam em termos de atipia celular e displasia, desde lesões precursoras a CECc in situ e CECc invasivo.2 Há três subtipos principais de CECc: doença de Bowen (DB), ceratoacantoma (KA) e CECc invasivo.3
Os achados dermatoscópicos da DB (ou seja, CECc in situ) incluem um fundo rosa ou pigmentado acompanhado por vasos glomerulares aglomerados e vasos pontilhados, escamas branco‐amareladas e erosão.4 O KA compartilha características clínicas e histopatológicas comuns com o CECc bem diferenciado.5 O KA raramente se transforma em CECc invasivo e, portanto, seu diagnóstico preciso evita o tratamento excessivo.6
O CECc invasivo tem sinais dermatoscópicos específicos relacionados à sua diferenciação e profundidade de invasão.7 As estruturas dermatoscópicas vistas no CECc podem ser resumidas da seguinte maneira: 1) queratina, central ou não, 2) estruturas vasculares, 3) ulceração e 4) áreas brancas sem estrutura.8 À medida que o CECc invasivo se torna indiferenciado, as estruturas de queratina desaparecem, um padrão polimórfico de vasos lineares cobre a lesão e surge ulceração.9 A indiferenciação histopatológica é importante fator de risco na agressividade do CECc e no risco de recidiva.3,10 O diagnóstico diferencial precoce das variantes do CECc é especialmente importante, considerando o potencial metastático do CECc invasivo.11
O presente estudo teve como objetivo examinar os achados dermatoscópicos em casos de CECc invasivo com grau de diferenciação histopatológica variado, bem como comparar os achados dermatoscópicos de acordo com diferentes características morfológicas em pacientes com CECc e avaliar os achados dermatoscópicos de pacientes apresentando CECc invasivo nodular em comparação com aqueles de pacientes com KA. O objetivo também incluiu contribuir com a literatura revisando os achados dermatoscópicos da DB.
MétodosDeclaração de éticaO estudo foi aprovado pelo Comitê de Ética em Pesquisa Clínica Não Intervencionista da Faculdade de Medicina, Universidade Trakya (2023/479).
PacientesEste estudo transversal retrospectivo examinou os registros de 118 pacientes de janeiro de 2019 a julho de 2024 no ambulatório de doenças dermatológicas e venéreas da Trakya University. O estudo incluiu pacientes que tinham diagnóstico histopatológico de CECc invasivo, DB ou KA após excisão cirúrgica completa do tumor, que tinham fotografias macroscópicas e dermatoscópicas de alta qualidade e dados sociodemográficos e clínicos disponíveis.
As características sociodemográficas dos pacientes (idade, gênero, histórico de CEC, fototipo de Fitzpatrick), características clínicas (presença de múltiplas ceratoses actínicas, duração da lesão, localização da lesão em área exposta ao sol ou protegida)12 e diagnóstico histopatológico (CECc bem diferenciado, CECc moderadamente diferenciado, CECc pouco diferenciado, DB ou KA) foram registrados por um membro da equipe de pesquisa (M.Ü.). O mesmo pesquisador avaliou imagens macroscópicas para características morfológicas da lesão (pápula/placa eritematosa, pápula/placa hiperceratótica, nódulo hiperceratótico, tumor, pápula/placa ulcerada e nódulo ulcerado) e classificou as lesões como planas ou elevadas após avaliar suas características clínicas. Fotografias macroscópicas foram coletadas do arquivo de imagens da clínica. Pacientes que tinham CECc invasivo e KA com morfologia nodular foram avaliados em subgrupos separados. Como a ulceração é rara em KA, lesões nodulares ulceradas não foram avaliadas. A classificação histopatológica foi feita de acordo com os critérios diagnósticos definidos pela OMS em 2024 (N.C).13
DermatoscopiaAs imagens dermatoscópicas foram obtidas utilizando lentes 20× e um sistema de dermatoscopia com base na plataforma FotoFinder (FotoFinder Systems GmbH, Alemanha). Todas as imagens foram obtidas por dermatoscopia de contato com álcool gel ou gel de ultrassom em pacientes com lesões altamente elevadas. A avaliação das imagens dermatoscópicas foi realizada de maneira independente por dois pesquisadores (Y.G.Ü e Ö.F.E), ambos cegos para as informações clínicas e diagnósticos histopatológicos dos pacientes. As imagens dermatoscópicas foram recuperadas do banco de dados do sistema de videodermatoscopia digital da clínica.
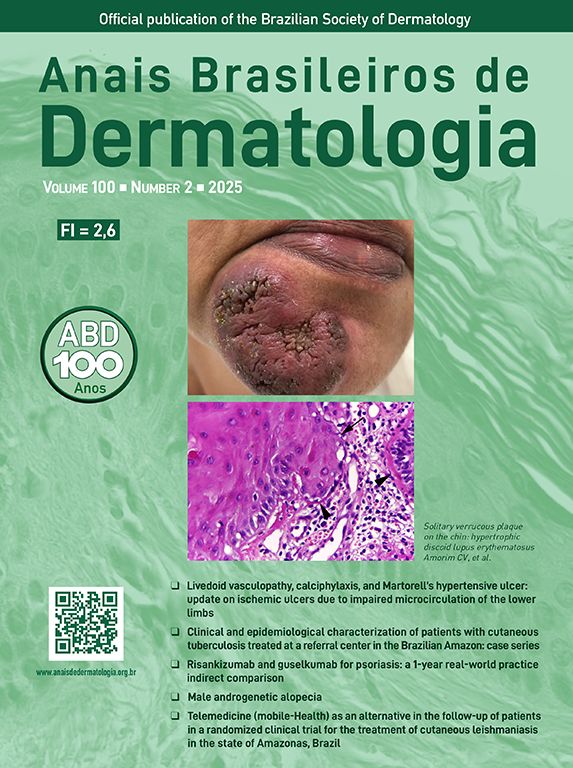
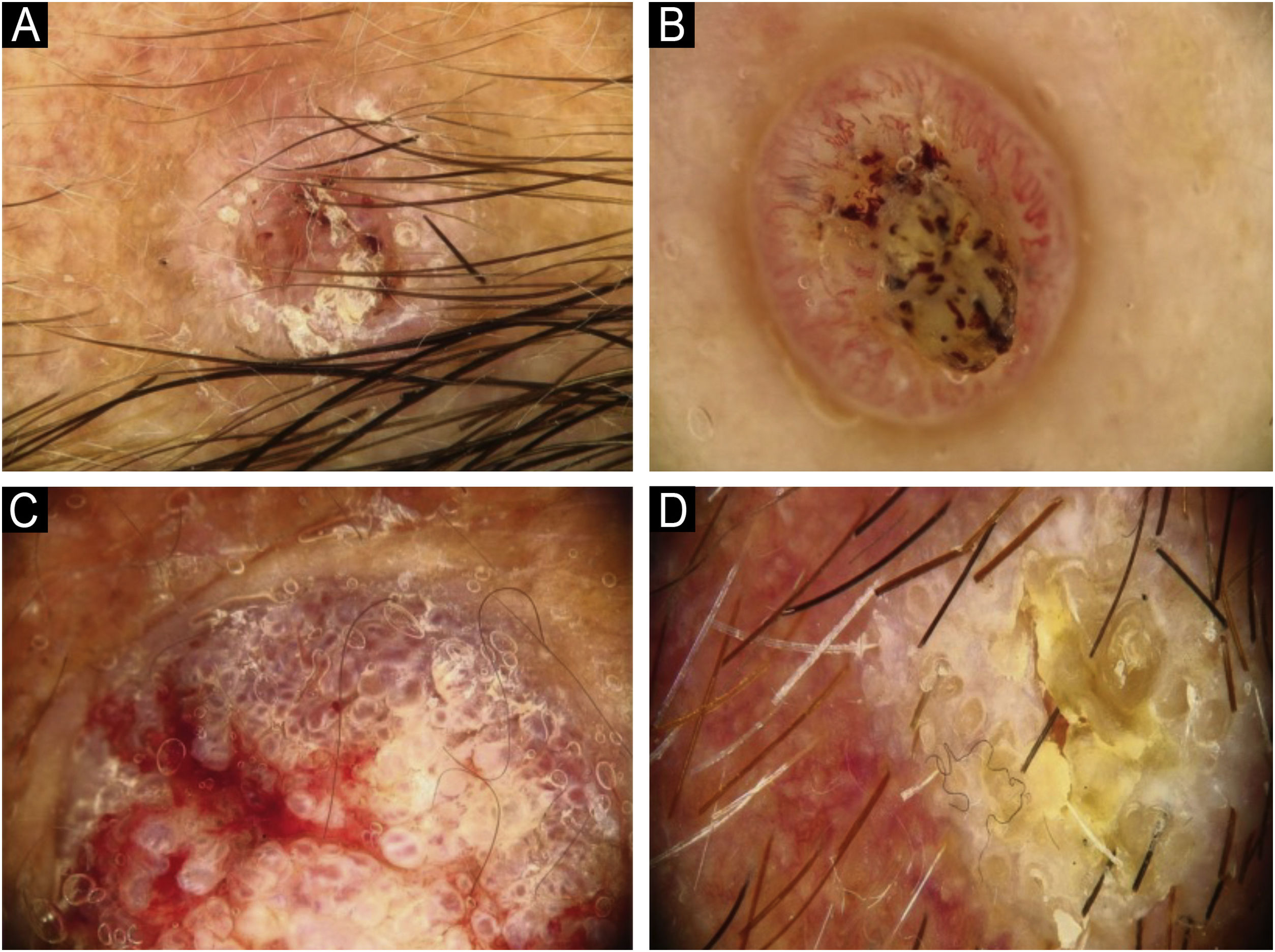
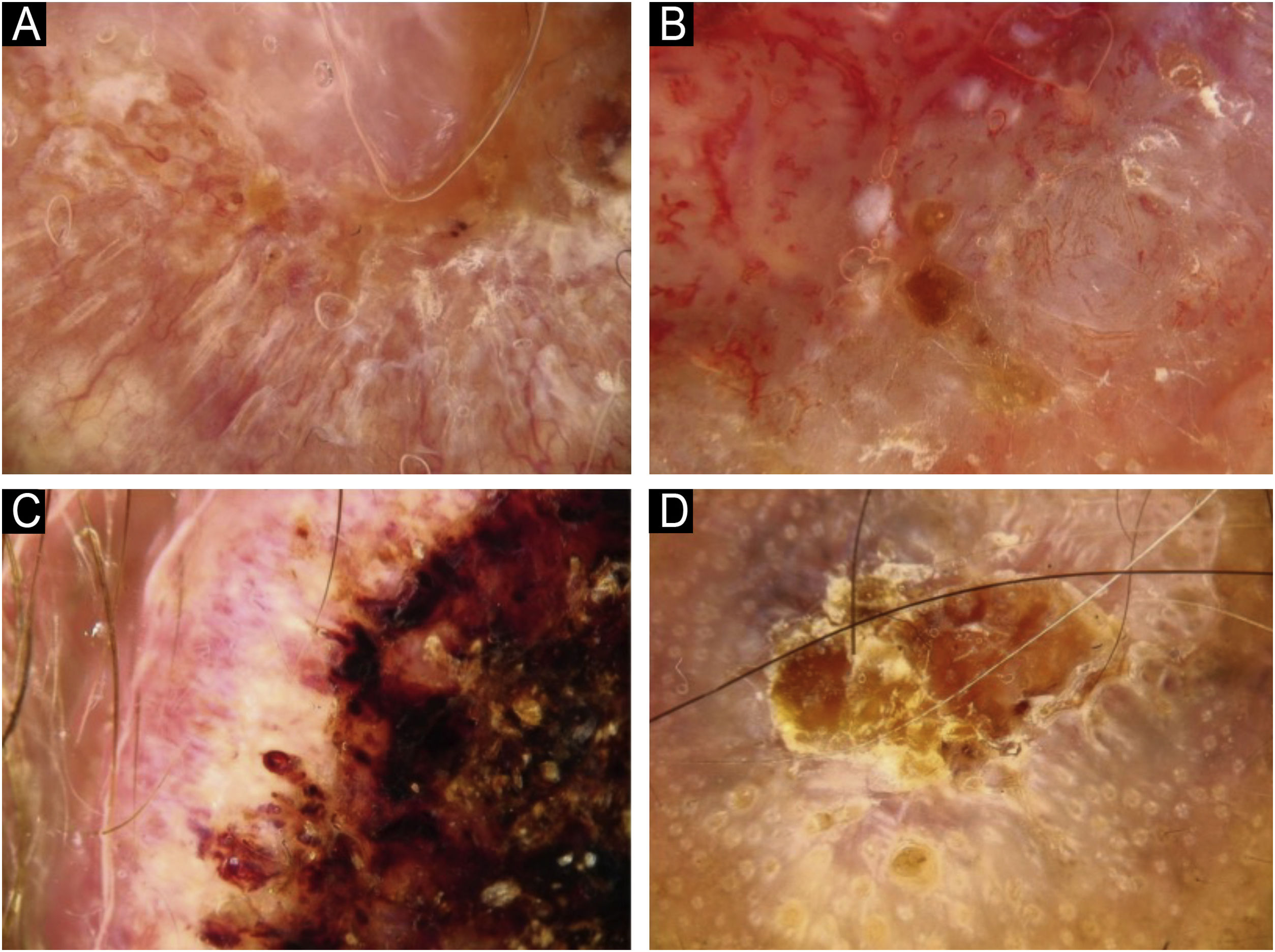
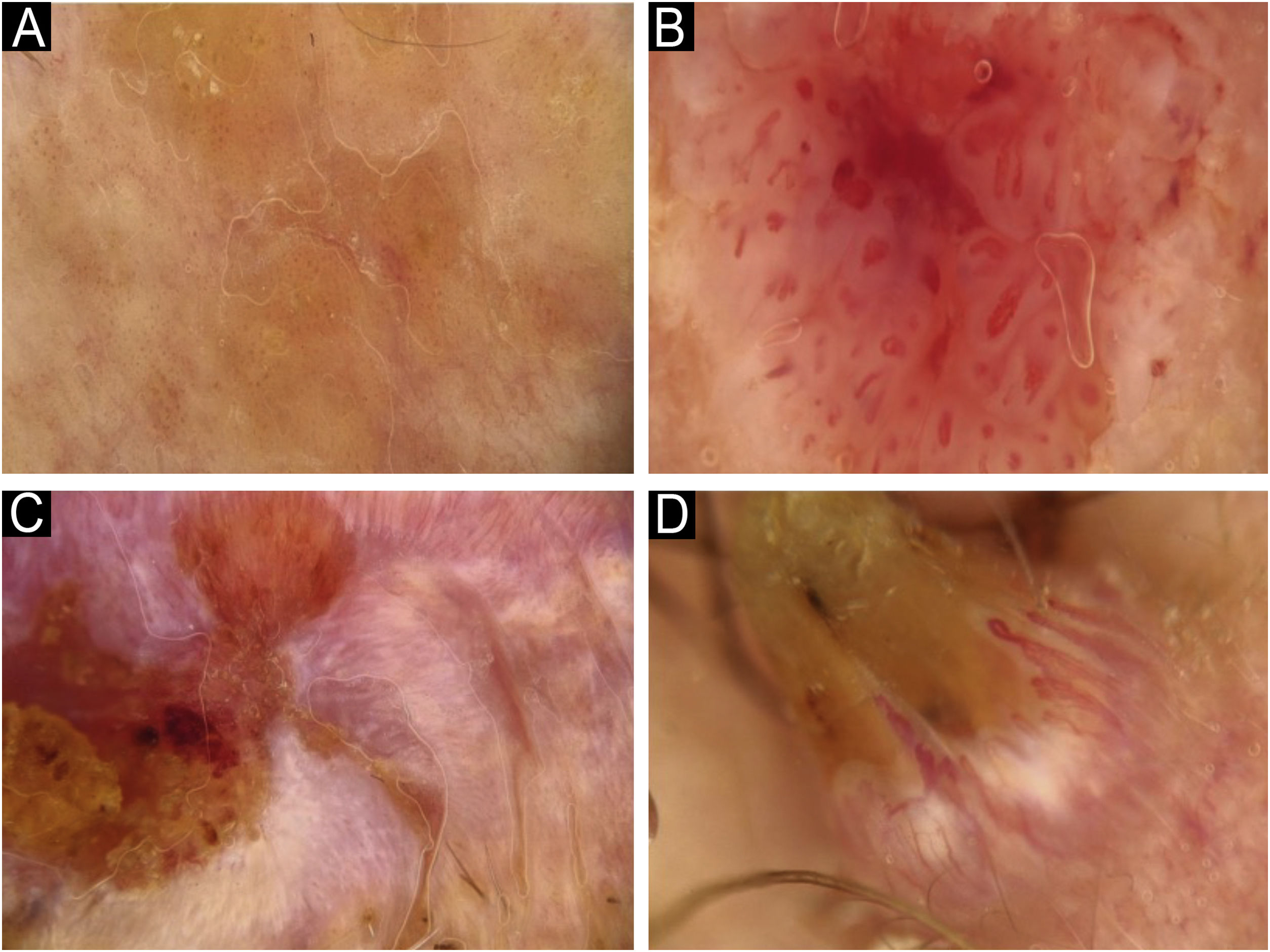
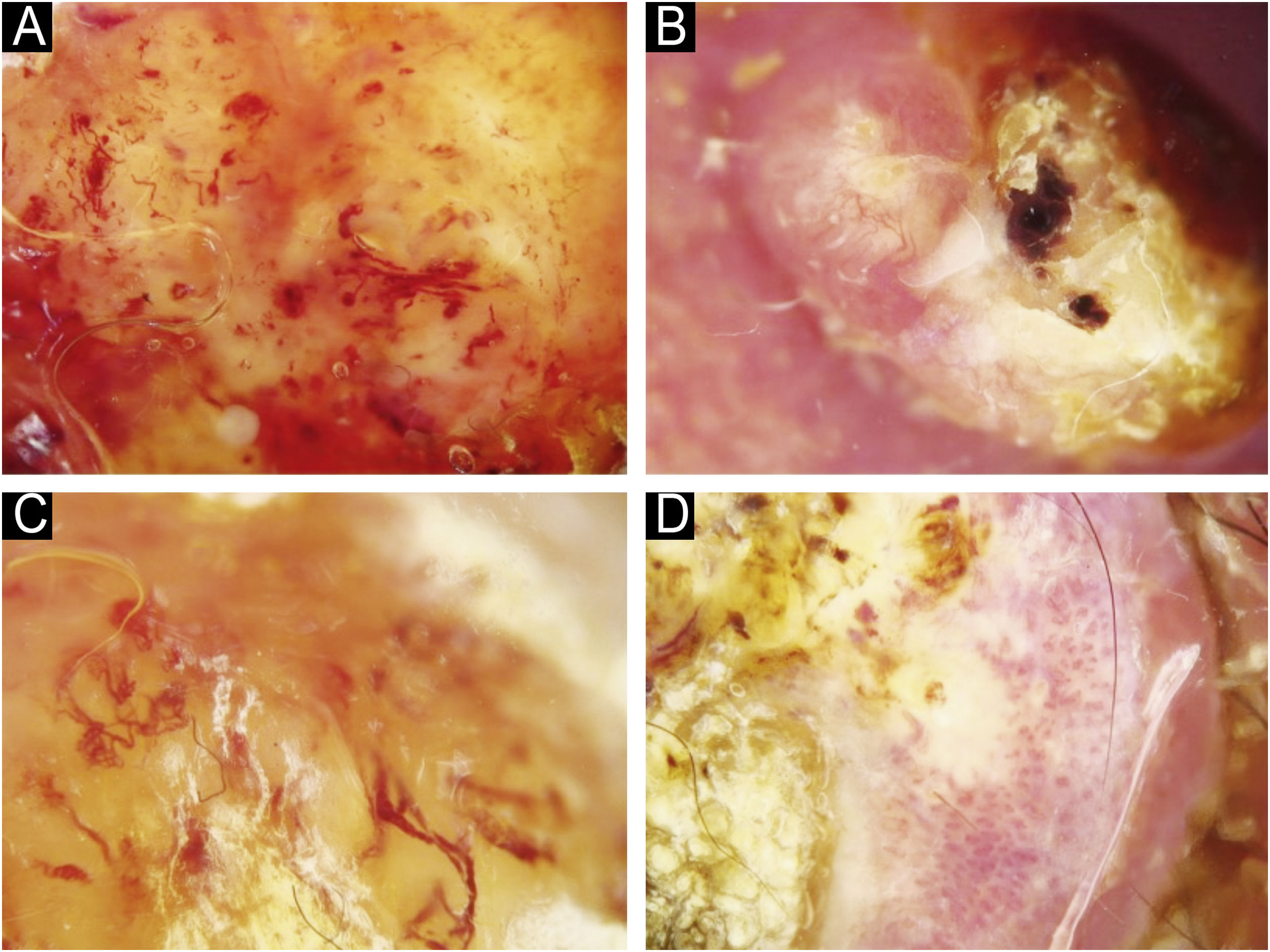
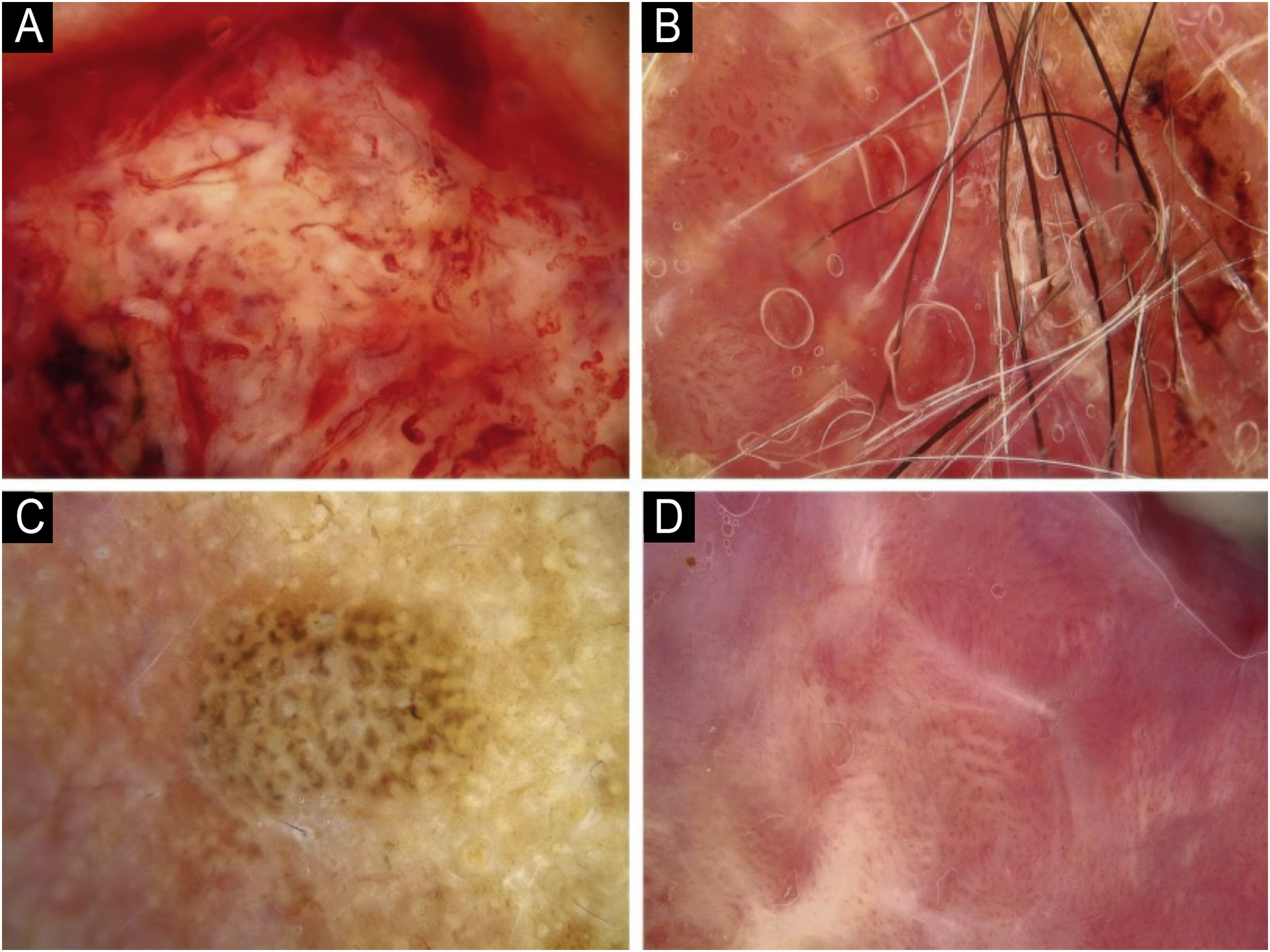
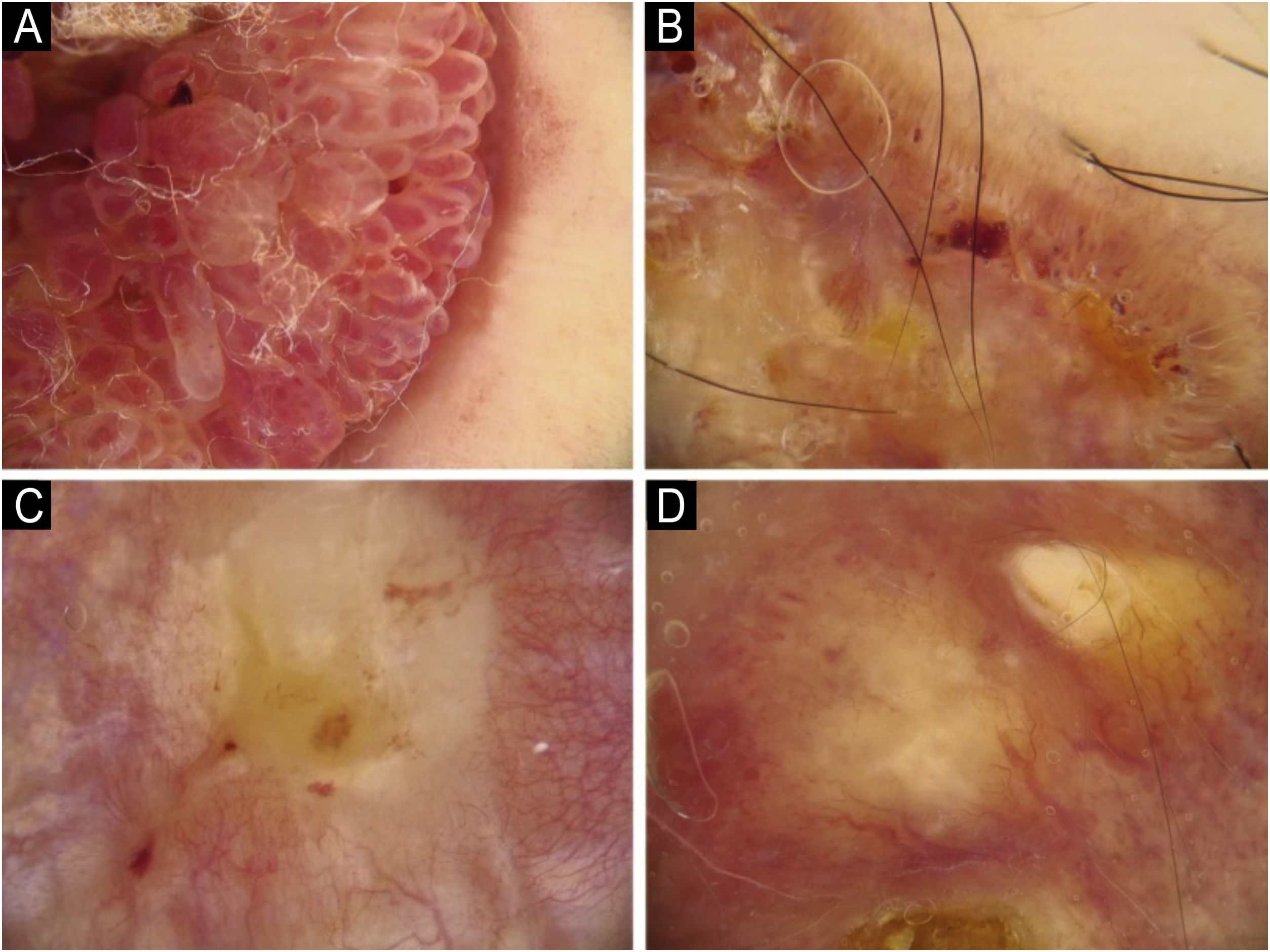
Utilizando os parâmetros especificados por Sgouros et al. e Rosendahl et al.,3,8 as imagens dermatoscópicas foram avaliadas sob os seguintes apectos principais: 1) características da queratinização (escamas, tampão central de queratina, halos brancos ao redor dos vasos, círculos brancos, massas brancas, linhas brancas, massas/pontos brancos, áreas brancas sem estrutura e rosetas; figs. 1 e 2); 2) solução de continuidade epidérmicas e dérmicas (ulceração/sangramento, erosão e pontos hemorrágicos); e 3) cor de fundo (branco, rosa, vermelho ou misto). Além disso, os vasos foram classificados em maior detalhe de acordo com 1) padrão vascular (monomorfo, polimorfo, sem padrão vascular claro); 2) estruturas vasculares (pontos, torrões, linhas; figs. 3 e 4); e 3) padrão vascular (aleatório, aglomerado, serpiginoso, linear, centralizado, radial, reticular, ramificado; figs. 5 e 6). As estruturas vasculares lineares foram avaliadas como retas, em alça, curvas, serpiginosas, helicoidais ou enoveladas (figs. 3 e 4).14 Os termos dermatoscópicos utilizados são baseados no estudo de Kittler et al.15
Os dados obtidos no estudo foram analisados usando o programa IBM SPSS Statistics versão 21. Frequência, porcentagem, média e desvio padrão foram usados como métodos estatísticos descritivos na análise de dados. A concordância dos achados dermatoscópicos identificados pelos dois médicos foi avaliada usando a estatística Kappa de Cohen. Os achados dermatoscópicos mostraram alta concordância intra‐avaliador e foram comparados com os achados histopatológicos usando os testes Qui‐quadrado e exato de Fisher. Valor de p<0,05 foi considerado estatisticamente significante.
ResultadosCaracterísticas demográficas e clínicas dos pacientesA média de idade dos pacientes foi de 69,05±11,92 anos, e a proporção masculinos:femininos foi de 2:1. A maioria das lesões estava localizada na região da cabeça e pescoço (n=102; 86,4%). Lesões múltiplas de ceratose actínica foram detectadas em 38,1% (n=45) dos pacientes no momento do diagnóstico. A classificação histopatológica foi CECc bem diferenciado em 50 pacientes (42,2%), CECc moderadamente diferenciado em 19 pacientes (16,1%), CECc pouco diferenciado em 16 pacientes (13,6%), DB em 10 pacientes (8,5%) e KA em 23 pacientes (19,5%; tabela 1).
Características demográficas, clínicas e diagnósticos histopatológicos de pacientes com carcinoma espinocelular cutâneo
| n=118 | |
|---|---|
| Idade (anos), média±DP (variação) | 69,05±11,92 (42–90) |
| Gênero, n (%) | |
| Masculino | 79 (66,9) |
| Feminino | 39 (33,1) |
| Duração da lesão (meses), média±DP (variação) | 14,78±29,53 (1–240) |
| História anterior de CEC, n (%) | 21 (17,8) |
| Ceratoses actínicas múltiplasa, n (%) | 45 (38,1) |
| Fototipo de Fitzpatrick, n (%) | |
| II | 49 (41,5) |
| III | 56 (47,5) |
| IV | 13 (11,0) |
| Localização, n (%) | |
| Cabeça e pescoço | 102 (86,4) |
| Membros superiores | 10 (8,5) |
| Tronco | 4 (3,4) |
| Membros inferiores | 2 (1,7) |
| Localização da lesão, n (%)b | |
| Exposta ao sol | 106 (89,8) |
| Protegida do sol | 12 (10,2) |
| Subtipo histopatológico, n (%) | |
| CECc bem diferenciado | 50 (42,4) |
| CECc moderadamente diferenciado | 19 (16,1) |
| CECc pouco diferenciado | 16 (13,6) |
| Doença de Bowen | 10 (8,5) |
| Ceratoacantoma | 23 (19,4) |
CECc, carcinoma espinocelular cutâneo.
Quando as características morfológicas determinadas pela análise da imagem clínica foram correlacionadas como o subtipo histopatológico, observou‐se que os CECcs bem diferenciados mais comumente se apresentavam como pápulas/placas hiperceratóticas (n=29; 58%), CECcs pouco diferenciados como pápulas/placas e nódulos ulcerados (n=6; 37,5%), DB como pápulas/placas eritematosas (n=8; 80%) e KA como nódulos hiperceratóticos (n=16; 69,5%; ver tabela suplementar 1).
Características dermatoscópicasHouve concordância completa entre as avaliações dos dois médicos para os parâmetros de pigmentação dermatoscópica, vasos ausentes, ulceração/sangramento, erosão, pontos hemorrágicos e fundo rosa (κ=1,000; p<0,001). Também houve alta concordância para todas as outras características dermatoscópicas (p<0,001 para todos os parâmetros, exceto padrão vascular linear, p=0,003; ver tabela suplementar 2).
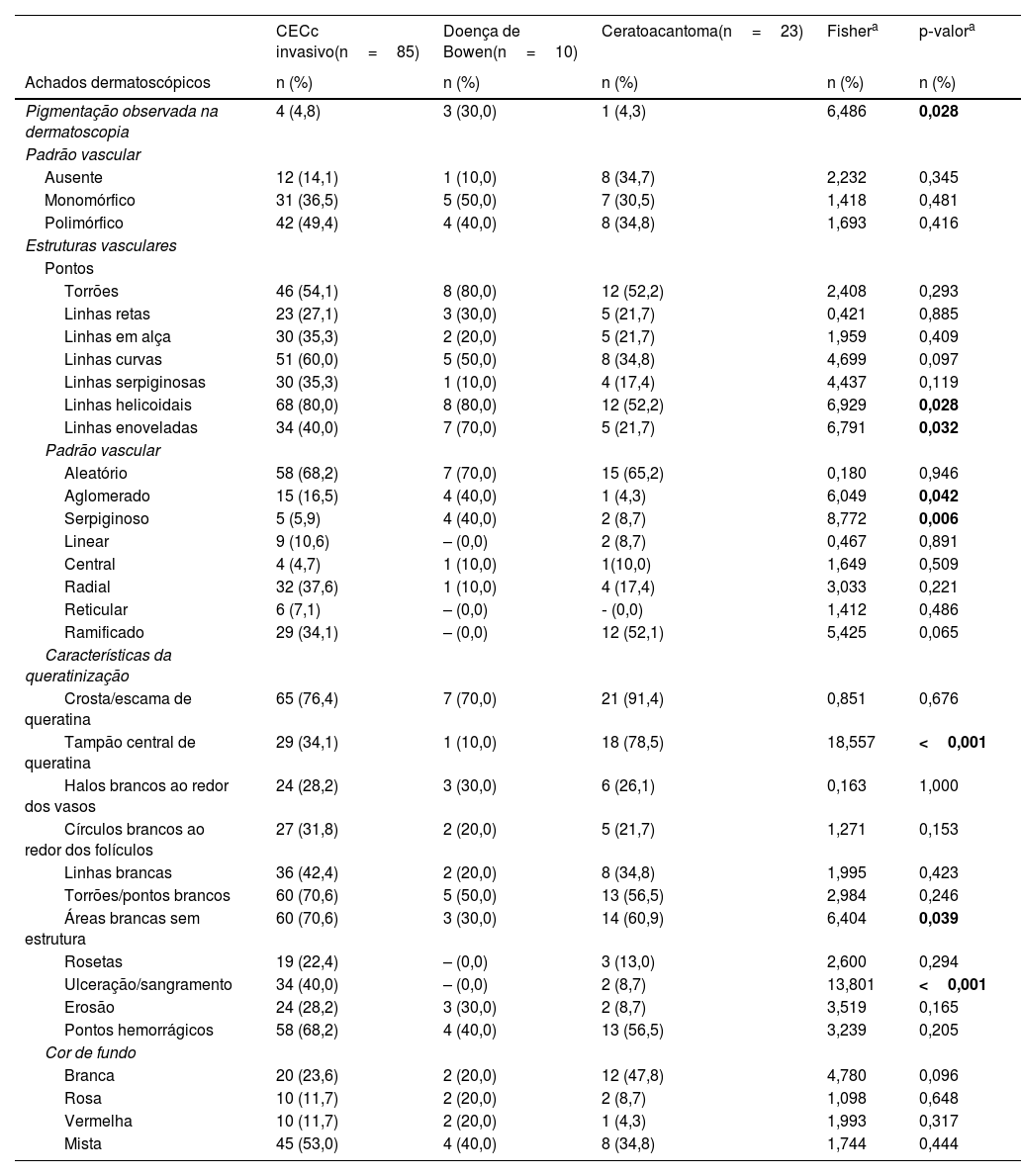
Os achados dermatoscópicos mais comuns no CECc incluíram crosta/escama de queratina (78,9%), estruturas vasculares lineares serpiginosas (74,5%), padrão vascular aleatório (67,7%), torrões/pontos brancos (66,1%), áreas brancas sem estrutura (65,2%) e pontos hemorrágicos (63,5%; tabela suplementar 3). A distribuição dos achados dermatoscópicos em CECc invasivo, DB e KA é mostrada na tabela 2. Pigmentação observada na dermatoscopia foi mais comum em pacientes com DB do que em pacientes com CECc invasivo e KA (p=0,028). Estruturas vasculares serpiginosas lineares foram detectadas com mais frequência em CECc invasivo e DB do que em KA (p=0,028). O padrão vascular linear enovelado foi mais comum em DB (p=0,032). Padrões vasculares aglomerados e serpiginosos também foram detectados com mais frequência em DB do que em CECc invasivo e KA (p=0,042 e p=0,006, respectivamente). O tampão central de queratina foi detectado com mais frequência em KA do que em CECc invasivo e DB (p<0,001). Áreas brancas sem estrutura foram menos comuns em pacientes com DB do que em pacientes com CECc invasivo e KA (p=0,039). O achado dermatoscópico de ulceração/sangramento foi mais comum em CECc invasivo, e não foi observado em nenhum paciente com DB (p<0,001).
Distribuição dos achados dermatoscópicos no carcinoma espinocelular cutâneo invasivo, doença de Bowen e ceratoacantoma
| CECc invasivo(n=85) | Doença de Bowen(n=10) | Ceratoacantoma(n=23) | Fishera | p‐valora | |
|---|---|---|---|---|---|
| Achados dermatoscópicos | n (%) | n (%) | n (%) | n (%) | n (%) |
| Pigmentação observada na dermatoscopia | 4 (4,8) | 3 (30,0) | 1 (4,3) | 6,486 | 0,028 |
| Padrão vascular | |||||
| Ausente | 12 (14,1) | 1 (10,0) | 8 (34,7) | 2,232 | 0,345 |
| Monomórfico | 31 (36,5) | 5 (50,0) | 7 (30,5) | 1,418 | 0,481 |
| Polimórfico | 42 (49,4) | 4 (40,0) | 8 (34,8) | 1,693 | 0,416 |
| Estruturas vasculares | |||||
| Pontos | |||||
| Torrões | 46 (54,1) | 8 (80,0) | 12 (52,2) | 2,408 | 0,293 |
| Linhas retas | 23 (27,1) | 3 (30,0) | 5 (21,7) | 0,421 | 0,885 |
| Linhas em alça | 30 (35,3) | 2 (20,0) | 5 (21,7) | 1,959 | 0,409 |
| Linhas curvas | 51 (60,0) | 5 (50,0) | 8 (34,8) | 4,699 | 0,097 |
| Linhas serpiginosas | 30 (35,3) | 1 (10,0) | 4 (17,4) | 4,437 | 0,119 |
| Linhas helicoidais | 68 (80,0) | 8 (80,0) | 12 (52,2) | 6,929 | 0,028 |
| Linhas enoveladas | 34 (40,0) | 7 (70,0) | 5 (21,7) | 6,791 | 0,032 |
| Padrão vascular | |||||
| Aleatório | 58 (68,2) | 7 (70,0) | 15 (65,2) | 0,180 | 0,946 |
| Aglomerado | 15 (16,5) | 4 (40,0) | 1 (4,3) | 6,049 | 0,042 |
| Serpiginoso | 5 (5,9) | 4 (40,0) | 2 (8,7) | 8,772 | 0,006 |
| Linear | 9 (10,6) | – (0,0) | 2 (8,7) | 0,467 | 0,891 |
| Central | 4 (4,7) | 1 (10,0) | 1(10,0) | 1,649 | 0,509 |
| Radial | 32 (37,6) | 1 (10,0) | 4 (17,4) | 3,033 | 0,221 |
| Reticular | 6 (7,1) | – (0,0) | ‐ (0,0) | 1,412 | 0,486 |
| Ramificado | 29 (34,1) | – (0,0) | 12 (52,1) | 5,425 | 0,065 |
| Características da queratinização | |||||
| Crosta/escama de queratina | 65 (76,4) | 7 (70,0) | 21 (91,4) | 0,851 | 0,676 |
| Tampão central de queratina | 29 (34,1) | 1 (10,0) | 18 (78,5) | 18,557 | <0,001 |
| Halos brancos ao redor dos vasos | 24 (28,2) | 3 (30,0) | 6 (26,1) | 0,163 | 1,000 |
| Círculos brancos ao redor dos folículos | 27 (31,8) | 2 (20,0) | 5 (21,7) | 1,271 | 0,153 |
| Linhas brancas | 36 (42,4) | 2 (20,0) | 8 (34,8) | 1,995 | 0,423 |
| Torrões/pontos brancos | 60 (70,6) | 5 (50,0) | 13 (56,5) | 2,984 | 0,246 |
| Áreas brancas sem estrutura | 60 (70,6) | 3 (30,0) | 14 (60,9) | 6,404 | 0,039 |
| Rosetas | 19 (22,4) | – (0,0) | 3 (13,0) | 2,600 | 0,294 |
| Ulceração/sangramento | 34 (40,0) | – (0,0) | 2 (8,7) | 13,801 | <0,001 |
| Erosão | 24 (28,2) | 3 (30,0) | 2 (8,7) | 3,519 | 0,165 |
| Pontos hemorrágicos | 58 (68,2) | 4 (40,0) | 13 (56,5) | 3,239 | 0,205 |
| Cor de fundo | |||||
| Branca | 20 (23,6) | 2 (20,0) | 12 (47,8) | 4,780 | 0,096 |
| Rosa | 10 (11,7) | 2 (20,0) | 2 (8,7) | 1,098 | 0,648 |
| Vermelha | 10 (11,7) | 2 (20,0) | 1 (4,3) | 1,993 | 0,317 |
| Mista | 45 (53,0) | 4 (40,0) | 8 (34,8) | 1,744 | 0,444 |
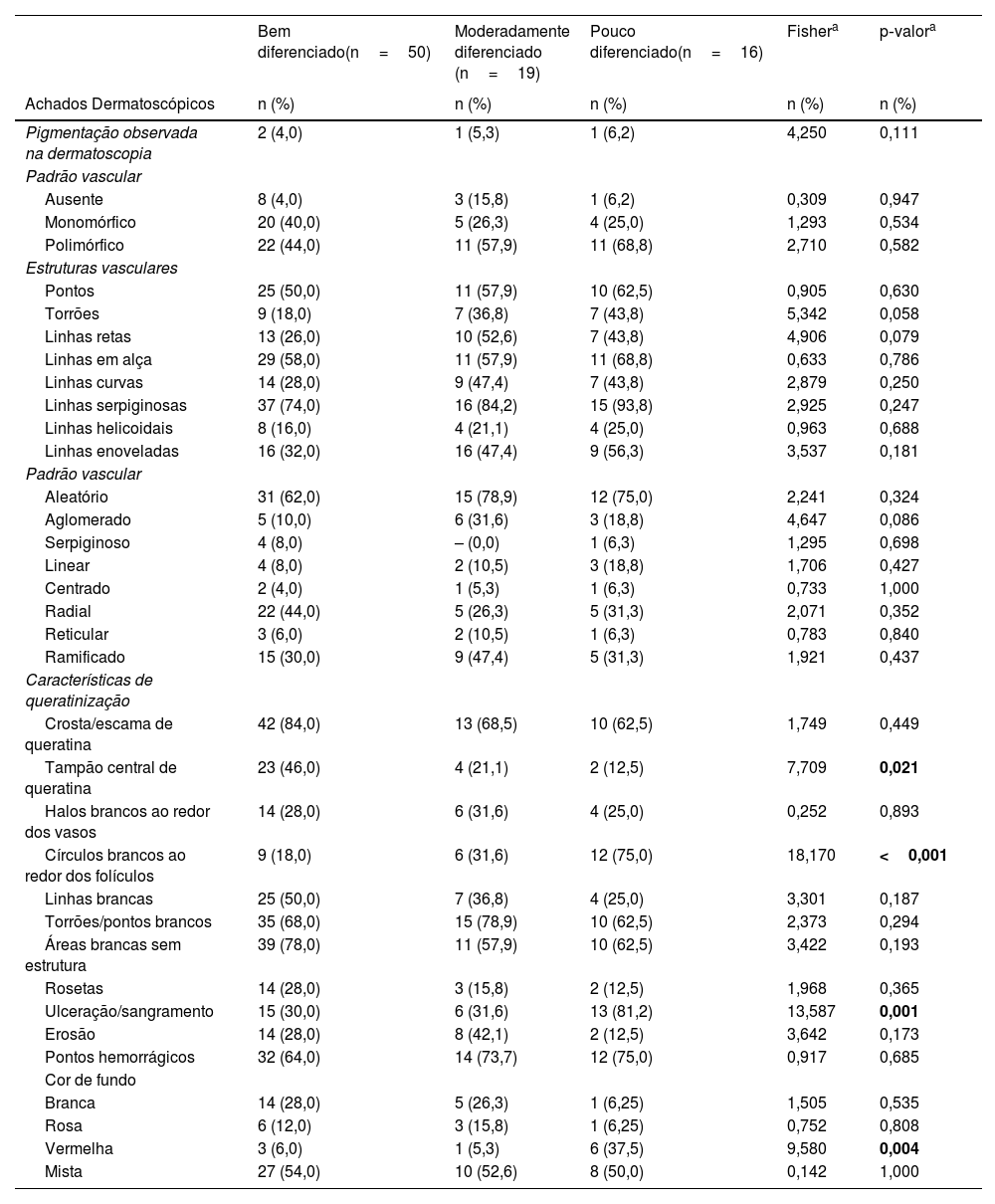
A comparação dos achados dermatoscópicos de acordo com a diferenciação histopatológica do CECc invasivo é mostrada na tabela 3. O tampão central de queratina foi mais comum em pacientes com CECcs bem diferenciados do que em pacientes com CECcs moderadamente e mal diferenciados (p=0,021). Círculos brancos ao redor dos folículos, ulceração/sangramento e fundo vermelho foram achados dermatoscópicos significantemente mais comuns em CECcs mal diferenciados do que em outros subtipos histopatológicos de CECc invasivo (p<0,001, p=0,001 e p=0,004, respectivamente).
Distribuição dos achados dermatoscópicos no carcinoma espinocelular cutâneo invasivo de acordo com a diferenciação histopatológica
| Bem diferenciado(n=50) | Moderadamente diferenciado (n=19) | Pouco diferenciado(n=16) | Fishera | p‐valora | |
|---|---|---|---|---|---|
| Achados Dermatoscópicos | n (%) | n (%) | n (%) | n (%) | n (%) |
| Pigmentação observada na dermatoscopia | 2 (4,0) | 1 (5,3) | 1 (6,2) | 4,250 | 0,111 |
| Padrão vascular | |||||
| Ausente | 8 (4,0) | 3 (15,8) | 1 (6,2) | 0,309 | 0,947 |
| Monomórfico | 20 (40,0) | 5 (26,3) | 4 (25,0) | 1,293 | 0,534 |
| Polimórfico | 22 (44,0) | 11 (57,9) | 11 (68,8) | 2,710 | 0,582 |
| Estruturas vasculares | |||||
| Pontos | 25 (50,0) | 11 (57,9) | 10 (62,5) | 0,905 | 0,630 |
| Torrões | 9 (18,0) | 7 (36,8) | 7 (43,8) | 5,342 | 0,058 |
| Linhas retas | 13 (26,0) | 10 (52,6) | 7 (43,8) | 4,906 | 0,079 |
| Linhas em alça | 29 (58,0) | 11 (57,9) | 11 (68,8) | 0,633 | 0,786 |
| Linhas curvas | 14 (28,0) | 9 (47,4) | 7 (43,8) | 2,879 | 0,250 |
| Linhas serpiginosas | 37 (74,0) | 16 (84,2) | 15 (93,8) | 2,925 | 0,247 |
| Linhas helicoidais | 8 (16,0) | 4 (21,1) | 4 (25,0) | 0,963 | 0,688 |
| Linhas enoveladas | 16 (32,0) | 16 (47,4) | 9 (56,3) | 3,537 | 0,181 |
| Padrão vascular | |||||
| Aleatório | 31 (62,0) | 15 (78,9) | 12 (75,0) | 2,241 | 0,324 |
| Aglomerado | 5 (10,0) | 6 (31,6) | 3 (18,8) | 4,647 | 0,086 |
| Serpiginoso | 4 (8,0) | – (0,0) | 1 (6,3) | 1,295 | 0,698 |
| Linear | 4 (8,0) | 2 (10,5) | 3 (18,8) | 1,706 | 0,427 |
| Centrado | 2 (4,0) | 1 (5,3) | 1 (6,3) | 0,733 | 1,000 |
| Radial | 22 (44,0) | 5 (26,3) | 5 (31,3) | 2,071 | 0,352 |
| Reticular | 3 (6,0) | 2 (10,5) | 1 (6,3) | 0,783 | 0,840 |
| Ramificado | 15 (30,0) | 9 (47,4) | 5 (31,3) | 1,921 | 0,437 |
| Características de queratinização | |||||
| Crosta/escama de queratina | 42 (84,0) | 13 (68,5) | 10 (62,5) | 1,749 | 0,449 |
| Tampão central de queratina | 23 (46,0) | 4 (21,1) | 2 (12,5) | 7,709 | 0,021 |
| Halos brancos ao redor dos vasos | 14 (28,0) | 6 (31,6) | 4 (25,0) | 0,252 | 0,893 |
| Círculos brancos ao redor dos folículos | 9 (18,0) | 6 (31,6) | 12 (75,0) | 18,170 | <0,001 |
| Linhas brancas | 25 (50,0) | 7 (36,8) | 4 (25,0) | 3,301 | 0,187 |
| Torrões/pontos brancos | 35 (68,0) | 15 (78,9) | 10 (62,5) | 2,373 | 0,294 |
| Áreas brancas sem estrutura | 39 (78,0) | 11 (57,9) | 10 (62,5) | 3,422 | 0,193 |
| Rosetas | 14 (28,0) | 3 (15,8) | 2 (12,5) | 1,968 | 0,365 |
| Ulceração/sangramento | 15 (30,0) | 6 (31,6) | 13 (81,2) | 13,587 | 0,001 |
| Erosão | 14 (28,0) | 8 (42,1) | 2 (12,5) | 3,642 | 0,173 |
| Pontos hemorrágicos | 32 (64,0) | 14 (73,7) | 12 (75,0) | 0,917 | 0,685 |
| Cor de fundo | |||||
| Branca | 14 (28,0) | 5 (26,3) | 1 (6,25) | 1,505 | 0,535 |
| Rosa | 6 (12,0) | 3 (15,8) | 1 (6,25) | 0,752 | 0,808 |
| Vermelha | 3 (6,0) | 1 (5,3) | 6 (37,5) | 9,580 | 0,004 |
| Mista | 27 (54,0) | 10 (52,6) | 8 (50,0) | 0,142 | 1,000 |
Com base em imagens macroscópicas e características clínicas, 20,3% das lesões eram planas. Quando as características dermatoscópicas foram comparadas entre lesões de CECc planas e elevadas, observou‐se que pigmentação observada na dermatoscopia e ulceração/sangramento eram proeminentes em lesões planas (p<0,001, p=0,004, respectivamente), enquanto o tampão central de queratina era mais comum em lesões elevadas (p<0,001; tabela suplementar 4).
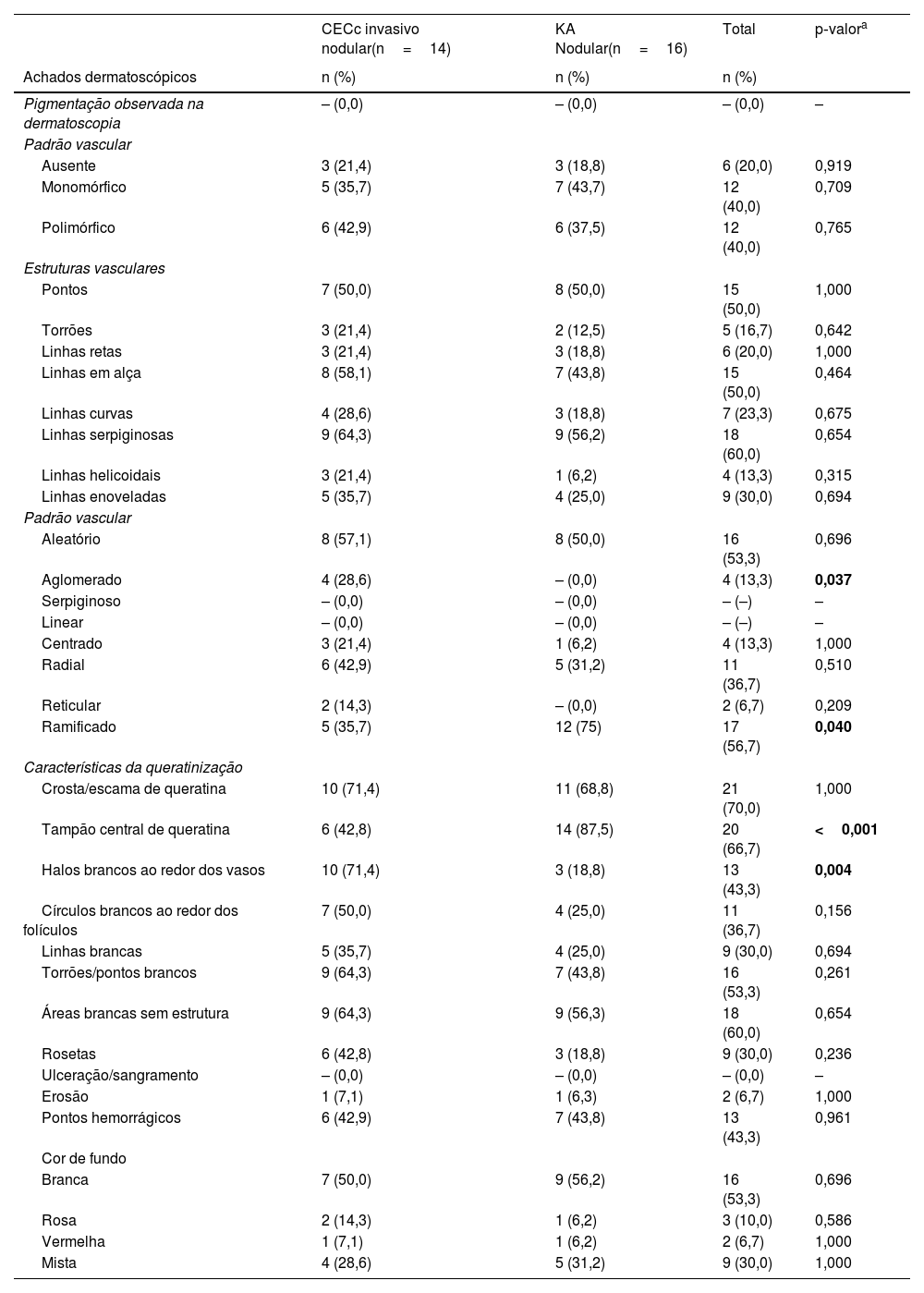
As características dermatoscópicas de 14 pacientes com CECc invasivo e 16 pacientes com KA com morfologia nodular são comparadas na tabela 4. Os achados dermatoscópicos mais comuns em lesões nodulares foram escamas (n=21, 70%), tampão central de queratina (n=20, 66,7%) e áreas brancas sem estrutura (n=18, 60%). Tampão central de queratina e padrão vascular ramificado foram observados em 87,5% e 75% dos pacientes com KA, o que foi estatisticamente mais frequente do que no CECc invasivo (p ≤ 0,001, p=0,040, respectivamente). Os achados dermatoscópicos de halo branco ao redor dos vasos e padrão vascular aglomerado foram estatisticamente mais comuns no CECc nodular invasivo em comparação com o KA nodular (p=0,004 e p=0,037, respectivamente).
Distribuição dos achados dermatoscópicos em pacientes com carcinoma espinocelular invasivo nodular e ceratoacantoma nodular
| CECc invasivo nodular(n=14) | KA Nodular(n=16) | Total | p‐valora | |
|---|---|---|---|---|
| Achados dermatoscópicos | n (%) | n (%) | n (%) | |
| Pigmentação observada na dermatoscopia | – (0,0) | – (0,0) | – (0,0) | – |
| Padrão vascular | ||||
| Ausente | 3 (21,4) | 3 (18,8) | 6 (20,0) | 0,919 |
| Monomórfico | 5 (35,7) | 7 (43,7) | 12 (40,0) | 0,709 |
| Polimórfico | 6 (42,9) | 6 (37,5) | 12 (40,0) | 0,765 |
| Estruturas vasculares | ||||
| Pontos | 7 (50,0) | 8 (50,0) | 15 (50,0) | 1,000 |
| Torrões | 3 (21,4) | 2 (12,5) | 5 (16,7) | 0,642 |
| Linhas retas | 3 (21,4) | 3 (18,8) | 6 (20,0) | 1,000 |
| Linhas em alça | 8 (58,1) | 7 (43,8) | 15 (50,0) | 0,464 |
| Linhas curvas | 4 (28,6) | 3 (18,8) | 7 (23,3) | 0,675 |
| Linhas serpiginosas | 9 (64,3) | 9 (56,2) | 18 (60,0) | 0,654 |
| Linhas helicoidais | 3 (21,4) | 1 (6,2) | 4 (13,3) | 0,315 |
| Linhas enoveladas | 5 (35,7) | 4 (25,0) | 9 (30,0) | 0,694 |
| Padrão vascular | ||||
| Aleatório | 8 (57,1) | 8 (50,0) | 16 (53,3) | 0,696 |
| Aglomerado | 4 (28,6) | – (0,0) | 4 (13,3) | 0,037 |
| Serpiginoso | – (0,0) | – (0,0) | – (–) | – |
| Linear | – (0,0) | – (0,0) | – (–) | – |
| Centrado | 3 (21,4) | 1 (6,2) | 4 (13,3) | 1,000 |
| Radial | 6 (42,9) | 5 (31,2) | 11 (36,7) | 0,510 |
| Reticular | 2 (14,3) | – (0,0) | 2 (6,7) | 0,209 |
| Ramificado | 5 (35,7) | 12 (75) | 17 (56,7) | 0,040 |
| Características da queratinização | ||||
| Crosta/escama de queratina | 10 (71,4) | 11 (68,8) | 21 (70,0) | 1,000 |
| Tampão central de queratina | 6 (42,8) | 14 (87,5) | 20 (66,7) | <0,001 |
| Halos brancos ao redor dos vasos | 10 (71,4) | 3 (18,8) | 13 (43,3) | 0,004 |
| Círculos brancos ao redor dos folículos | 7 (50,0) | 4 (25,0) | 11 (36,7) | 0,156 |
| Linhas brancas | 5 (35,7) | 4 (25,0) | 9 (30,0) | 0,694 |
| Torrões/pontos brancos | 9 (64,3) | 7 (43,8) | 16 (53,3) | 0,261 |
| Áreas brancas sem estrutura | 9 (64,3) | 9 (56,3) | 18 (60,0) | 0,654 |
| Rosetas | 6 (42,8) | 3 (18,8) | 9 (30,0) | 0,236 |
| Ulceração/sangramento | – (0,0) | – (0,0) | – (0,0) | – |
| Erosão | 1 (7,1) | 1 (6,3) | 2 (6,7) | 1,000 |
| Pontos hemorrágicos | 6 (42,9) | 7 (43,8) | 13 (43,3) | 0,961 |
| Cor de fundo | ||||
| Branca | 7 (50,0) | 9 (56,2) | 16 (53,3) | 0,696 |
| Rosa | 2 (14,3) | 1 (6,2) | 3 (10,0) | 0,586 |
| Vermelha | 1 (7,1) | 1 (6,2) | 2 (6,7) | 1,000 |
| Mista | 4 (28,6) | 5 (31,2) | 9 (30,0) | 1,000 |
CECc, carcinoma espinocelular cutâneo; KA, ceratoacantoma.
As características sociodemográficas e clínicas dos pacientes do presente estudo foram consistentes com estudos anteriores, indicando que a maioria dos pacientes com CECc são masculinos e idoso, e as lesões são mais comumente localizadas na região da cabeça e pescoço.16,17 A incidência de ceratose actínica aumenta com a idade, e esse aumento é maior na faixa etária de 70 anos.18 Ceratoses actínicas múltiplas são fatores de risco para o desenvolvimento de CECc invasivo.19 Foi relatado que o percentual de ceratoses actínicas múltiplas acompanhando CECc invasivo é de 11,5%.17 Essa taxa foi maior no presente estudo. Isso pode estar relacionado ao fato de a média de idade do presente estudo ser 69,05 anos e os pacientes serem monitorados regularmente para ceratose actínica e CECc.
Em diferentes estudos, a pigmentação observada na dermatoscopia em CECc é relatada como variando entre 0,01% e 25%.20 Sua prevalência foi maior (5,5%) em DB pigmentada.21 No presente estudo, essa taxa foi de 6,7% e foi mais comumente observada em DB. Ao avaliar os achados dermatoscópicos, deve‐se ter em mente que pigmentação é raramente vista em KA e CECc invasivo.
Os achados dermatoscópicos mais comuns no CECc são os vasos lineares irregulares.3,16 Se os vasos lineares tiverem mais de uma volta, são chamados de vasos serpiginosos.14,15 Vasos lineares irregulares são também denominados vasos serpiginosos.22,23 Em um estudo de Lallas et al., os achados dermatoscópicos de CECc invasivo incluíram vasos lineares irregulares radiais e pontilhados.16 Embora os estudos utilizem nomenclaturas dermatoscópicas diferentes, vasos serpiginosos e pontilhados na dermatoscopia devem ser valorizados para o diagnóstico de CECc, como indica a literatura.
Rosendahl et al. determinaram que o padrão vascular em KA e CECc invasivo era mais frequentemente aleatório, isto é, não específico.8 No presente estudo, distribuição semelhante foi observada em subtipos diferentes de DB. Vários estudos demonstraram que os vasos glomerulares e padrão vascular aglomerado são achados importantes no diagnóstico dermatoscópico de DB.3,9 Como resultado, vasos glomerulares e arranjo vascular aglomerado ajudam a diferenciar a DB de KA e CECc invasivo.
CECcs invasivos bem diferenciados mostram padrão de crescimento exofítico e apresentam estruturas brancas acompanhadas de escamas na dermatoscopia.16,23 Sgouros et al. detectaram o achado dermatoscópico de aberturas foliculares brancas com mais frequência em CECc invasivo bem diferenciado.3 Manfredini et al. relataram que o achado dermatoscópico de áreas brancas sem estrutura era mais comum em CECcs invasivos bem diferenciados.24 Em um estudo conduzido em 2024, foi determinado que achados dermatoscópicos como queratina agrupada centralmente, círculos brancos e halo perivascular esbranquiçado foram mais comumente observados em CECc invasivo bem diferenciado em comparação com CECc invasivo pouco diferenciado.25
Lallas et al. enfatizaram que aglomeração central de escamas ou queratina em imagens dermatoscópicas era fator preditivo negativo do diagnóstico de CECc invasivo pouco diferenciado.16 No presente estudo, achados dermatoscópicos do tampão central de queratina, crosta/escama de queratina e áreas brancas sem estrutura foram vistos com mais frequência em CECcs invasivos bem diferenciados.
O CECc pouco diferenciado apresenta‐se clinicamente como lesão plana e dermatoscopicamente de cor vermelha, frequentemente com estruturas vasculares anormais.16,24 Foi enfatizado que o achado dermatoscópico de vasos arboriformes é importante para o diagnóstico de CECcs invasivos pouco diferenciados. No presente estudo, os CECcs invasivos foram analisados em dois grupos: bem diferenciados e pouco diferenciados.25 Tanto o presente estudo quanto o estudo de Sgouros et al.3 analisaram o CECc invasivo dividido em três subtipos histopatológicos diferentes. Nenhuma diferença foi encontrada entre esses três subtipos histopatológicos diferentes em relação ao padrão vascular dermatoscópico. Entre os pacientes com CECc pouco diferenciado no presente estudo, ulceração foi detectada clinicamente em 75%, e ulceração/sangramento e fundo vermelho foram mais comuns dermatoscopicamente. Os autores acreditam que mais pesquisas são necessárias sobre esse assunto.
Na literatura, os achados dermatoscópicos de círculos brancos ao redor dos folículos e halos brancos ao redor dos vasos não são utilizados separadamente, mas chamados coletivamente de círculos brancos.16,22 Entretanto, Papageorgiou et al. examinaram esses dois achados dermatoscópicos separadamente e enfatizaram que os círculos brancos ao redor dos folículos apoiaram o diagnóstico de CECc invasivo pouco diferenciado.24 Os achados do presente estudo apoiam esse fato. No mesmo estudo, halos brancos ao redor dos vasos foram considerados importante achado dermatoscópico para CECc invasivo inicial. No presente estudo, halos brancos ao redor dos vasos foram mais frequentemente detectados em CECcs bem diferenciados e foram importantes na diferenciação entre CECc invasivo nodular e KA.
A presença de queratina na dermatoscopia tem alta sensibilidade na diferenciação entre diferentes tipos de câncer de pele não melanocítico, distinguindo CECc invasivo e KA de um lado e carcinoma basocelular cutâneo do outro.8 Entretanto, o valor preditivo positivo desse achado dermatoscópico diminui para 50% para diferenciar CECc e KA de DB. No presente estudo, os achados dermatoscópicos de queratinização, círculos brancos e áreas brancas sem estrutura foram menos comuns em pacientes com DB. Como no presente estudo e no estudo de Rosendahl et al., os achados dermatoscópicos de círculos brancos e áreas brancas sem estrutura foram favoráveis a CECc e KA na diferenciação com DB.8
Em seu estudo, Sgouros et al. enfatizaram que erosão foi vista na dermatoscopia principalmente em pacientes com DB, enquanto ulceração foi vista principalmente em pacientes com CECc invasivo.3 No presente estudo, não foram vistas ulcerações em nenhum dos pacientes com DB, enquanto erosão foi mais frequentemente detectada do que em CECc invasivo e KA. Quando avaliados em conjunto com a literatura, esses achados se destacam como importantes na diferenciação dermatoscópica de DB.
Os achados dermatoscópicos vistos em KA incluem fundo branco, tampão central de queratina e vasos lineares irregulares ou em grampo de cabelo.3,6 A literatura enfatiza a similaridade dos achados dermatoscópicos em KA e CECc invasivo.8,26 O achado dermatoscópico mais comum é crosta/escama de queratina, observada em 100% dos KAs e 90% dos CECcs invasivos.23 Os achados dermatoscópicos de crosta/escama de queratina e fundo branco foram mais comumente observados em KA no presente estudo, consistentes com a literatura. Entretanto, o tampão central de queratina foi visto mais significantemente em KA do que em outros subtipos. Como apoiado pelo presente estudo, o tampão central de queratina é importante no diagnóstico de KA.
A apresentação morfológica mais comum do KA é como lesão nodular com margens bem definidas e tampão hiperceratótico central.5 No presente estudo, 69,5% dos pacientes com KA apresentaram lesões nodulares. Lesões nodulares e ulceradas são vistas em CECc invasivo.3 A diferenciação dermatoscópica entre KA e CECc invasivo é importante em lesões com morfologia semelhante. Lin et al. argumentaram que o tampão central de queratina era importante para diferenciar KA de CECc nodular.23 Os achados do presente estudo também apoiam esse fato. O mesmo estudo relatou que estruturas vasculares glomerulares eram as estruturas vasculares mais comuns em CECc nodular, enquanto nenhuma diferença foi encontrada entre CECc e KA em relação a estruturas vasculares ou padrão vascular. No estudo de Pyne et al.,27 vasos ramificados foram considerados mais comuns em KA do que em cSCC invasivo. Nenhum comentário foi feito sobre a morfologias das lesões nesse estudo. Em nosso estudo, padrão vascular ramificado foi visto com mais frequência em pacientes com KA nodular. No diagnóstico dermatoscópico de KA nodular, a presença de tampão central de queratina e estruturas de padrão vascular ramificado devem ser valorizadas.
As limitações do presente estudo são seu desenho retrospectivo, o número relativamente pequeno de lesões examinadas nos subgrupos e a avaliação da morfologia clínica das lesões com base apenas em imagens clínicas, sem palpação.
ConclusõesNo presente estudo, achados dermatoscópicos específicos foram obtidos para o diagnóstico diferencial de DB e KA nodular. Entretanto, achados dermatoscópicos específicos não foram detectados para CECc invasivo moderadamente diferenciado.
A precisão dos critérios dermatoscópicos propostos não pode ser generalizada como resultado do presente estudo, mas ajudará os médicos nessa questão, em virtude do número limitado de estudos na literatura.
Suporte financeiroNenhum.
Contribuição dos autoresMustafa Ürün: Aprovação da versão final do manuscrito; concepção, desenho e planejamento do estudo; obtenção, análise e interpretação dos dados; elaboração e redação do manuscrito; revisão crítica da literatura e revisão crítica do manuscrito.
Yıldız Gürsel Ürün: Aprovação da versão final do manuscrito; concepção, desenho e planejamento do estudo; interpretação dos dados; revisão crítica do manuscrito.
Ömer Faruk Elmas: Aprovação da versão final do manuscrito; análise e interpretação dos dados; revisão crítica da literatura.
Nuray Can: Aprovação da versão final do manuscrito; análise e interpretação dos dados; elaboração e redação do manuscrito; revisão crítica da literatura.
Conflito de interessesNenhum.
Como citar este artigo: Ürün M, Ürün YG, Elmas ÖF, Can N. Evaluation of dermoscopic findings in patients with cutaneous squamous cell carcinoma according to histopathological subtype and lesion morphology. An Bras Dermatol. 2025;100. https://doi.org/10.1016/j.abd.2024.09.005
Trabalho realizado no Departamento de Dermatologia, University Hospital, Trakya University, Edirne, Turquia.