Estudos anteriores geralmente se concentravam em anormalidades no teste do olho seco e envolvimentos oculares, como uveíte e blefarite na psoríase. O escore do índice de área e gravidade da psoríase (PASI, do inglês psoriasis area severity index), usado para avaliar a gravidade da psoríase, é uma ferramenta complexa e demorada.
ObjetivoAvaliar a relação entre a gravidade da doença e a espessura epitelial corneana central (EECC) na psoríase.
MétodosForam incluídos neste estudo 175 olhos de 175 pacientes com psoríase e 57 olhos de 57 indivíduos saudáveis como grupo controle. Os pacientes com psoríase foram divididos em três subgrupos, de acordo com o escore PASI, em <10 leve, 10‐20 moderado e> 20 grave. A EECC foi medida por tomografia de coerência óptica de domínio espectral (SD‐OCT do inglês spectral domain‐optical coherence tomography), e os valores médios foram registrados. Os valores médios da EECC foram comparados entre os grupos de psoríase e o grupo controle. Além disso, foi avaliada a relação entre o escore PASI e a EECC.
ResultadosO valor médio da EECC foi de 58,06±3,1μm no grupo leve, 60,10±5,0μm no grupo moderado, 65,75±6,3μm no grupo grave e 56,16±3,1μm no grupo controle. Foi determinado que o valor médio da EECC foi significantemente maior em todos os grupos de psoríase em comparação com o grupo controle (p <0,001). O valor médio da EECC foi significantemente maior no grupo com psoríase moderada do que no grupo com psoríase leve (p=0,018) e no grupo com psoríase grave em comparação com o grupo com psoríase moderada (p <0,001). Houve forte correlação positiva entre o escore PASI e a EECC (p <0,001; r=0,519).
Limitações do estudoDesenho transversal e número relativamente pequeno de participantes.
ConclusõesHá forte correlação positiva entre a gravidade da psoríase e a EECC. A medida da EECC sem contato por SD‐OCT pode ser um indicador da gravidade da psoríase.
A psoríase é doença inflamatória cutânea crônica, com forte predisposição genética e características patogênicas autoimunes como hiperproliferação epidérmica e taxa de renovação relativamente alta do epitélio da camada basal.1
Em geral, a psoríase afeta a pele, mas também pode afetar as articulações e tem sido associada a várias doenças. A inflamação não se limita à pele psoriásica e demonstrou‐se afetar diferentes sistemas orgânicos. Quando comparados a indivíduos controle, os pacientes com psoríase apresentam aumento da hiperlipidemia, hipertensão, doença arterial coronariana, diabetes tipo 2 e aumento do índice de massa corporal.2
Além dessas doenças sistêmicas, o envolvimento ocular é comum, afetando 12% dos casos.3,4 Diminuição da acuidade visual corrigida, pterígio, catarata, blefarite, ceratite, hiperemia conjuntival e olho seco foram relatados como sendo comuns em pacientes com psoríase.5,6 Além disso, ceratite puntiforme e “derretimento da córnea” foram relatados na psoríase.7,8 Em processos inflamatórios que afetam a superfície ocular, a córnea e o epitélio conjuntival também são potencialmente afetados.9
O epitélio corneano é escamoso não queratinizado que desempenha papel muito importante na proteção do olho e na manutenção de alta qualidade óptica, pois é a camada mais externa.9‐11 Verificou‐se que o epitélio contribui isoladamente com 0,85 D na refração da córnea na zona de 3,6mm de diâmetro.12
A tomografia de coerência óptica de domínio espectral (SD‐OCT, do inglês spectral‐domain optical coherence tomography) é uma técnica sem contato que permite a mensuração da espessura epitelial corneana e avaliação precisa das camadas da córnea com grande confiabilidade e repetibilidade.13–15 A SD‐OCT é amplamente utilizada em clínicas oftalmológicas atualmente.
O escore do índice de área e gravidade da psoríase (PASI, do inglês psoriasis area and severity index) é um método objetivo que pontua a gravidade da psoríase. Para determinar o escore PASI, a área de superfície corporal afetada, eritema, infiltração e descamação são avaliados.16 Por isso, o escore PASI é uma ferramenta complexa e demorada.17
Sabe‐se que a literatura não contém estudos avaliando a relação entre a gravidade da psoríase e a espessura do epitélio corneano. No presente estudo, os autores investigam a espessura do epitélio corneano por SD‐OCT em pacientes com psoríase, classificados de acordo com o escore PASI, em comparação com indivíduos normais.
Material e métodosEste estudo transversal de caso controle foi realizado com a aprovação do Comitê de Ética em Pesquisa Médica da University of Istinye (registro de aprovação: 2/2021.K‐67) de acordo com os princípios éticos da Declaração de Helsinque. Formulários de consentimento por escrito foram recebidos de todos os participantes.
Um total de 175 olhos de 175 pacientes com psoríase e 57 olhos de 57 participantes saudáveis (grupo controle [GC]) foram incluídos neste estudo. Apenas os olhos direitos dos participantes foram incluídos no estudo. Todos os participantes foram submetidos a um exame ocular completo, incluindo o teste de Schirmer.18 Dados demográficos e exames dos segmentos anterior e posterior foram registrados em todos os casos.
O mesmo especialista (Aksoy B) calculou e registrou o escore PASI de cada paciente. Os pacientes com psoríase foram divididos em três subgrupos de acordo com o escore PASI: subgrupo leve (PASI <10), subgrupo moderado (PASI entre 10 e 20) e subgrupo grave (PASI> 20).19,20 O estudo excluiu indivíduos com história anterior de trauma ou cirurgia ocular, indivíduos com olho seco, doenças da córnea e conjuntiva ou doenças oculares ativas, indivíduos que usaram anteriormente medicações oculares tópicas de longa duração e indivíduos que utilizavam lentes de contato.
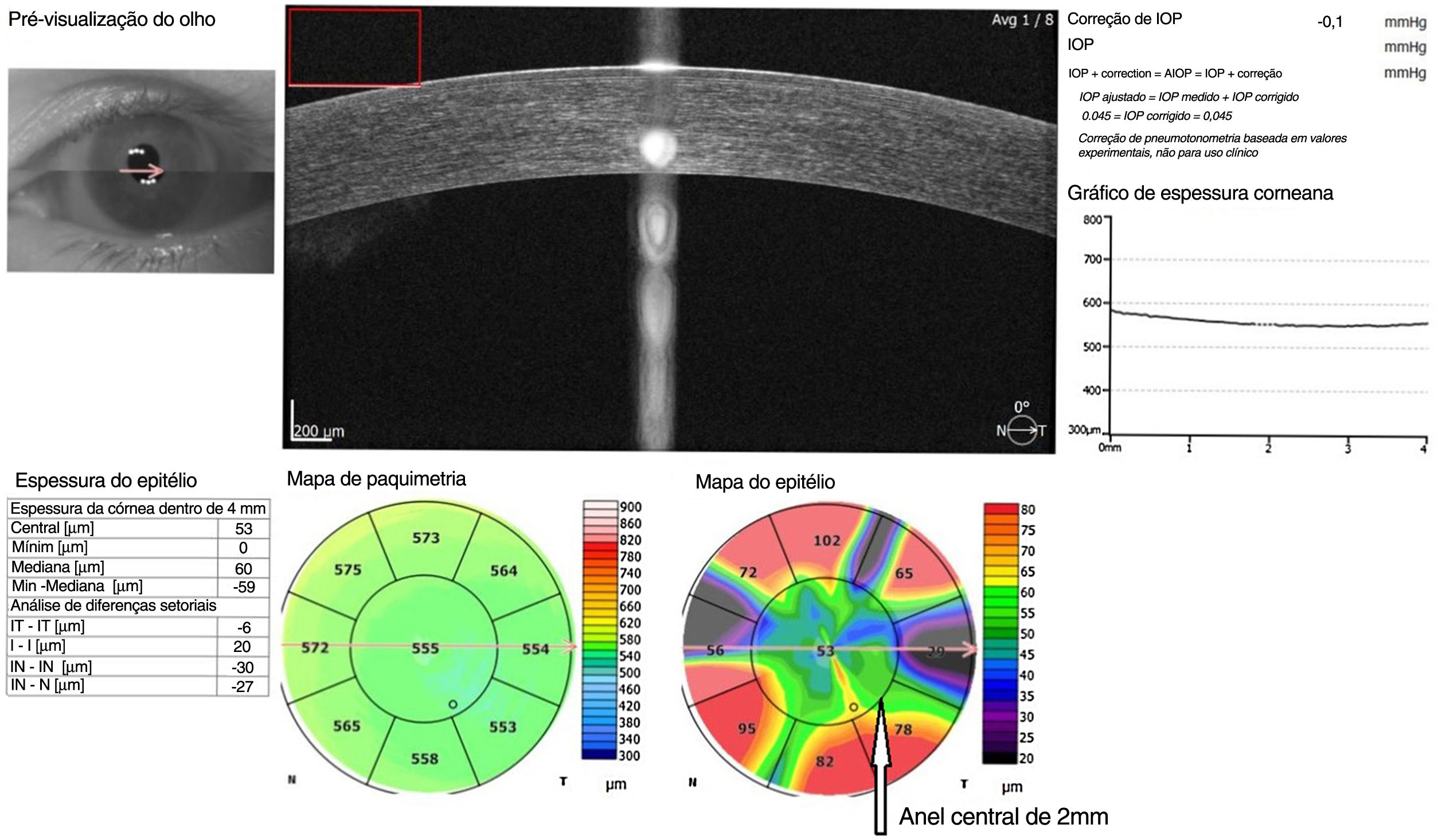
As medidas da espessura epitelial corneana central (EECC) foram realizadas pelo mesmo dispositivo SD‐OCT (Optopol Technology sp.zo. Zawiercie, Polônia). As medidas de OCT foram realizadas antes do exame oftalmológico para evitar possíveis artefatos. O mapeamento da espessura epitelial corneana dos pacientes foi obtido utilizando o modo de imagem da córnea do dispositivo SD‐OCT (fig. 1). Os valores da espessura do epitélio corneano foram examinados dentro de um círculo de 4mm de diâmetro. O valor da espessura epitelial da área central corneana de 2mm de diâmetro foi definido como a espessura epitelial corneana central (EECC).21
O mesmo especialista (Gunes IB) realizou todas as medidas. As medidas foram realizadas entre as 9h00 e as 11h00 para evitar os efeitos da variação diurna. Os valores médios da EECC nos grupos de psoríase leve, moderada e grave foram comparados com os do grupo controle. Os valores dos subgrupos de psoríase também foram comparados.
O software SPSS, versão 20.0 foi utilizado na análise estatística de todos os dados. Os testes de Kolmogorov–Smirnov e Shapiro‐Wilk examinaram a compatibilidade de dados numéricos e a distribuição normal. O teste U de Mann‐Whitney foi usado para dois grupos independentes, e o teste H de Kruskal‐Wallis foi usado para mais de dois grupos independentes que não apresentaram distribuição normal. Para detectar diferenças significantes entre mais de dois grupos independentes, foi utilizada uma das análises post‐hoc, o teste U de Mann‐Whitney com correção de Bonferroni. O teste de qui‐quadrado foi utilizado na análise das variáveis categóricas entre si. O coeficiente de Spearman foi utilizado nos testes de correlação. Os resultados foram analisados com intervalo de confiança de 95% e p‐valor <0,05 foi considerado estatisticamente significante.
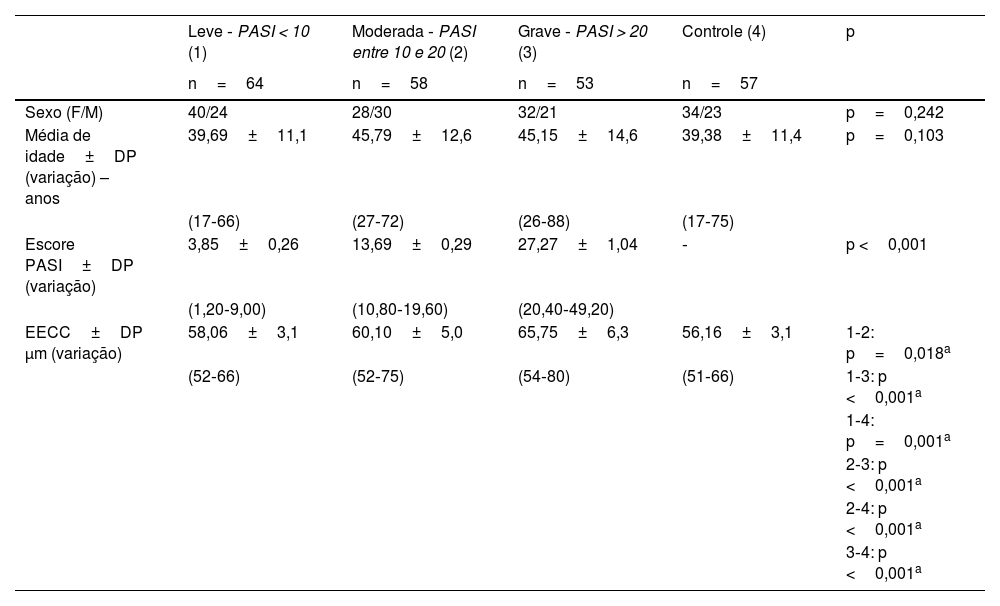
ResultadosO presente estudo incluiu 232 olhos de 232 participantes. A média de idade dos participantes foi de 43,60 (mín: 17, máx: 88), dos quais 57,8% eram do sexo feminino (n=134) e 42,2% do sexo masculino (n=98). Os pacientes foram divididos em três grupos, de acordo com o escore PASI. O grupo leve incluiu 64 olhos (27,6%), o grupo moderado incluiu 58 olhos (25,0%) e o grupo grave incluiu 53 olhos (22,8%). O grupo controle incluiu 57 olhos (24,6%). Não houve diferença significante na distribuição de idade e sexo entre os grupos do estudo (p=0,103 e p=0,242, respectivamente). A tabela 1 mostra os dados demográficos dos grupos de pacientes e do grupo controle.
Dados demográficos, valores de EECC e escore PASI dos grupos
| Leve ‐ PASI < 10 (1) | Moderada ‐ PASI entre 10 e 20 (2) | Grave ‐ PASI > 20 (3) | Controle (4) | p | |
|---|---|---|---|---|---|
| n=64 | n=58 | n=53 | n=57 | ||
| Sexo (F/M) | 40/24 | 28/30 | 32/21 | 34/23 | p=0,242 |
| Média de idade±DP (variação) – anos | 39,69±11,1 | 45,79±12,6 | 45,15±14,6 | 39,38±11,4 | p=0,103 |
| (17‐66) | (27‐72) | (26‐88) | (17‐75) | ||
| Escore PASI±DP (variação) | 3,85±0,26 | 13,69±0,29 | 27,27±1,04 | ‐ | p <0,001 |
| (1,20‐9,00) | (10,80‐19,60) | (20,40‐49,20) | |||
| EECC±DP μm (variação) | 58,06±3,1 | 60,10±5,0 | 65,75±6,3 | 56,16±3,1 | 1‐2: p=0,018a |
| (52‐66) | (52‐75) | (54‐80) | (51‐66) | 1‐3: p <0,001a | |
| 1‐4: p=0,001a | |||||
| 2‐3: p <0,001a | |||||
| 2‐4: p <0,001a | |||||
| 3‐4: p <0,001a |
DP, desvio‐padrão; n, número de casos; F/M, sexo feminino/masculino; PASI, psoriasis area severity index; EECC, espessura epitelial central corneana (μm).
A espessura epitelial corneana média foi de 58,06±3,1μm no grupo leve, 60,10±5,0μm no grupo moderado, 65,38±5,8μm no grupo grave e 56,16±3,1μm no grupo controle.
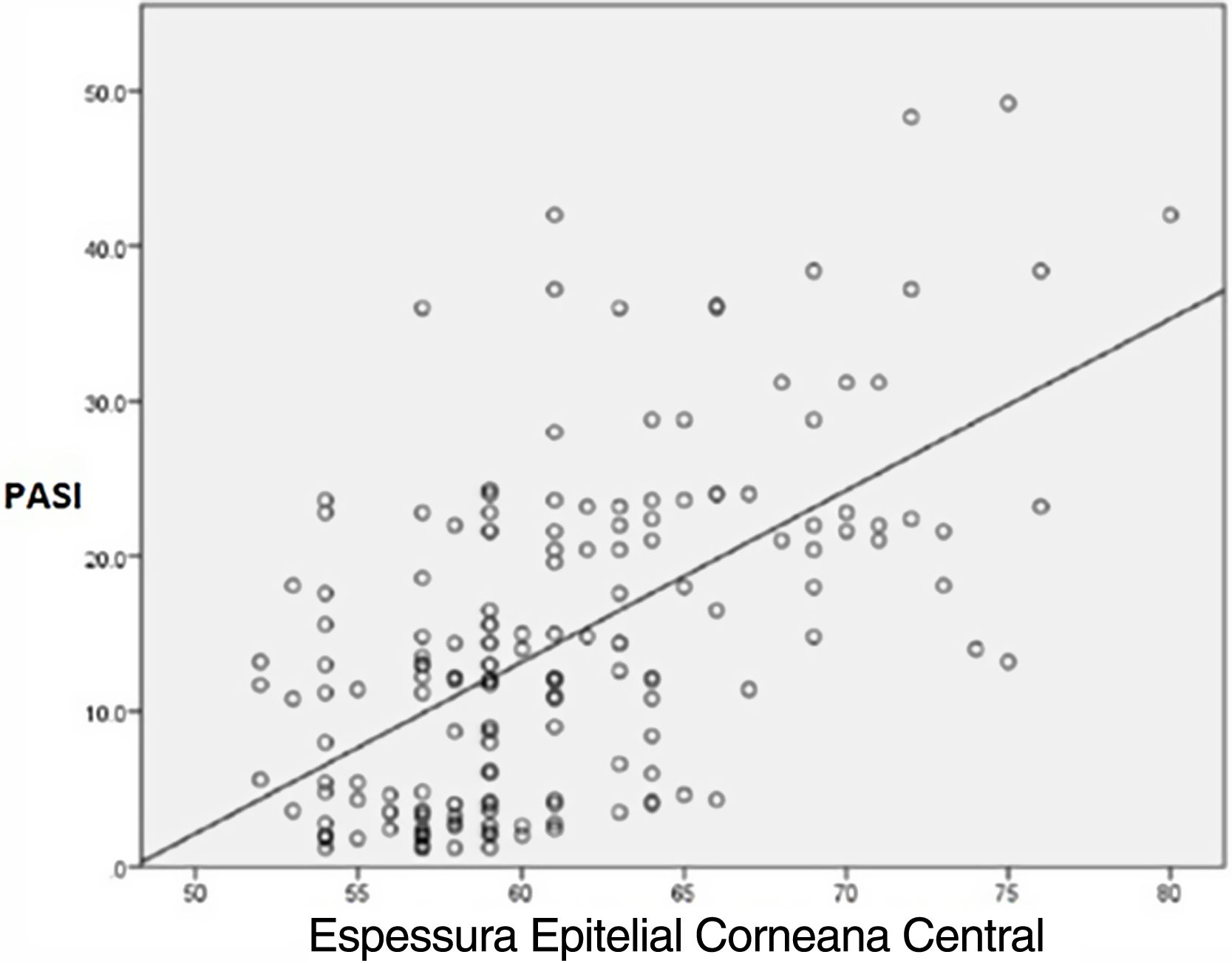
Os valores médios da EECC apresentaram diferença estatisticamente significante entre os grupos (p <0,001). A espessura epitelial corneana média no grupo controle foi significantemente menor do que em todos os grupos de psoríase (p <0,001). Na análise post hoc realizada entre os grupos de psoríase, o valor médio da EECC foi significantemente menor no grupo leve em comparação ao grupo moderado (p=0,018), e o valor médio da EECC foi significantemente menor nos grupos leve e moderado em relação ao grupo grave (p <0,001). Além disso, houve forte correlação positiva entre o escore PASI, que indica a gravidade da doença e a espessura epitelial corneana (p <0,001; r=0,519; fig. 2).
DiscussãoO presente estudo teve como objetivo avaliar a espessura epitelial corneana em pacientes com psoríase por meio da SD‐OCT. Estudos anteriores geralmente se concentravam em anormalidades no teste do olho seco e alterações oculares, como uveíte e blefarite na psoríase.4–7 Ao contrário de estudos anteriores, o presente estudo avalia a relação entre a espessura epitelial corneana e a gravidade da doença em pacientes com psoríase.
Diversos estudos mostraram que a medida da EECC utilizando a SD‐OCT, sem contato com o olho, é confiável e reprodutível.15,22,23 A EECC média foi avaliada em estudos anteriores, com a aplicação de citologia de imprint, microscopia confocal in vivo ou ultrassonografia.24–26 Diversos estudos utilizaram amplamente a SD‐OCT, beneficiando‐se não ser necessário contato, além da precisão, estabilidade e repetibilidade dos resultados.27,28
Ostadian et al. descobriram que o valor médio da EECC da população normal é de 56,64±2,82μm em medidas feitas por meio de SD‐OCT.29 Semelhante a esse estudo, a espessura epitelial corneana média foi de 56,16±3,1μm no grupo controle do presente estudo.
Kanellopoulos et al.30 relataram correlação positiva entre a espessura epitelial corneana e a idade. Samy et al. relataram que o valor da EECC diminui com a idade, mas não de acordo com o sexo.31 Não foram encontradas diferenças significantes na espessura epitelial corneana média de acordo com sexo e idade nos grupos de pacientes e no grupo controle.
Estudos anteriores descreveram o envolvimento da córnea na psoríase com ceratite pontilhada superficial, opacidades, erosões recorrentes, úlceras e cicatrizes.5–8 Além disso, Her et al.6 mostraram que o olho seco é comum em pacientes com psoríase e que o filme lacrimal nesses pacientes é relativamente instável em virtude dos danos na superfície ocular. O mecanismo etiopatogênico da psoríase que afeta a superfície ocular ainda não foi esclarecido. Neste estudo, espessamento epitelial corneano foi observado em pacientes com psoríase sem comprometimento ocular por placas psoriásicas. O envolvimento ocular na psoríase sem placa psoriásica pode ser o resultado do fenótipo psoriásico, que pode induzir processos inflamatórios imunomediados em outros órgãos além da pele.32
O escore PASI é um método objetivo que mostra a gravidade da psoríase. Para determinar o escore PASI, são avaliados a área de superfície corporal afetada, eritema, endurecimento e descamação.16
O presente estudo dividiu os pacientes com psoríase em três grupos, de acordo com os escores PASI, em leve, moderado e grave. Ao comparar a espessura epitelial corneana média dos grupos de pacientes e do grupo controle, observou‐se que a espessura epitelial corneana era significativamente maior nos grupos de pacientes leves, moderados e graves em comparação ao grupo controle. Quando os grupos de pacientes foram avaliados entre si, a espessura epitelial corneana média dos grupos moderado e grave foi significantemente maior do que no grupo leve. Além disso, uma forte correlação positiva foi observada entre a gravidade da doença e a espessura epitelial corneana (p <0,001; r=0,519).
Um estudo sobre a serina‐protease semelhante à tripsina, marapsina, enfatiza que a expressão da marapsina é encontrada apenas no tipo não queratinizado do epitélio escamoso em humanos, como esôfago, tonsila, laringe, colo do útero e córnea.33 Esses epitélios que expressam marapsina são todos relativamente espessos, têm taxa de renovação relativamente alta e não são queratinizados. Além disso, a marapsina não é expressa no epitélio queratinizado, mas é fortemente induzida quando a epiderme sofre hiperplasia e hiperproliferação, como durante a reepitelização de feridas e na psoríase. A expressão da marapsina está associada à diferenciação escamosa de queratinócitos, seja constitutivamente em epitélios não queratinizados ou sob condições de hiperproliferação e hiperplasia no epitélio queratinizado da epiderme. Foi demonstrado que a marapsina é fortemente regulada positivamente na epiderme hiperplásica e hiperproliferativa na psoríase.33 Mais recentemente, Adachi et al.34 identificaram marapsina na córnea de ratos, o que está de acordo com estudo anterior de Wong et al.,35 mostrando forte expressão de mRNA da marapsina no olho de camundongos. Em condições normais, o ciclo celular epidérmico é concluído em cerca de quatro semanas. Na psoríase, no entanto, o ciclo celular epidérmico é acelerado. A divisão celular na camada basal ocorre a cada 1,5 dias, e a migração dos queratinócitos para o estrato córneo ocorre em aproximadamente quatro dias. Isso resulta na hiperproliferação de queratinócitos.36 Além disso, Aragona et al.37 mostraram que metaplasia escamosa estava presente na citologia por imprint da superfície ocular em pacientes com psoríase sem envolvimento ocular.
O presente estudo encontrou espessamento epitelial corneano associado a psoríase sem envolvimento ocular. Embora o envolvimento da superfície ocular esteja ausente, os autores acreditam que o aumento da expressão de marapsina e a metaplasia escamosa no olho de pacientes com psoríase podem causar hiperproliferação e espessamento epitelial corneano em virtude do aumento da taxa de renovação epitelial.
As limitações do presente estudo são as seguintes: este é um estudo transversal, inclui número relativamente pequeno de participantes e não consegue avaliar os pacientes segundo o tempo de diagnóstico.
ConclusãoO presente estudo mediu a espessura epitelial corneana utilizando SD‐OCT sem contato e demonstrou correlação positiva entre a gravidade da psoríase e a EECC. Os autores acreditam que a EECC pode ser um dos indicadores de gravidade da doença em pacientes com psoríase e acreditam que os achados do presente estudo serão confirmados por estudos prospectivos que incluam um grande número de participantes no futuro.
Suporte financeiroNenhum.
Contribuição dos autoresİrfan Botan Güneş: Preparação de material, obtenção e análise dos dados; primeira versão do manuscrito; comentários sobre versões anteriores do manuscrito; aprovação da versão final do manuscrito.
Hakan Öztürk: Preparação de material, obtenção e análise dos dados; comentários sobre versões anteriores do manuscrito; aprovação da versão final do manuscrito.
Fuat Yavrum: Preparação de material, obtenção e análise dos dados; comentários sobre versões anteriores do manuscrito; aprovação da versão final do manuscrito.
Bediz Özen: Preparação de material, obtenção e análise dos dados; comentários sobre versões anteriores do manuscrito; aprovação da versão final do manuscrito.
Bern Aksoy: Preparação de material, obtenção e análise dos dados; comentários sobre versões anteriores do manuscrito; aprovação da versão final do manuscrito.
Conflito de interessesNenhum.
Como citar este artigo: Güneş IB, Aksoy B, Öztürk H, Yavrum F, Özen B. Does corneal epithelial thickness show the severity of psoriasis? SD‐OCT study. An Bras Dermatol. 2023;98:781–6.
Trabalho realizado nos Departamentos de Dermatologia e Oftalmologia, VMI Medical Park Hospital Kocaeli, Kocaeli, Turquia.