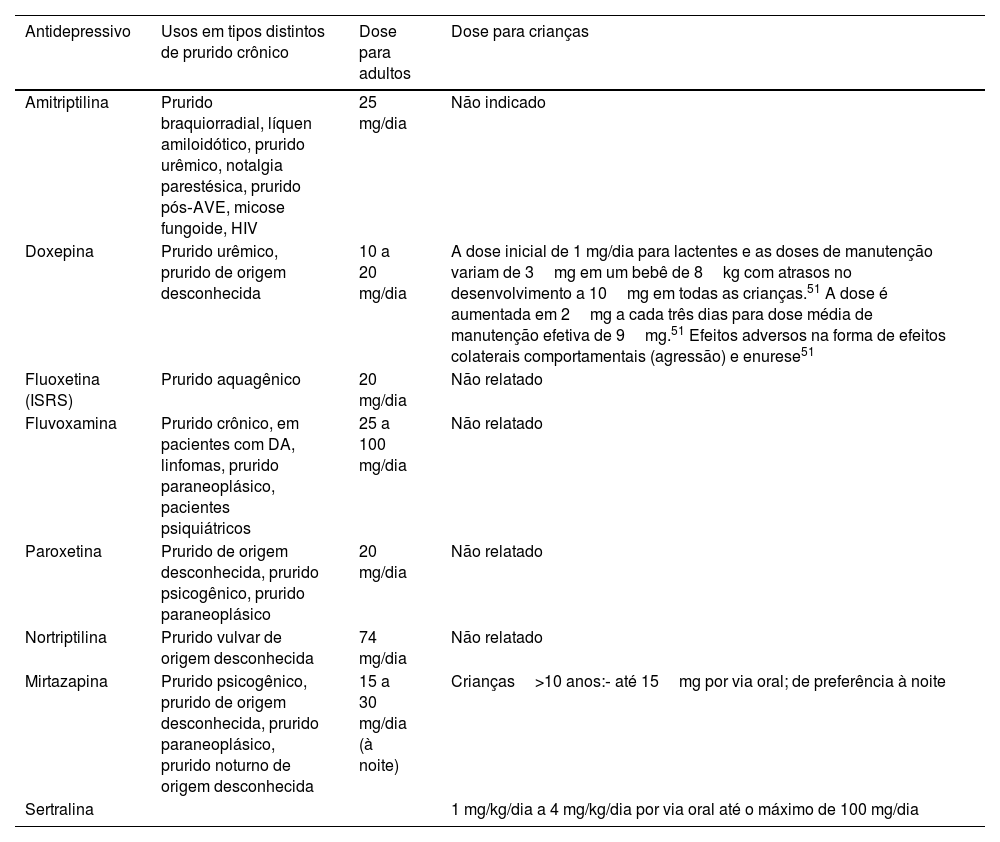
O prurido crônico abrange a manifestação de várias condições cutâneas, alérgicas, infecciosas, neurológicas, psicológicas e sistêmicas, cuja investigação etiológica e estratégia terapêutica podem ser desafiadoras. Esta revisão abrangente visa melhorar a compreensão do prurido, destacando elementos importantes em sua patogênese, incluindo queratinócitos, células de Merkel e mastócitos, fibras nervosas, vias histaminérgicas e não histaminérgicas e a interação de sinais de prurido com o sistema nervoso central. A avaliação diagnóstica do prurido crônico pode exigir abordagem meticulosa, guiada pela identificação de lesões cutâneas ou sinais/sintomas de doenças sistêmicas subjacentes. A avaliação abrangente, incluindo histórico médico detalhado, exame físico completo e exames laboratoriais e de imagem apropriados, frequentemente complementados por biopsia de pele com histopatologia e imunofluorescência direta, é essencial. As estratégias de tratamento para prurido crônico devem ser individualizadas com base na etiologia identificada. Medidas gerais, como emolientes, servem como intervenções iniciais, seguidas por abordagens direcionadas. Corticosteroides tópicos, inibidores de calcineurina, fototerapia e imunossupressores sistêmicos tratam a inflamação cutânea. Anti‐histamínicos, antidepressivos e imunossupressores podem ser empregados com base na etiologia específica. Terapias emergentes, incluindo medicamentos biológicos e inibidores de Janus quinases (JAK), têm potencial em casos refratários.
O prurido é o sintoma mais frequentemente relatado entre os pacientes que consultam dermatologistas.1 Foi definido pelo médico alemão Samuel Hafenreffer há mais de 350 anos como “sensação desagradável que provoca o desejo ou reflexo de coçar”.2,3
O prurido crônico (PC), isto é, prurido que dura mais de seis semanas,1 tem prevalência estimada variando de 8% a 25% e pode ser localizado ou generalizado.4–6 A prevalência de PC em crianças de 6 a 10 anos é estimada em 15%,7 e em idosos (≥ 65 anos) é de 25%.8
Pacientes que sofrem de PC geralmente experimentam impacto significante no bem‐estar psicossocial, incluindo distúrbios do sono, vergonha ou mesmo distúrbios dismórficos corporais em virtude de lesões visíveis causadas por escoriações.9–11 Pacientes com prurido intenso têm qualidade de vida mais baixa e sofrem mais de depressão do humor e ansiedade. Ideações suicidas foram relatadas em 18,5% dos pacientes com PC.12
O International Forum for the Study of Itch (IFSI) classificou o PC em três categorias: (i) PC na pele primariamente lesada (alterada; PCL), em que uma doença subjacente está presente na pele; (ii) PC na pele primariamente não lesada (inalterada; PCNL), na qual não há lesões cutâneas iniciais (anteriormente conhecido como prurido sine materia); e (iii) PC com lesões graves por escoriações (p. ex., prurigo crônico, líquen simples), o que impede a classificação na primeira ou segunda categoria.13 Essa classificação é crucial para orientar o diagnóstico e o tratamento, pois os mecanismos subjacentes e as estratégias terapêuticas podem variar significantemente dependendo do tipo de prurido.
O objetivo principal desta revisão é explorar a patogênese do PC, suas origens na pele/mucosa ou no sistema nervoso central (SNC), com atenção especial a essas diferentes distinções de prurido e às causas relacionadas a condições dermatológicas subjacentes, doenças internas ou quando classificado como PC de origem desconhecida (CPUO, do inglês chronic pruritus of unknown origin), juntamente com as recomendações atuais para investigação e tratamento.
Patogênese do prurido crônicoA histamina foi o primeiro mediador identificado associado ao prurido. Entretanto, a terapia anti‐histamínica provou ser eficaz apenas no tratamento de algumas condições, como urticária, reações alérgicas a medicamentos e reações a picadas de insetos. O prurido é sintoma resultante de interação complexa de mediadores inflamatórios, células imunológicas, células da pele e redes neuronais, envolvendo os sistemas nervosos periférico e central para produzir a resposta característica de coçar. O processo começa na epiderme e na junção dermoepidérmica, onde um pruritógeno – originado de produtos de células imunes, compostos exógenos ou queratinócitos – ativa receptores pruriginosos em fibras nervosas do tipo C não mielinizadas.14 Essas fibras podem ser classificadas como histaminérgicas ou não histaminérgicas com base na expressão do receptor.15 As fibras nervosas histaminérgicas estão tipicamente envolvidas na transição do prurido agudo para o prurido ativado por histamina, enquanto o PC está associado a fibras não histaminérgicas, que são ativadas por pruritógenos diferentes da histamina.16
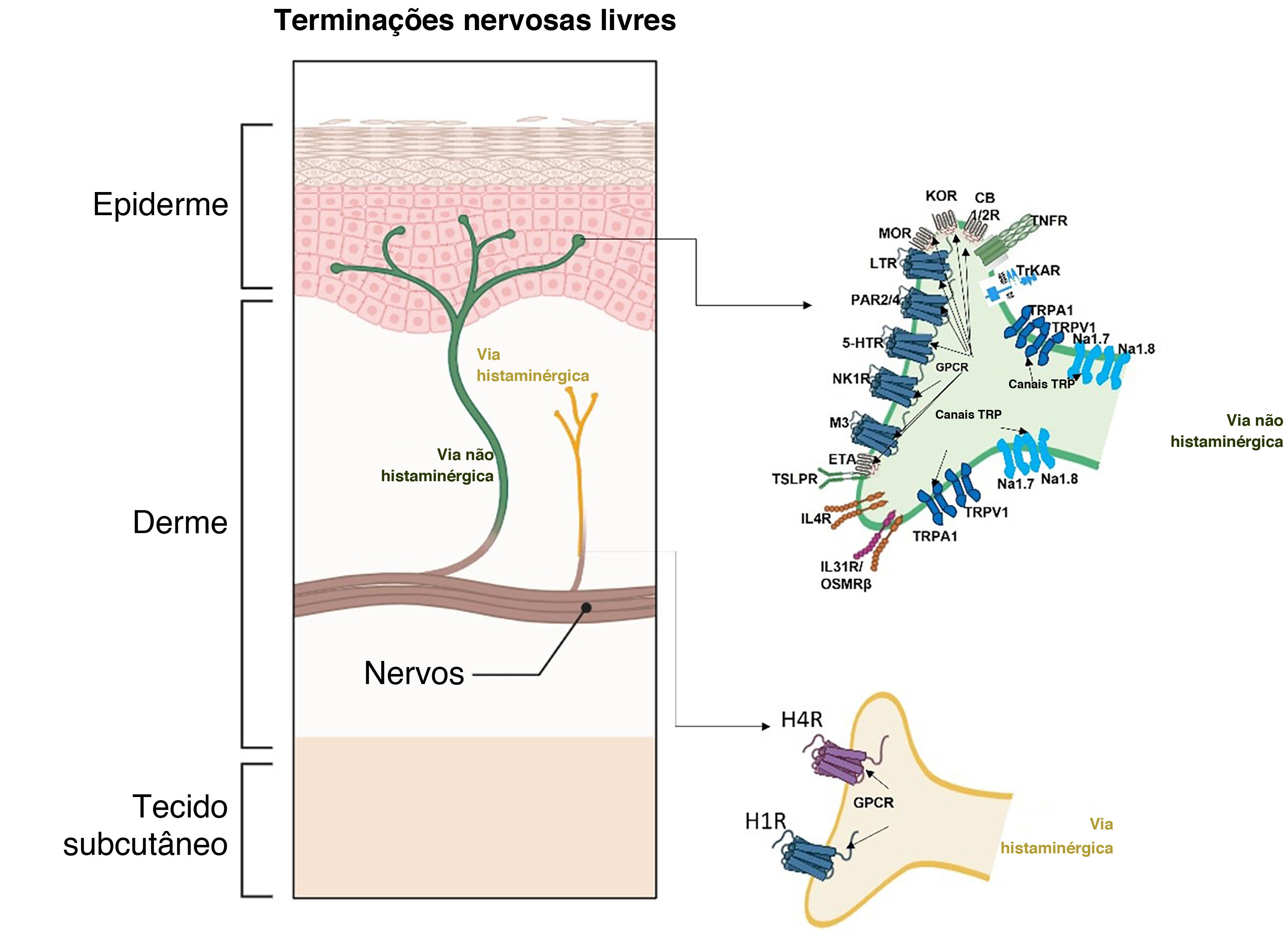
As comunicações desreguladas entre as terminações nervosas sensoriais, células imunes, queratinócitos, células residentes na pele, bem como o SNC, desencadeiam a cronificação do PC. Após o desencadeamento de estímulos cutâneos, os sinais de prurido são enviados aos nervos periféricos a partir das terminações nervosas cutâneas, que se originam em gânglios da raiz dorsal (GRD), sobem para o tálamo somatossensorial e são então projetados para o córtex cerebral (figs. 1 e 2).17
Receptores de prurido (SNP) na epiderme e derme. Existem pelo menos três subconjuntos de pruriceptores que expressam receptores de pruritógenos dedicados. Esses neurônios são geralmente subdivididos em neurônios NP1, NP2 e NP3 com base em seus padrões de expressão. Canais catiônicos de potencial receptor transitório vaniloide subtipo 1 e/ou potencial receptor transitório anquirina‐1 e NaV1.7 e NaV1.8, respectivamente, são necessários para a sinalização a jusante dos receptores de prurido e são consistentemente expressos em subconjuntos desses neurônios (via não histaminérgica). O prurido histaminérgico resulta da ação direta da histamina pruritógena em seu receptor (H1R) e (H4R) nos nervos sensoriais para transmitir sinais de prurido. Embora o H1R seja coexpresso com outros receptores pruritógenos em pruriceptores, sua utilidade como alvo terapêutico do prurido é limitada a certas doenças inflamatórias de prurido, como a urticária.
5‐HTR, receptor de serotonina; CB1/2, receptor canabinoide tipo 1 e 2; ETA, receptor de endotelina A; H1/4R, receptor de histamina tipo 1 e 4; IL31R, receptor de interleucina 31; IL4R, receptor de interleucina 4; KOR, receptor opioide kappa; LTR, receptor de leucotrienos; M3, receptor muscarínico de acetilcolina 3; MOR, receptor opioide mu; Nav1.7/1.8, canal de sódio dependente de voltagem; NK1R, receptor de neurocinina 1; OSMRβ, receptor beta da oncostatina M; P, fosfato; PAR2/4, receptor ativado por protease tipo 2 e 4; TNFR, receptor do fator de necrose tumoral; TrkA, receptor de tropomiosina quinase A; TRPA1, receptor transitório da anquirina 1; TRPV1, receptor transitório do potencial vaniloide 1; TSLPR, receptor de linfopoietina estromal tímico. Imagem parcialmente criada usando BioRender®.
O prurido na pele envolve os seguintes componentes principais: (i) células residentes na pele; (ii) fibras nervosas do prurido (SNP); (iii) receptores de prurido; (iv) vias de prurido histaminérgicas e não histaminérgicas; (v) transmissão de prurido na medula espinal; (vi) prurido no cérebro (SNC).18
- i)
Células residentes na pele
Queratinócitos são considerados como estando na linha de frente do sistema nervoso, em virtude de sua alta bioatividade e capacidade de secretar pruritógenos.19 Eles expressam o receptor ativado por protease (PAR2), receptor Toll 3 (TRL3), receptores de histamina (HR1‐HR4), endotelina A (ETA) e B (ETB), serotonina (5‐HTR), receptor de oncostatina‐M β (OSMRβ), integrina αvβ3, receptor de linfopoietina estromal tímica (TSLPR), receptores de neuropeptídeo Y (NPY), incluindo TRPV3 e V4 (fig. 2)
A via indireta de indução do prurido envolve a ruptura da barreira epidérmica, levando ao aumento do gradiente inflamatório e à perda de água transepidérmica. Essa ruptura é tipicamente acompanhada pela produção de citocinas pró‐inflamatórias (p. ex., IL‐6) e várias quimiocinas (p. ex., CXCL‐8, CCL17/TARC, CCL19/MIP‐3β, CCL22/MDC, CCL23/MIP‐3, CCL4/MIP‐1β e CXCL1/GRO1α), bem como fator de crescimento neural (NGF, do inglês nerve growth factor) pelos queratinócitos. Os principais mediadores pruriginosos liberados pelos queratinócitos que podem ativar diretamente as terminações nervosas pruriginosas incluem TSLP, periostina, ET‐1, IL‐33 e BNP.19,20
TSLP e outras citocinas Th2 podem induzir a secreção de periostina, que por sua vez pode estimular a liberação adicional de TSLP, potencialmente estabelecendo um ciclo de feedback pruriginoso positivo. Um dos mediadores pruriginosos mais potentes derivados dos queratinócitos é o ET‐1, cuja produção pode ser desencadeada pela ativação de PAR2, TLR3, TRPV3 e TRPV4. A IL‐33, membro da família IL‐1 de citocinas inflamatórias, é constitutivamente expressa no núcleo dos queratinócitos e atua como uma alarmina, liberada em resposta a inflamação ou dano celular.20
Inicialmente, a IL‐33 demonstrou atuar nas células do sistema imunológico inato e adaptativo, especificamente mastócitos, células linfoides inatas tipo 2 (ILC2), basófilos e células T auxiliares tipo 2. No entanto, seu receptor, ST2, também é expresso nas terminações nervosas sensoriais da pele, e sua ativação leva à resposta de prurido em camundongos. Além disso, a IL‐33 é regulada positivamente em lesões de dermatite atópica (DA), potencialmente contribuindo para o fenótipo pruriginoso associado a essa condição.20
Células de MerkelAs células de Merkel desencadeiam o ciclo prurido‐coceira após a estimulação pelo receptor Piezzo‐2.19 O complexo formado por células de Merkel e terminações pruriceptivas MRGPRA3+(fibras C) em casos de xerose e prurigo nodular (PN) pode estar funcionalmente comprometido. As células de Merkel expressam TRPM8.19
MastócitosOs mastócitos, células imunes inatas, estão localizadas na derme papilar, perto das fibras nervosas, ao redor da unidade pilossebácea, ao redor dos vasos sanguíneos dérmicos e estão repletas de pruritógenos, capazes de ativar as vias histaminérgicas e não histaminérgicas.19
- ii)
Fibras nervosas do prurido
Os corpos celulares das fibras alfa‐delta (Aδ) mielinizadas (prurido mecânico), fibras C não mielinizadas (CM e CMH), ambas não histaminérgicas, e as fibras C não mielinizadas (CMi/histaminérgicas) residem nos gânglios da raiz dorsal (GRD) com axônios inervando a pele (epiderme e derme) e dendritos fazendo sinapses no corno dorsal da medula espinal.18 O prurido é iniciado quando pruritógenos endógenos e exógenos se ligam a seus receptores nessas terminações nervosas sensoriais.18
- iii)
Receptores e canais de prurido18,21
Existem três classes principais de receptores de prurido: receptores acoplados à proteína G (GRPs), receptores Toll‐like (TLRs) e receptores de citocinas (como exemplo, interleucina‐31, linfopoietina estromal tímica, IL‐4, IL‐13, IL‐33, oncostatina‐M [OSM]).18,21 Os membros do GPCR relacionado a Mas (MRGPR) envolvidos no prurido são representados por MRGPRX1 e MRGPRX4 em humanos e, como exemplo, a cloroquina provoca prurido por meio da estimulação de MRGPRA3 em roedores e MRGPRX1 em humanos.21 Uma classe de canais amplamente associados ao prurido são os canais de receptor de potencial transitório (TRP). Esse grupo inclui TRP vaniloide‐1 (TRPV1) e TRP ankyrina‐1 (TRPA1), que ativam os canais de sódio Nav1.7 e Nav1.8, propagando assim o potencial de ação do sinal de prurido. As vias histaminérgicas e não histaminérgicas do prurido dependem da sinalização de TRP. A tabela 120–25 fornece um resumo dos diferentes receptores de prurido, seus compostos ativadores e as vias ou doenças associadas.22,23
Canais de prurido, receptores, seus compostos ativadores e vias, condições ou doenças associadas20–25
| Canais/receptores | Tipo | Compostos ativadores | Vias/doenças associadas | |
|---|---|---|---|---|
| Canais de receptor de potencial transitório (TRP) | TRPA1 (TRP anquirina 1) | Alicina (encontrada no alho), isotiocianato de alila (alcaloide encontrado no óleo de mostarda, wasabi e raiz‐forte), ácido araquidônico, BAM8‐22, ácidos biliares, bradicinina, carvacrol, cloroquina, Mucuna pruriens, cinamaldeído (encontrado no óleo de canela), endotelina‐1, peróxido de hidrogênio, IL‐33, IL‐31, LPA, LTB4, prostaglandinas, t‐BHP, TSLP, 5‐HT (serotonina), periostina | Prurido não histaminérgico associado a MRGPR e prurido não histaminérgico mediado por PAR; condições como DA, dermatite de contato alérgica, prurido colestático, psoríase | |
| TRPV1 (TRP vaniloide 1) | Capsaicina, histamina, ATP, produtos da lipo‐oxigenase, prostaglandinas, imiquimode, periostina, IL31, IL‐33 | Prurido histaminérgico e prurido não histaminérgico mediado por PAR, vias de prurido mediadas por IL‐31 e IL‐33; condições: DA, psoríase, prurigo nodular | ||
| TRPV2 (TRP vaniloide 2) | Aumento da temperatura, estímulos físicos | Degranulação de mastócitos, cascata inflamatória mediada por PKA | ||
| TRPV3 (TRP vaniloide 3) | Compostos derivados de plantas, ácido araquidônico, farnesil pirofosfato (FPP) | Prurido não histaminérgico mediado por PAR, síntese de BNP mediada por IL‐31; condições: síndrome de Olmsted (mutação missense com ganho de função do gene que codifica TRPV3), DA, psoríase | ||
| TRPV4 (TRP vaniloide 4) | Histamina, endotelina‐1, 5‐HT, lisofosfatidilcolina (LPC) | Prurido histaminérgico; prurido da pele seca, dermatite de contato alérgica, psoríase, prurido idiopático crônico | ||
| TRPM8 (TRP melastatina 8) | Mentol, icilina | Prurido histaminérgico e não histaminérgico; Circuito interneuronal espinal associado a neurônios B5‐1; prurido da pele seca, DA, urticária, prurido do couro cabeludo | ||
| TRPC3 (TRP canônico 3) | Cloroquina, beta‐alanina | Prurido não histaminérgico; dermatite de contato | ||
| TRPC4 (TRP canônico 4) | Sertralina | Prurido associado ao receptor de sertralina HT2B | ||
| Receptores acoplados à proteína G (GRPs) | Receptores (humanos e murinos) | Ligante endógeno | Ligante exógeno | |
| MRGPX2 (ortólogo humano), MrgprB2 (ortólogo murino) | Substância P, fator plaquetário‐4, AC‐30/SC, β‐defensina, catelicidina, LL‐37, BAM (8\u201222; 13‐22; 22), catestatina, cortistatina, hemocinina‐1 | Ciprofloxacina, levofloxacina, moxifloxacina, ofloxacina, atracúrio, rocurônio, tubocurarina, angiopeptina, cetrorelix, hexarelina, icatibanto, leuprolida, octreotida, sermorrelina, composto 48/80, mastoparan, CSP‐CSP1‐CSP‐2, entf, estreptina‐1 | ||
| MRGPRX1 (ortólogo humano), Mrgprc11 (ortólogo murino) | BAMB98‐220, β‐defensina, SLIGL [Tyr6] γ2‐MSH96‐12), neuropeptídeo FF | IPDef1; IRDef2 | ||
| MRGPRX1 (ortólogo humano), Mrgpra3 (ortólogo murino) | β‐defensina | Cronoquina | ||
| MRGPRX1 (ortólogo humano), Mrgpd (ortólogo murino) | β‐alanina, alamandina, 5‐oxoETE, angiotensina (1‐7), GABA | ND | ||
| MRGPRX4 (ortólogo humano), Mrgpra1 (ortólogo murino) | Bilirrubina, salusina β, neuropeptídeos contendo Arg‐Phe‐amida (FLRF‐amida, FMRF‐amida e NPFF) | ND | ||
| Mrgpra4 | Neuropeptídeo FF, ACTH | ND | ||
| Receptores do tipo Toll (TLRs)22,23 | Os TLRs funcionam como sensores inatos no sistema imunológico.22 Eles podem ter papel semelhante no sistema nervoso, mas essa possibilidade não foi demonstrada de maneira conclusiva22O prurido crônico após lesão na pele também requer TRPA1. Vários tipos de TLRs expressos por nociceptores, como TLR2, TLR3, TLR4 e TLR7, foram implicados na modulação do prurido por meio do acoplamento funcional ao TRPA1 e/ou TRPV123 | TLR3, TLR7 e potencialmente TLR4 são expressos em neurônios sensoriais primários de pequeno tamanho. TLR3, TLR7 e potencialmente TLR4 são expressos em subtipo de neurônios pruriceptivos/nociceptivos na raiz dorsal e no gânglio trigêmeo, fornecendo ligação direta entre a ativação de TLR e prurido22A ativação de TLRs neuronais pode iniciar a sensação de prurido acoplando‐se aos canais iônicos.22 Além disso, os TLRs são expressos nas células da pele e nas células gliais da medula espinal para regular a inflamação e a neuroinflamação no prurido crônico22 | ||
| Receptores de citocinas24 | TSLP e seu complexo receptor IL7Rα / TSLPR24,25A sinalização intracelular desses receptores de interleucina é mediada pelo TRPA1 | Expresso por um pequeno subconjunto de neurônios do GRD sensíveis ao prurido24A alta expressão cutânea de TSLP é característica marcante da DA, e o TSLP é liberado por KCs em resposta a uma ampla gama de estímulos, incluindo alergia e ativação proteolítica de PAR224 | ||
| IL‐33 e seu complexo receptor ST2 / IL1RAP24,25A sinalização intracelular desses receptores de interleucina é mediada pelos canais TRPA1/TRPV1 | Expresso por um subconjunto de neurônios do GRD sensíveis à histamina.24 Entretanto, o envolvimento exato da IL‐33 no prurido é menos claro,24 embora essa citocina seja importante para o desenvolvimento de condições crônicas de prurido, como ACD e xerose24Foi relatado que a IL‐33 estimula a produção de encefalina em células linfoides inatas do grupo 224O derivado da medula adrenal bovina A da proencefalina 8‐22 é um potente agonista do MRGPR24 | |||
| Interleucinas derivadas de células imunes tipo 2 (ILs) – IL‐4, IL‐13, IL‐31 e seus receptores24,25A sinalização intracelular de IL‐13Rα1 e IL‐4Rα é mediada pela via JAK1/STAT | Essas citocinas do tipo 2 desempenham papel importante no prurido associado à DA24O envolvimento dessas citocinas nas lesões cutâneas da DA já era conhecido, mas essas citocinas recentemente também foram implicadas na modulação direta dos neurônios do prurido.24 Em camundongos, o complexo receptor IL‐4 e IL‐13 IL‐4Rα/IL‐13Rα1 é amplamente expresso por neurônios do GRD sensíveis ao prurido, e o complexo receptor IL‐31 IL‐31Rα/OSMRβ é ainda expresso por algumas frações sensíveis a 5‐HT desses neurônios24A expressão desses receptores também foi detectada em GRDs humanos24Essas citocinas aumentam amplamente a excitabilidade neuronal do prurido, potencializando assim as vias histaminérgicas e não histaminérgicas da coceira24 | |||
ACTH, hormônio adrenocorticotrófico; DA, dermatite atópica; BAM, medula adrenal bovina; BNP, peptídeo natriurético tipo B; CSP, peptídeo‐1 estimulador de competência; GABA, ácido gama aminobutírico, IL, interleucina; IPDef1 (IP defensina‐1) e IRDef2 (IR defensina‐2), ambos são peptídeos salivares de carrapatos; JAK/STAT, Janus quinase/transdutor de sinal e ativador da transcrição; LTB4, leucotrieno B4; LPA, ácido lisofosfatídico; 5‐HT, 5‐hidroxiptamina (serotonina); oxoETE, ácido 5‐oxo‐eicosatetraenoico; ND, não determinado; MSH, hormônio estimulante de melanócitos; NPFF, neuropeptídeo FF; PAMAP, peptídeo de pró‐adrenomedulina, PACAP, polipeptídeo ativador de adenilato ciclase hipofisário; PAR, receptor ativado por protease; PKA, proteína quinase‐A; VIP, peptídeo vasointestinal, TSLP, linfopoietina estromal tímica.
Existem vários estímulos químicos que desencadeiam o prurido em diferentes estágios, incluindo neuropeptídeos, aminas, citocinas, quimiocinas, proteases, lipídios e opioides e seus respectivos receptores, como demonstrado na tabela 2.20,24–27 O prurido relacionado ao mediador implica que o prurido está associado a mediadores, incluindo histamina, 5‐hidroxitriptamina, proteases, peptídeo opioide, peptídeos e eicosanoides.24
- iv)
Vias histaminérgicas e não histaminérgicas
Mediadores e receptores distintos envolvidos no prurido crônico20,25–27
| Classes de mediadores e/ou alvos envolvidos na patogênese do prurido | Mediadores | Células envolvidas, ações e distúrbios associados |
|---|---|---|
| Neuropeptídeos (críticos na transmissão da sensação de coceira do sistema nervoso periférico para o sistema nervoso espinal e para o cérebro) | Peptídeo relacionado ao gene da calcitonina (CGRP) | Agente vasodilatador expresso nos neurônios sensoriais, neurônios motores, monócitos, macrófagos, células de Langerhans (CLs) e queratinócitos.O CGPRα é expresso no sistema nervoso central (SNC) e no sistema nervoso periférico (SNP), enquanto o CGRPβ é menos encontrado no SNP, mas é a única forma encontrada nos queratinócitos.20O CGRP é liberado após a ativação do canal catiônico do potencial receptor transitório subfamília V membro 1 (TRPV1, também conhecido como receptor de capsaicina e receptor vaniloide‐1) na membrana dos neurônios sensoriais.20O CGRP atua em várias células imunes, incluindo células T e B, células dendríticas (CD), mastócitos, macrófagos, CLs, causando neuroinflamação, vasodilatação neurogênica e resposta imune.Os interneurônios CGRP+(no GRD) podem mediar a transmissão espinhal do prurido, mas não os sinais de dor.20 |
| Substância P (SP) | A SP é importante transmissor dos neurônios aferentes no SNP e no SNC.25A SP atua em células imunológicas distintas, como eosinófilos, mastócitos, células T e promove a inflamação da pele.O receptor de neurocinina‐1 (NK‐1R) é tradicionalmente considerado o principal receptor de SP; no entanto, em mastócitos, o membro B2 do receptor acoplado à proteína G relacionado a Mas (MrgprB2/MrgprX2) pode ser o receptor crítico para a ativação de mastócitos mediada pela SP.A SP ativa os mastócitos para liberar histamina, leucotrieno B4 (LTB4), prostaglandina D2 (PGD2) e fator de necrose tumoral alfa (TNF‐α).25 Esses mediadores atingem as terminações nervosas sensoriais na epiderme e na derme, onde induzem a liberação de SP e exacerbam o prurido, em um ciclo vicioso de feedback positivo para coceira.25SP liberada pelas terminações nervosas sensoriais, especialmente pelas fibras C, pode aumentar a liberação de histamina e TNFα dos mastócitos, a produção de IL‐1, IL‐6 e IL‐8 nos queratinócitos ou a produção de IL‐8 nas células endoteliais microvasculares dérmicas, todas contribuindo para a inflamação local.25 | |
| Neuropeptídeo Y (NPY) | Os interneurônios inibitórios espinais expressam receptores para essa molécula que formam sinapses com fibras aferentes estimuladas pela secreção do peptídeo natriurético B.27 | |
| Neurotrofina | A neurotrofina é uma grande família de ativadores fisiológicos que promovem o crescimento, a diferenciação e a manutenção dos neurônios.26 Ela contém principalmente fator de crescimento nervoso (NGF), fator neurotrófico derivado do cérebro (BDNF), fatores neurotróficos‐3 (NT‐3) e fatores neurotróficos‐4 (NT‐4).26Os níveis de NGF nas lesões pruriginosas da DA e da psoríase aumentaram significantemente e correlacionaram‐se com a gravidade das doenças;26 O NGF, ao mesmo tempo, regulou positivamente a expressão de neuropeptídeos sensoriais, que podem induzir a liberação de TRPV1, provocar a degranulação dos mastócitos e resultar em prurido.26 | |
| Peptídeo natriurético tipo B (BNP) | O BNP é um mediador central do prurido.5 A liberação e a síntese de BNP são reguladas positivamente pela interleucina‐31 (IL‐31) em neurônios sensoriais do gânglio da raiz dorsal (GRD).20Os receptores de IL‐31 (IL‐31RA e OSMR) são coenriquecidos com o gene BNP (Nppb) no GRD.20A expressão do BNP e do receptor é aumentada na pele lesionada de pacientes com DA.20Nas células da pele humana, os fenótipos pró‐inflamatórios e promotores de prurido são promovidos pelo BNP.20Na pele, descobriu‐se que o BNP sensibiliza o potencial receptor transitório vaniloide‐3 (TRPV3), resultando em maior liberação de Serpina E1, um mediador específico do prurido com níveis de transcrição positivamente correlacionados com a gravidade da DA na pele humana.20 | |
| Peptídeo liberador de gastrina (GRP) | O GRP é um transmissor seletivo de prurido espinhal conhecido por ser altamente expresso em uma população de interneurônios do corno dorsal (CD) da medula espinhal e pode servir como “portão com vazamento” para sinais nociceptivos.20Os neurônios GRP recebem entrada direta dos pruritoceptores MrgprA3+.20O nível de GRP também está aumentado na pele do paciente com DA e o GRP parece promover a liberação de linfopoietina estromal tímica (TSLP) dos queratinócitos.20 | |
| Somatostatina (SST) | A SST se origina dos GRDs e dos neurônios do corno dorsal espinhal e é um importante hormônio endócrino e um neuropeptídeo no sistema nervoso, incluindo o SNP e o SNC.20 | |
| Peptídeos opioides | Os peptídeos opioides têm efeitos no prurido periférico e central. Eles funcionam efetivamente pela ativação do receptor μ (MOR) e inibição do receptor κ (KOR) no SNC. O MOR é o principal receptor funcional para a produção de prurido, mas o KOR faz o oposto. Na periferia, por outro lado, a morfina induz a geração de prurido ao provocar a degranulação dos mastócitos.26 Todos esses peptídeos opioides podem causar prurido após administração intratecal.26As endorfinas endógenas demonstram afinidade pelo MOR expresso nas fibras C e A.27 Estes formam sinapses com interneurônios excitatórios GRPR+no corno posterior, onde a sinalização é pruritógena.27 O KOR se liga à dinorfina, cuja atividade é anti‐pruritógena.27A nível fisiológico existe uma homeostase entre a ativação de MOR e KOR, controlada principalmente pela excreção de dinorfina.27 Na medula espinhal, existe uma subpopulação de interneurônios inibidores da dinorfina+.27 A perda de função desses interneurônios está implicada na sinalização central de prurido e alocinese.27 | |
| Aminas | Histamina27 | A histamina é um meio químico armazenado principalmente nos leucócitos basófílos e nos mastócitos.26 Quando essas células são ativadas por fatores imunológicos e não imunológicos, a histamina é liberada.26 Seus receptores pertencem aos membros dos receptores acoplados à proteína G (GPCR), nos quais os receptores H1 e H4 (H1R e H4R) desempenham papéis importantes no aparecimento do prurido.26 Anteriormente, considerava‐se que a histamina dominava o desenvolvimento do prurido por meio da ligação ao H1R e ativação da fosfolipase Cβ3 (PLCβ3) e da fosfolipase A2 (PLA2).26 HR‐4 está presente em queratinócitos e em fibras C (histaminérgicas).27A histamina pode aumentar o influxo de cálcio nos terminais axônicos dos neurônios da medula espinhal, ativando o receptor transitório vaniloide‐1 (TRPV1) e, em seguida, promovendo ativação de uma série de sinais intracelulares e, finalmente, levando à geração de prurido.26Hoje em dia, a histamina é considerada o principal mediador em algumas condições como urticária aguda e crônica, algumas reações adversas a medicamentos e picadas de insetos. O prurido mediado por H4R na medula espinhal pode ser persistente, e os antagonistas para H4R atenuaram prurido em pacientes com DA, enquanto os antagonistas de H1R e H2R são amplamente ineficazes na DA e na psoríase.20 |
| Proteases | As proteases atuam como qualquer enzima na proteólise, estando envolvidas em diversas reações fisiológicas. Acredita‐se que as proteases sejam substâncias extremamente importantes no prurido independente da histamina.27 Estudos recentes demonstraram que as proteases desempenham papel crucial no ataque de prurido, combinando‐se com GPCR, denominados receptores ativados por proteases (PARs), especialmente PAR2 e PAR4.26 | |
| Outros peptídeos | Bradicinina | A bradicinina é um peptídeo ativo do grupo de proteínas cinina. É um potente mediador inflamatório e vasodilatador dependente do endotélio, que contribui para a produção de reação inflamatória e a dilatação dos vasos sanguíneos.26 Os receptores de bradicinina compreendem o receptor B1 (B1R) e o receptor B2 (B2R) pertencentes à família GPCR.26 Ao se combinar com seus receptores, a bradicinina inicia e induz uma variedade de reações fisiológicas e patológicas.26 |
| Metabólitos de fosfolipídios | Canabinoides | Os canabinoides (CB) pertencem aos derivados do ácido araquidônico, cujos receptores contêm o receptor CB1 e o receptor CB2. O receptor CB1 é distribuído no SNC, enquanto o receptor CB2 é distribuído nos tecidos periféricos.27 Os CBs, ao se ligarem a seus receptores, podem induzir a liberação de 13‐endorfinas, e aliviar a dor e aliviar o prurido induzido pela histamina.27 Esses resultados indicam que os CB pode estar envolvidos na regulação da dor e do prurido.26Em camundongos, ambos os receptores foram detectados em neurônios sensoriais, enquanto em humanos, apenas CB2R foi localizado.15 A ativação do CBR em neurônios sensoriais pode diminuir a atividade neuronal e modular a resposta de exacerbação do axônio.15 O tetra‐hidrocanabinol, um componente bioativo da maconha, bloqueou a coçadura provocada pelo composto 48/80.15 |
| Eicosanoides | Existem várias subfamílias de eicosanoides, consistindo em leucotrienos (LTs), prostaglandinas, resolvinas, lipoxinas, eoxinas e tromboxanos.26 Os LTs, mais proeminentemente, são reguladores importantes na modulação do prurido, e os níveis de LTB4 são significantemente elevados na DA e lesões psoriáticas, que geralmente são pruriginosas.26 | |
| Fator de ativação plaquetária (PAF) | O PAF tem uma variedade de efeitos fisiológicos e fisiopatológicos, atuando como importante mediador e ativador na anafilaxia, inflamação, agregação e degranulação plaquetária e quimiotaxia leucocitária.26 Normalmente, o PAF é produzido em pequenas quantidades por várias células (p. ex., plaquetas, neutrófilos, macrófagos, células endoteliais e monócitos), mas emerge em maiores quantidades de células inflamatórias em resposta a um estimulador específico.26 | |
| Prurido induzido por citocinas e fator quimiotático | As citocinas constroem “uma ponte de comunicação” entre o sistema imunológico e o sistema nervoso. As lesões cutâneas e o prurido relacionados à DA são agravadas sob a interação mútua das vias de sinal imunológico neural‐epidérmico.20 O prurido é causado por uma variedade de citocinas derivadas de prurido, incluindo TSLP, interleucina‐2 (IL‐2), interleucina‐4 (IL‐4), interleucina‐13 (IL‐13), IL‐31, interleucina‐33 (IL‐33), etc., e pelo desequilíbrio do circuito neuroimune entre os receptores IL‐4R, IL‐13R, IL‐31RA, OSMR, Mrgprs e peptídeos de prurido (SP, BNP, CGRP, GRP e protease, etc.).20À medida que a quantidade de células TH2 é aumentada, a inflamação relacionada a citocinas específicas e a geração de eosinofilia e imunoglobulina E (IgE) são promovidas, enquanto a geração de proteínas de barreira epidérmica e peptídeos antibacterianos é inibida. A IL‐4 e a IL‐13 são citocinas típicas do tipo 2 e comprovadamente estimulam de maneira direta os neurônios sensoriais por meio dos sinais da Janus quinase‐1 (JAK1) e promovem a sensação de prurido.20 | |
| IL‐13 | Os níveis de IL‐13 estão aumentados na pele e no soro de pacientes com DA, e a IL‐13 participa do início da DA e do prurido. Juntamente com a IL‐4, agrava a disfunção da barreira epidérmica pela regulação negativa da expressão de filagrina (FLG) e involucrina (IVL) nos queratinócitos.20Os neurônios sensoriais e queratinócitos expressam o receptor heterodímero IL‐4, o receptor alfa/IL‐13, o receptor alfa‐1 (IL‐4Rα/IL‐13Rα1) e o receptor alfa‐2 de IL‐13 (IL‐13Rα2).20A IL‐13 liga‐se à IL‐13Rα1 com baixa afinidade, e quando o receptor heterodímero constituído por IL‐13Rα1 e IL‐4Rα é formado, com alta eficiência, este último é um receptor do tipo II.20Os agonistas heterodímeros de IL‐13 e TLR2 podem regular positivamente a transcrição de IL‐13Rα2 em queratinócitos e neurônios sensoriais, respectivamente, promovendo inflamação neurogênica e exacerbando a DA e o prurido.20 | |
| IL‐31 | A IL‐31 desempenha papel importante na indução de prurido e inflamação na DA e dermatite de contato crônica em camundongos e humanos.20A IL‐31 estimula o subconjunto neuronal NP3 relacionado ao prurido, uma subpopulação também responsiva a 5‐HT liberado por mastócitos, leucotrieno C4 (LTC4) e S1p, e libera BNP e SST. Além disso, a IL‐31 se liga a seus receptores em queratinócitos epidérmicos e células imunes (ou seja, eosinófilos) para induzir disfunção da barreira cutânea e inflamação cutânea.20 | |
| IL‐33 | A IL‐33 é um amplificador eficaz da reação imune tipo 2 e é um alvo importante para o prurido cutâneo seco e o prurido crônico de origem desconhecida (CPUO).20O receptor de IL‐33 ST2 (também chamado de IL‐33R) é expresso em GRDs, queratinócitos, células imunes, fibroblastos e mastócitos.20A ligação da IL‐33 aos queratinócitos contribui para a obstrução da expressão das proteínas filagrina e claudina‐1 e danos funcionais à barreira cutânea e facilitação da regulação imunológica.20A IL‐33 estimula diversas células, incluindo ILC2 (célula linfoide inata tipo 2) e gera citocinas tipo 2, incluindo IL‐5 e IL‐13.20 | |
| TSLP | O TSLP é citocina pró‐alérgica liberada principalmente pelos queratinócitos sendo o principal alvo na DA. O TSLP impulsiona a inflamação mediada por TH2 e aumenta a liberação de periostina dos queratinócitos, promovendo assim a sinalização do prurido, e esse efeito é suscetível ao inibidor de JAK2 SD1008 e ao inibidor de STAT3 niclosamida.Após ser liberado dos queratinócitos, o TSLP ativa várias células imunológicas, como células T, células dendríticas, mastócitos e neurônios sensoriais diretamente evocando prurido.20 As funções biológicas do TSLP requerem a formação de heterodímeros entre o receptor de TSLP (TSLPR) e o receptor alfa de interleucina‐7 (IL‐7Ra).20 A ativação de TSLPR de neurônios sensoriais aferentes primários requer TRPA1, mas não TRPV1.20O TSLP também é importante para promover o crescimento e a regeneração de pelos induzidos por feridas em camundongos, o que pode ser uma questão que deve ser considerada para o uso de antagonistas do TSLP para prurido acompanhado de perda de cabelos.20 | |
| Periostina | A periostina desempenha papéis críticos na patogênese da fibrose na pele, lesões de DA, psoríase, inflamação alérgica na pele e prurigo nodular.20A periostina é liberada dos queratinócitos dérmicos e fibroblastos após estimulação pelas citocinas TH2 IL‐13 e IL‐4 e, em seguida, ativa a integrina aVβ3 em uma fração das fibras sensoriais de prurido SST+/NPPB+.20 Enquanto isso, a periostina estimula os queratinócitos e as células imunes a liberar várias citocinas, incluindo citocinas TH2, como a IL‐31.20MC903 e ácaros da poeira doméstica promovem a liberação de periostina através de mecanismo mediado por JAK / STAT.20 A periostina também induz a liberação de TSLP em um ciclo de feedback periostina‐TSLP‐ citocina TH2‐periostina.20 | |
| Lipocalina‐2 (LCN2) | LCN2 é modulador central do prurido crônico por meio de um mecanismo dependente de STAT3 nos astrócitos espinhais.20 Também é liberado por neutrófilos e queratinócitos.20 O nível sérico de LCN2 está associado à gravidade do prurido em pacientes com psoríase.20 | |
| IL‐2 | A IL‐2 é indutora de prurido, bem como uma citocina autócrina, e uma única injeção intradérmica induz prurido cutâneo local de baixa intensidade com duração de 48 a 72 horas, bem como eritema em pacientes humanos com DA e indivíduos saudáveis.20A IL‐2 é liberada dos queratinócitos e de várias células imunológicas e, em seguida, ativa os neurônios histaminérgicos. Além disso, induz eritema e infiltração de células T dérmicas.20 | |
| IL‐6 | A IL‐6 é predominantemente expressa em células dendríticas, queratinócitos, macrófagos e neurônios.20 O nível de IL‐6 derivado de células dendríticas está ligado à DA. A IL‐6 facilita a expressão de IL‐4 pelas células T CD4+e sua diferenciação para células TH2.20 | |
| Oncostatina M (OSM) | A OSM é liberada por células T dérmicas, macrófagos, células dendríticas, neutrófilos e monócitos. Seu receptor OSMR reside em neurônios sensoriais que expressam BNP; no entanto, a OSM não ativa a entrada de cálcio neuronal sensorial – portanto, é diferente de outros pruritógenos.20A OSM também potencializa o prurido evocado por histamina e leucotrieno.20 |
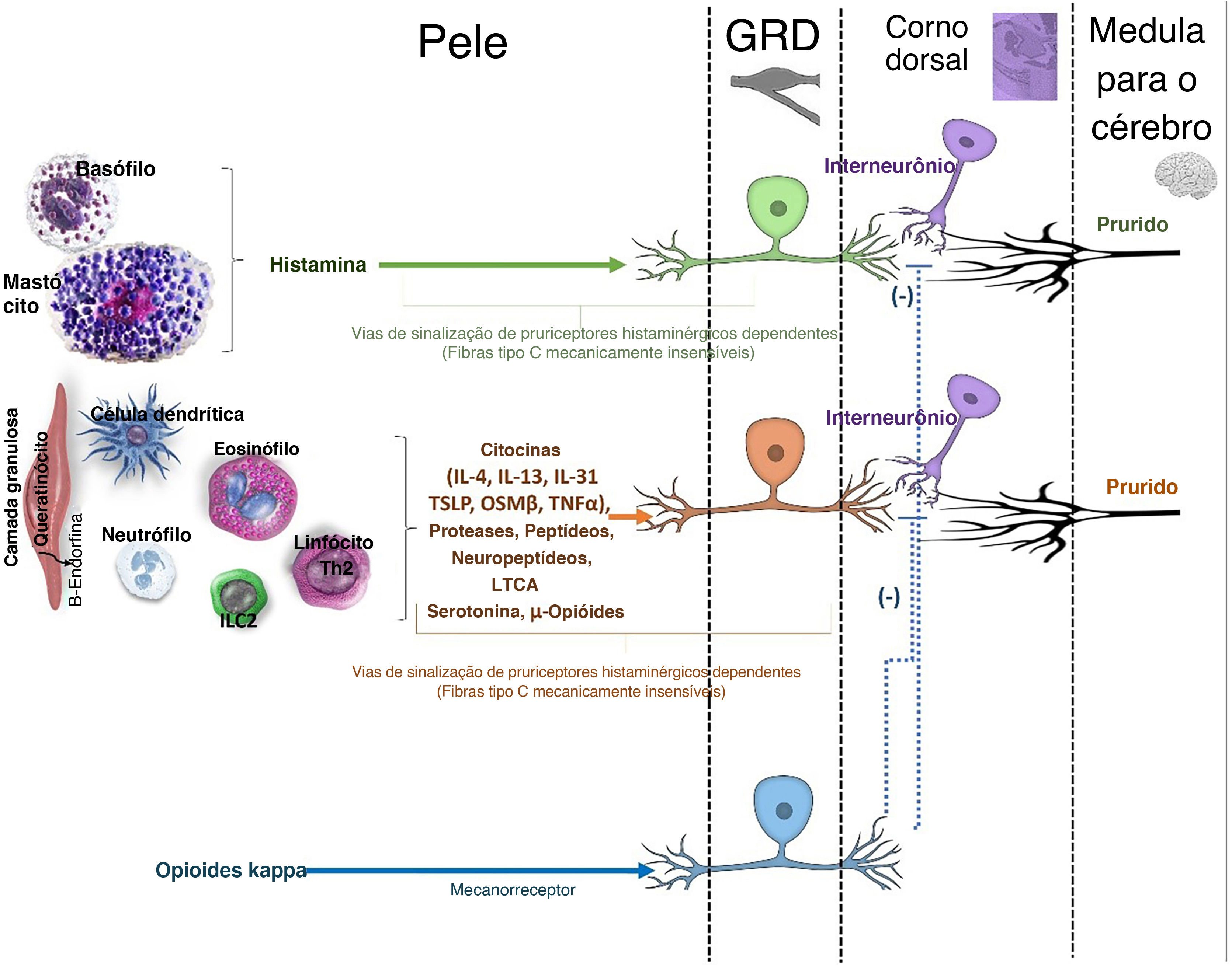
Os nervos sensoriais histaminérgicos e não histaminérgicos constituem as duas principais vias do prurido.18 A via histaminérgica transmite prurido agudo e crônico, como nos casos de urticária espontânea aguda ou crônica, e é mediada pela histamina secretada principalmente por mastócitos, basófilos e queratinócitos.18 Uma vez liberada, a histamina se liga aos receptores H1 e H4 nos nervos histaminérgicos, ativando o TRPV1.18 O prurido não histaminérgico é provocado por nervos que expressam vários receptores, ativados por pruritógenos diferentes da histamina.18 Esses pruritógenos são liberados por uma variedade de células efetoras, incluindo mastócitos, granulócitos, macrófagos, linfócitos, células linfoides inatas tipo 2 (ILC2), queratinócitos e neurônios.18 Evidências recentes também sugerem que os basófilos podem promover prurido mediado pela imunoglobulina E (IgE), independente dos mastócitos.18
- v)
Prurido na medula espinal
O sinal de prurido é transmitido através dos corpos celulares dos neurônios no GRD para o corno dorsal da medula espinal (fig. 3).18 Os neurônios sensoriais ativados liberam peptídeo liberador de gastrina (GRP), que se liga aos neurônios intermediários positivos para o receptor GRP (GRPR; interneurônios) na medula espinal.18 Anormalidades estruturais da medula espinal também podem modular a via de sinalização do prurido, causando prurido neuropático localizado.18 Populações específicas de interneurônios inibitórios estão envolvidas no controle do prurido, e sua disfunção poderia levar à percepção aumentada do prurido.25 A radiculopatia dos nervos cervicais contribui para o prurido braquiorradial, enquanto os ramos dorsais dos nervos intercostais estão envolvidos na notalgia parestésica.18
- vi)
Prurido no cérebro (SNC)
Vias que induzem e inibem o prurido na medula espinhal. Além dos mediadores inflamatórios, há muito se reconhece que os opioides mu (por exemplo, morfina) podem desencadear prurido. Embora seja bem conhecido que os opioides mu desencadeiam prurido, em parte, no sistema nervoso central (SNC), o receptor opioide mu (MOR) é abundantemente expresso nas fibras dos pruriceptores na pele. Os opioides Mu atuam como pruritógenos diretos. Os neurocircuitos periféricos do prurido revelaram um amplo arranjo de vias não histaminérgicas na pele (epiderme e derme), que podem desencadear várias formas de prurido. Há vias endógenas dedicadas a suprimir o prurido tanto na periferia quanto no SNC. É bem conhecido o fato de que estímulos mecânicos (p. ex., coceira) e dor podem suprimir o prurido. Isso provavelmente se deve, em parte, às vias inibitórias desencadeadas na medula espinhal. Além disso, os opioides kappa endógenos, diferentemente dos opioides mu, demonstraram suprimir o prurido por sua capacidade de atuar nos neurônios sensoriais, na medula espinhal (corno dorsal) e no cérebro. A ativação do receptor opioide kappa (KOR) contrabalança o efeito pruritógeno da ativação do MOR. Entretanto, a ativação de KOR na periferia é predominantemente expressa em neurônios mecanossensoriais (mecanorreceptores), ao invés de pruriceptores.
GRD, gânglio da raiz dorsal; ILC2, célula linfoide inata tipo 2; IL, interleucina, TSLP, linfopoietina estromal tímica; OSMβ, oncostatina beta, LTC4, leucotrieno C4; μ‐opioides, mu‐opioides; (–), efeito inibitório.
Após a transmissão pela medula espinal, os sinais de prurido correm ao longo do trato espinotalâmico e atingem o tálamo e o núcleo parabraquial, e em seguida o cérebro.18
A percepção do prurido envolve o córtex somatossensorial primário e secundário, a ínsula e o córtex cingulado anterior.18
O prurido histaminérgico e não histaminérgico também ativa áreas distintas do cérebro e pode se assemelhar à percepção da dor. É muito importante lembrar que a ativação cerebral após estimulação pruriginosa é diferente em pacientes com PC em comparação com voluntários saudáveis. Isso foi demonstrado em estudos de ressonância magnética funcional (RMf), por exemplo, com pacientes com DA, onde o circuito frontoestriatal é relevante para o prurido. Existem vias inibitórias de cima para baixo do tronco cerebral modulando o sinal de prurido no nível da coluna vertebral.18 Essas vias parecem ser afetadas em pacientes com PC.26
- vii)
Via eferente do prurido: ação motora para escoriar
No SNC (cérebro), os principais neurotransmissores são a noradrenalina (NA) e a serotonina (5‐HT).19
A população de neurônios NA+está localizada no locus coeruleus, enquanto seus receptores adrenérgicos α1 são encontrados em interneurônios inibitórios da medula espinal. O receptor 5‐HT1A, expresso em interneurônios GRPR+, também desempenha papel direto na sinalização eferente (descendente) do prurido. A substância cinzenta periaquedutal (PAG) recebe informações da amígdala e do núcleo parabraquial, contribuindo ativamente para o processamento central do componente emocional do prurido.27 Uma subpopulação de neurônios glutamatérgicos que expressam taquicinina‐1 (TAC1+) promove estímulos que sustentam o ciclo vicioso do prurido. O córtex cingulado anterior faz parte de um circuito com o núcleo talâmico anterolateral e o estriado dorsomedial, modulando o prurido histaminérgico por meio de um circuito espinal dependente de interneurônios Bhlhb5+.19
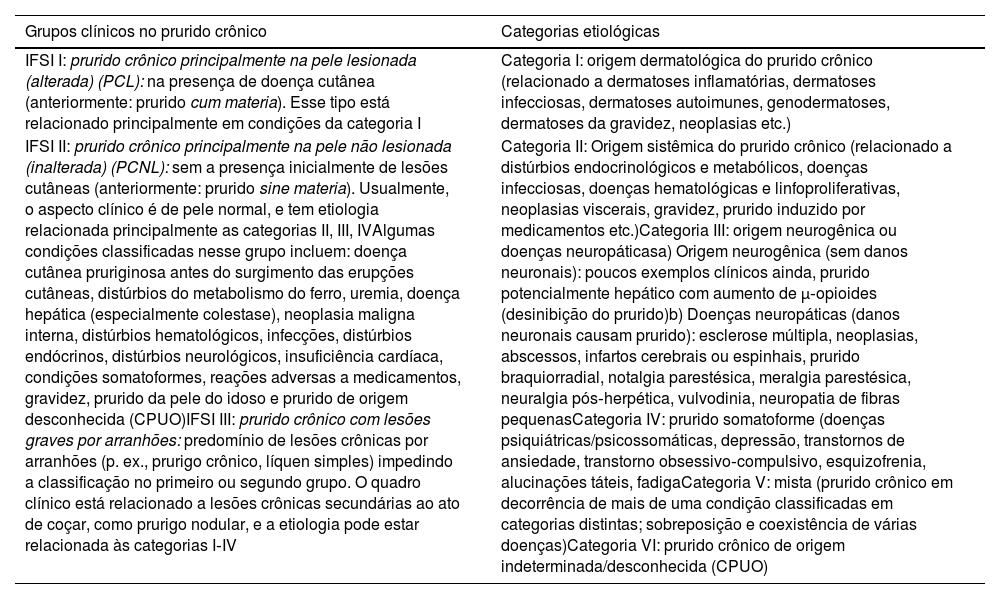
Classificação e investigação do prurido de acordo com a presença ou ausência de lesões cutâneas primáriasO PC pode continuar independente de sua causa e pode adquirir estado de doença independente, com comportamento inflamatório neuroimune, em várias condições.13 Na tabela 3, a classificação atual do PC de acordo com o IFSI é adaptada e apresentada em seus respectivos grupos e categorias.4,28
Classificação do prurido crônico em grupos e categorias4,28
| Grupos clínicos no prurido crônico | Categorias etiológicas |
|---|---|
| IFSI I: prurido crônico principalmente na pele lesionada (alterada) (PCL): na presença de doença cutânea (anteriormente: prurido cum materia). Esse tipo está relacionado principalmente em condições da categoria I | Categoria I: origem dermatológica do prurido crônico (relacionado a dermatoses inflamatórias, dermatoses infecciosas, dermatoses autoimunes, genodermatoses, dermatoses da gravidez, neoplasias etc.) |
| IFSI II: prurido crônico principalmente na pele não lesionada (inalterada) (PCNL): sem a presença inicialmente de lesões cutâneas (anteriormente: prurido sine materia). Usualmente, o aspecto clínico é de pele normal, e tem etiologia relacionada principalmente as categorias II, III, IVAlgumas condições classificadas nesse grupo incluem: doença cutânea pruriginosa antes do surgimento das erupções cutâneas, distúrbios do metabolismo do ferro, uremia, doença hepática (especialmente colestase), neoplasia maligna interna, distúrbios hematológicos, infecções, distúrbios endócrinos, distúrbios neurológicos, insuficiência cardíaca, condições somatoformes, reações adversas a medicamentos, gravidez, prurido da pele do idoso e prurido de origem desconhecida (CPUO)IFSI III: prurido crônico com lesões graves por arranhões: predomínio de lesões crônicas por arranhões (p. ex., prurigo crônico, líquen simples) impedindo a classificação no primeiro ou segundo grupo. O quadro clínico está relacionado a lesões crônicas secundárias ao ato de coçar, como prurigo nodular, e a etiologia pode estar relacionada às categorias I‐IV | Categoria II: Origem sistêmica do prurido crônico (relacionado a distúrbios endocrinológicos e metabólicos, doenças infecciosas, doenças hematológicas e linfoproliferativas, neoplasias viscerais, gravidez, prurido induzido por medicamentos etc.)Categoria III: origem neurogênica ou doenças neuropáticasa) Origem neurogênica (sem danos neuronais): poucos exemplos clínicos ainda, prurido potencialmente hepático com aumento de μ‐opioides (desinibição do prurido)b) Doenças neuropáticas (danos neuronais causam prurido): esclerose múltipla, neoplasias, abscessos, infartos cerebrais ou espinhais, prurido braquiorradial, notalgia parestésica, meralgia parestésica, neuralgia pós‐herpética, vulvodinia, neuropatia de fibras pequenasCategoria IV: prurido somatoforme (doenças psiquiátricas/psicossomáticas, depressão, transtornos de ansiedade, transtorno obsessivo‐compulsivo, esquizofrenia, alucinações táteis, fadigaCategoria V: mista (prurido crônico em decorrência de mais de uma condição classificadas em categorias distintas; sobreposição e coexistência de várias doenças)Categoria VI: prurido crônico de origem indeterminada/desconhecida (CPUO) |
Além disso, para a compreensão do prurido, algumas terminologias importantes são significantes, tais como: alodinia, que se refere a dor ou prurido causados por estímulos tipicamente não dolorosos ou não pruriginosos e está associada à sensibilização central; alocinese, o desencadeamento do prurido a partir de estímulos que geralmente não o provocam; atmocinese, que é o prurido que ocorre quando a pele é exposta ao ar, como quando a roupa é removida; sensibilização central, descrevendo o aumento da capacidade de resposta dos neurônios nociceptivos no SNC a estímulos normais ou sublimiares, muitas vezes ligados a lesão periférica ou inflamação, resultando em maior excitabilidade das vias centrais, atividade inibitória reduzida e desenvolvimento de dor ou PC; disestesia, sensação anormal que pode incluir queimação, prurido, dor ou formigamento, geralmente observada no couro cabeludo; e inflamação neurogênica, que está relacionada à liberação de mediadores, como a substância P (SP) ou o peptídeo relacionado ao gene da calcitonina (CGRP), de neurônios aferentes periféricos, impactando o sistema imunológico.29
Avaliações do desfecho no prurido foram criadas para ajudar os médicos e pesquisadores a mensurar a gravidade do prurido relatada pelos pacientes de maneira padronizada e quantificável. As principais avaliações de desfecho incluem:
- a)
Escala Visual Analógica (EVA): os pacientes classificam a intensidade do prurido em uma linha contínua, variando de 0 (sem prurido) a 10 (pior prurido imaginável);30
- b)
Escala de Avaliação Numérica (NRS, do inglês Numerical Rating Scale): semelhante à EVA, na NRS os pacientes atribuem valor numérico (p. ex., 0‐10) indicando a gravidade do prurido. Ele fornece uma avaliação rápida e direta do prurido;
- c)
Dermatology Life Quality Index (DLQI): representa o impacto do prurido na qualidade de vida do paciente, incluindo questões de diferentes domínios, como sintomas, atividades diárias e bem‐estar emocional, fornecendo visão abrangente de como o prurido afeta vários aspectos da vida;31
- d)
Itch Numeric Rating Scale (Itch NRS): essa é uma escala de classificação numérica específica projetada para avaliar a gravidade do prurido, variando de 0 a 10;32
- e)
Patient‐Oriented Eczema Measure (POEM): originalmente projetado para eczema, esse questionário avalia o impacto do prurido nos sintomas e seu efeito nas atividades diárias.33
Uma etapa essencial na abordagem do PC envolve registro meticuloso do histórico médico do paciente e exame clínico complete (tabela 4).28 Além disso, a investigação diagnóstica interdisciplinar, incorporando exames laboratoriais e de imagem, é imprescindível para o diagnóstico.13
- i)
Prurido crônico relacionado a condições dermatológicas
Dados médicos relevantes na anamnese de pacientes com prurido crônico28
| Características do prurido | Data de início, duração | |
| Distribuição anatômica: localização (início, disseminado ou localizado) | ||
| Qualidade (tipificação: prurido puro, características neuropáticas) | ||
| Intensidade: (gravidade na escala de classificação numérica) | ||
| Evolução: flutuações diurnas, evolução contínua/semelhante a um ataque ou paroxística, melhora/agravamento espontâneo, agravamento noturno | ||
| Fatores de provocação (p. ex., aquagênico, exercício físico), fatores de alívio (p. ex, frio, pele coberta por roupas) | ||
| Comportamento de coçar | ||
| Associação temporal com doenças pré‐existentes, cirurgias, ingestão de medicamentos, outros eventos | ||
| Terapias anteriores com/sem sucesso | ||
| Percepção do paciente sobre a causa do prurido | ||
| Fatores de sobrecarga psicossocial | ||
| Comprometimento da qualidade de vida relacionada à saúde, sofrimento mental, distúrbios do sono | ||
| Informações gerais | Doenças pré‐existentes, incluindo dermatoses | |
| Cirurgias anteriores | ||
| Histórico de viagens | ||
| Gravidez | ||
| Condições atópicas associadas | ||
| Alergias: tipo I e tipo IV | ||
| Ingestão de medicamentos, infusões, transfusões de sangue | ||
| Residência em área endêmica de infestações | ||
| Perguntas de triagem relacionadas a transtornos de ansiedade e depressão | 1. Triagem da depressão: | |
| No último mês, você se sentiu frequentemente deprimido, melancólico ou sem esperança? | ||
| No último mês, você frequentemente teve pouco interesse ou prazer em suas atividades? | ||
| Se ambas as perguntas forem respondidas negativamente, depressão importante pode ser excluída com alta sensibilidade de 96% | ||
| 2. Triagem de transtornos de ansiedade: | ||
| Durante as últimas quatro semanas, você se sentiu significantemente prejudicado por: tensão nervosa, ansiedade, sensação de ter perdido o equilíbrio mental? Você se preocupou com todos os tipos de coisas? | ||
| Durante as últimas quatro semanas, você teve um ataque de ansiedade (sensação repentina de ansiedade ou pânico?) | ||
| Características particulares da história médica | Vários membros da família são afetados | Sarna ou outras doenças parasitárias |
| Prurido após contato com água | Prurido aquagênico associado a doenças linfoproliferativas (p. ex, policitemia vera); | |
| Prurido durante o contato com a água (banho de chuveiro, banho de banheira) independentemente da temperatura ou durante o resfriamento da pele após o banho | ||
| Prurido durante/após exercício físico | Prurido colinérgico | |
| Prurido e icterícia | Câncer de pâncreas | |
| Hepatite colestática | ||
| Colestase intra‐hepática da gravidez | ||
| Prurido no inverno | Xerosis | |
| Eczema asteatótico | ||
| Prurido com sintomas B (perda ponderal, sudorese noturna encharcada, febre e prurido generalizado) | Neoplasias internas | |
| Linfomas (como doença de Hodgkin, leucemia linfocítica crônica) |
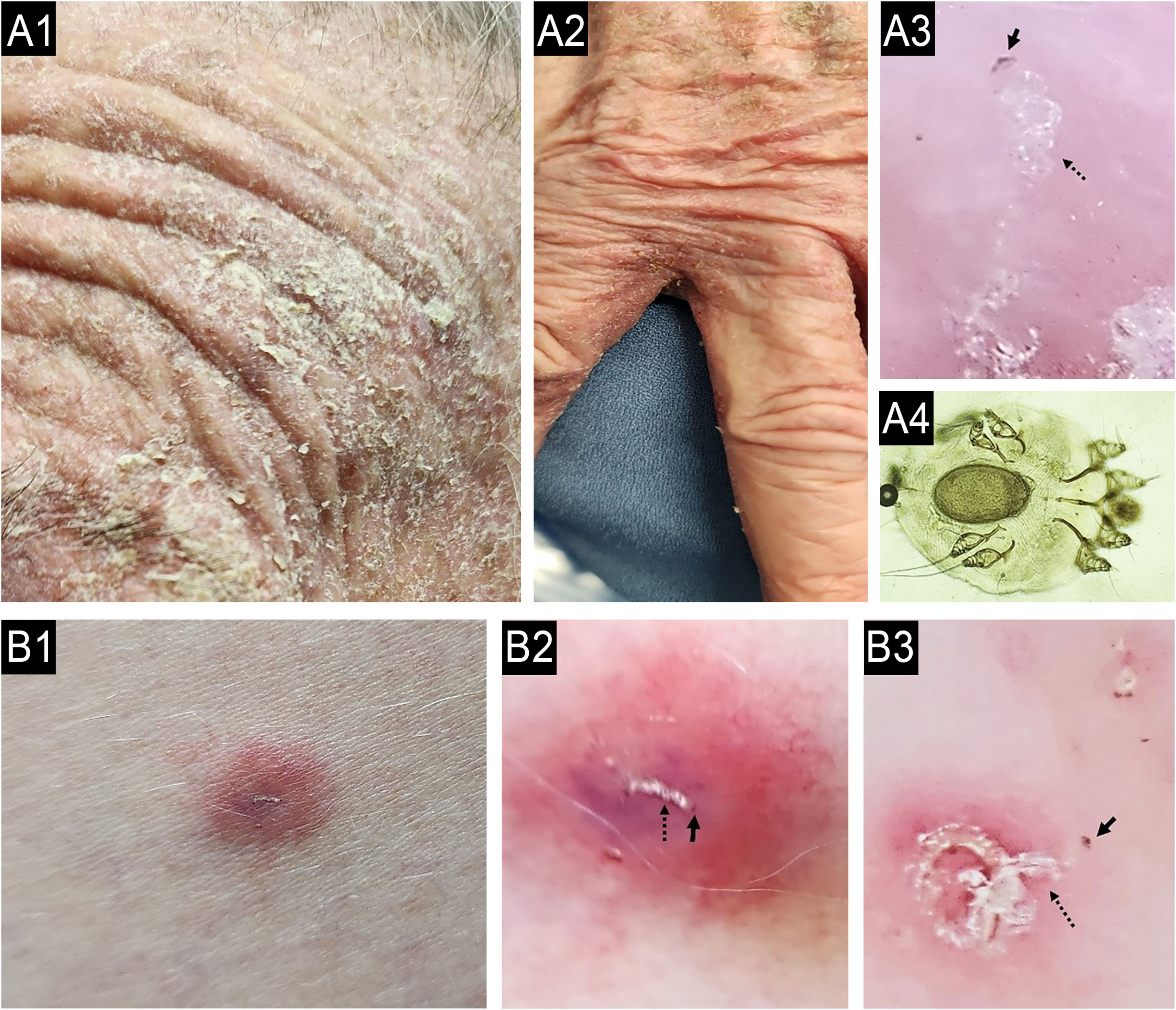
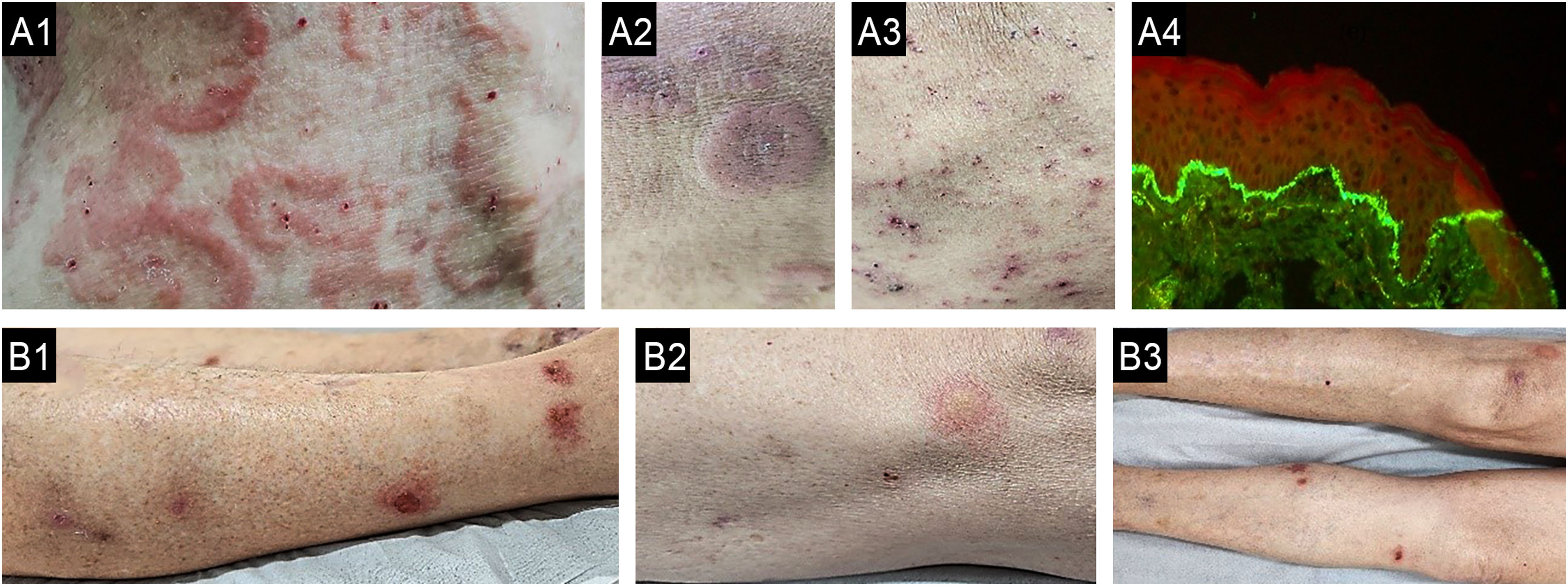
Quando uma dermatose primária está presente, o diagnóstico diferencial pode ser definido por meio de consideração cuidadosa da história clínica e do exame dermatológico.34 Infelizmente, o PC tem sido diagnosticado erroneamente em todo o mundo, atribuído principalmente ao diagnóstico e tratamento incorretos de pacientes com sarna crônica, especialmente em apresentações atípicas (fig. 4). Portanto, o exame dermatoscópico e o exame microscópico direto tornam‐se críticos para os dermatologistas.35,36
(A) Caso de prurido crônico diagnosticado erroneamente como reação adversa a medicamentos (caso A1‐4) e outro (B) como DA (caso B1‐3) apresentando‐se como escabiose sub‐reptícia, diagnosticado por dermatoscopia e raspagem direta da pele guiada por dermatoscopia. A: Paciente do sexo feminino, 87 anos, portadora de prurido crônico havia sete meses, apresentou história de 15 dias de internação com hipótese clínica de reação adversa a medicamentos. A1: Lesões eritematosas‐descamativas na face. A2: Lesões interdigitais eritematosas descamativas nas mãos. A3: Dermatoscopia da área interdigital mostrando “jato com sua fumaça” (burrow's acari) (seta preta pontilhada) e o “sinal de asa delta” (seta preta completa; aumento de 30×). A4: Microscopia óptica (coloração KOH, aumento de 800x×) das escamas coletadas da pele orientada por exame de dermatoscopia, uma fêmea adulta de Sarcoptes scabei var. mostrando um ovo em seu corpo. (B) Paciente do sexo feminino que sofria de prurido crônico e pápulas dispersas no tronco durante os últimos seis meses, diagnosticada erroneamente como DA do adulto, tratada nos primeiros três meses com upadacitinibe 30mg/dia, e depois em virtude de prurido intratável, o médico associou dupilumabe ao tratamento. B1: Pápulas eritematosas na região lateral da coxa. B2: Dermatoscopia mostrando o “jato com sua fumaça” (seta preta pontilhada) e seta preta inteira demonstrando o “sinal da asa delta”, aumento de 10×. B3: Dermatoscopia de lesões plantares mostrando “jato com sua fumaça” (burrow's acari; seta preta pontilhada) e o “sinal de asa delta” (seta preta completa; aumento de 400×).
A histopatologia em dermatoses cutâneas, incluindo coloração pela hematoxilina & eosina (H&E), imuno‐histoquímica (especialmente nos casos em que linfoma cutâneo é diagnóstico diferencial) e imunofluorescência direta (para descartar dermatoses autoimunes) pode ser extraordinariamente útil nesse cenário se a etiologia não for prontamente evidente apenas na história e no exame físico.34 Alguns exames laboratoriais relevantes (p. ex., níveis séricos de IgE, contagem de eosinófilos no sangue periférico, imunofluorescência indireta) são muito úteis para o diagnóstico etiológico no PC.37–39
- ii)
Prurido crônico secundário a doenças internas ou sistêmicas
Normalmente, apresenta‐se como prurido generalizado sem lesão cutânea primária da pele.2 A causa mais atribuível de prurido generalizado em pacientes com doença sistêmica subjacente foi a anemia ferropriva, que respondeu à reposição de ferro.2 Em todos os casos de prurido generalizado sem erupção cutânea (GPWOR, do inglês generalized pruritus without rash), especialmente quando há suspeita de perda de ferro, é importante perguntar sobre dieta (vegetariana ou vegana), fontes potenciais de perda de sangue, cirurgia bariátrica anterior e sintomas gastrintestinais. Em alguns pacientes, a reposição de ferro leva à interrupção completa do prurido logo após a introdução da terapia com ferro.2
Quando há suspeita de deficiência de ferro, mas os níveis de ferritina parecem estar dentro da faixa “normal”, pode ser necessário verificar também o ferro sérico e a capacidade total de ligação ao ferro. A tentativa de reposição de ferro deve ser considerada se os níveis de ferritina estiverem abaixo do limite inferior do intervalo de referência (15 a 25μg/L) ou se houver anemia ou microcitose não atribuível a outras causas (p. ex., sangramento gastrintestinal, perda urinária, traço de talassemia ou policitemia). Indivíduos com deficiência de ferro não explicável também devem ser testados para anticorpos de transglutaminase tecidual (TTG), particularmente anticorpos anti‐transglutaminase‐2, desde que não tenham excluído o glúten de sua dieta por pelo menos seis semanas. Se os resultados do teste de TTG forem anormais, recomenda‐se o encaminhamento a um gastroenterologista para consideração de endoscopia e biopsia com histopatologia do intestino delgado. A histopatologia pode ser indicada mesmo com resultado negativo de TTG, pois a deficiência de IgA, que é relativamente comum, pode levar a medida de TTG falsamente negativa.2
Sobrecarga de ferroTambém pode estar associada a prurido generalizado, seja em associação com hemocromatose ou hiperferritinemia na ausência de hemocromatose.2
Neoplasias hematológicas e outras neoplasias malignas relacionadas ao prurido crônicoEstudo de coorte retrospectivo foi realizado em nível populacional incluindo 327.502 pacientes elegíveis diagnosticados com prurido não especificado com controles pareados. Compreenderam 68,1% mulheres, 59,3% de raça branca, 22,2% de raça negra e média de idade de 42,2±22 anos. Os pacientes com prurido apresentaram risco aumentado de linfoma de Hodgkin em um ano (RR=4,42; IC95% 2,83‐6,88), leucemia mieloide (RR=2,56; IC95% 1,79‐3,67), mieloma múltiplo (RR=2,38; IC95% 1,66‐3,42), linfoma não Hodgkin (RR=2,35; IC95% 1,96‐2,82), gamopatia monoclonal (RR=1,90; IC95% 1,55‐2,32), síndrome mielodisplásica (RR=1,74; IC95% 1,14‐2,64) e leucemia linfocítica (RR=1,47; IC95% 1,07‐2,02).40 Os autores concluíram que o prurido não diferenciado é maior nos primeiros 12 meses, e a LDH (lactato desidrogenase) tem utilidade diagnóstica limitada nesses pacientes. Os profissionais devem rastrear pacientes com prurido não diferenciado para neoplasias malignas hematológicas, como indicado clinicamente.40 Em pacientes com PC sem diagnósticos dermatológicos concomitantes, idade avançada, gênero masculino, doença hepática e abuso de tabaco aumentam as chances de neoplasia maligna subjacente.41
O prurido pode ser um pródromo de neoplasia maligna, muitas vezes aparecendo antes de outros sinais e sintomas. É particularmente comum em neoplasias hematológicas, com estimativas de prevalência de até 30% em pacientes com linfoma de Hodgkin, 15% naqueles com linfoma não Hodgkin e 67% em pacientes com policitemia vera. Os distúrbios linfoproliferativos provavelmente envolvem a expressão de citocinas relacionadas a Th2, incluindo IL‐3 e TSLP.39
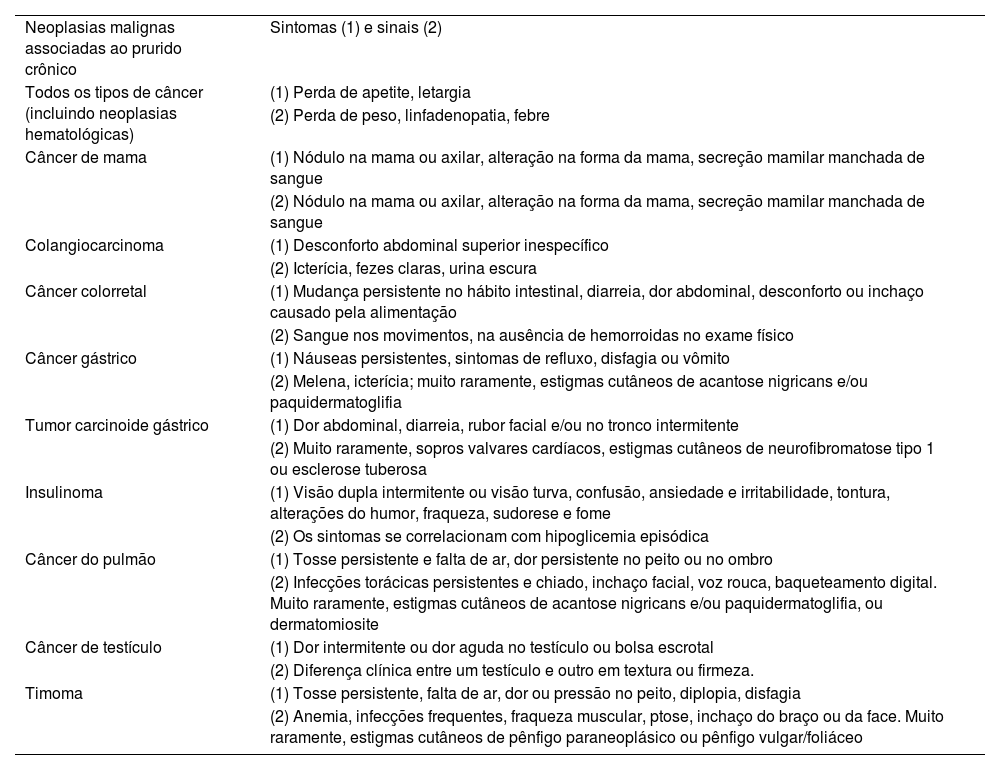
Pacientes com policitemia vera geralmente apresentam prurido aquagênico, desencadeado pelo contato com água em qualquer temperatura, geralmente minutos após a exposição, e geralmente mais grave com água quente. Outras condições hematológicas também podem se manifestar com prurido generalizado, que pode ser acompanhado por achados cutâneos eczematosos, urticariformes ou liquenificados, como na síndrome hipereosinofílica. Entre os tumores sólidos, há associação notável entre prurido e câncer do sistema hepatobiliar. Embora os tumores malignos sólidos sejam causa relativamente rara de prurido, a tabela 5 destaca as neoplasias malignas associadas ao PC e suas características clínicas.39
Características clínicas (sintomas e sinais) de alguns cânceres associados ao prurido crônico
| Neoplasias malignas associadas ao prurido crônico | Sintomas (1) e sinais (2) |
| Todos os tipos de câncer (incluindo neoplasias hematológicas) | (1) Perda de apetite, letargia |
| (2) Perda de peso, linfadenopatia, febre | |
| Câncer de mama | (1) Nódulo na mama ou axilar, alteração na forma da mama, secreção mamilar manchada de sangue |
| (2) Nódulo na mama ou axilar, alteração na forma da mama, secreção mamilar manchada de sangue | |
| Colangiocarcinoma | (1) Desconforto abdominal superior inespecífico |
| (2) Icterícia, fezes claras, urina escura | |
| Câncer colorretal | (1) Mudança persistente no hábito intestinal, diarreia, dor abdominal, desconforto ou inchaço causado pela alimentação |
| (2) Sangue nos movimentos, na ausência de hemorroidas no exame físico | |
| Câncer gástrico | (1) Náuseas persistentes, sintomas de refluxo, disfagia ou vômito |
| (2) Melena, icterícia; muito raramente, estigmas cutâneos de acantose nigricans e/ou paquidermatoglifia | |
| Tumor carcinoide gástrico | (1) Dor abdominal, diarreia, rubor facial e/ou no tronco intermitente |
| (2) Muito raramente, sopros valvares cardíacos, estigmas cutâneos de neurofibromatose tipo 1 ou esclerose tuberosa | |
| Insulinoma | (1) Visão dupla intermitente ou visão turva, confusão, ansiedade e irritabilidade, tontura, alterações do humor, fraqueza, sudorese e fome |
| (2) Os sintomas se correlacionam com hipoglicemia episódica | |
| Câncer do pulmão | (1) Tosse persistente e falta de ar, dor persistente no peito ou no ombro |
| (2) Infecções torácicas persistentes e chiado, inchaço facial, voz rouca, baqueteamento digital. Muito raramente, estigmas cutâneos de acantose nigricans e/ou paquidermatoglifia, ou dermatomiosite | |
| Câncer de testículo | (1) Dor intermitente ou dor aguda no testículo ou bolsa escrotal |
| (2) Diferença clínica entre um testículo e outro em textura ou firmeza. | |
| Timoma | (1) Tosse persistente, falta de ar, dor ou pressão no peito, diplopia, disfagia |
| (2) Anemia, infecções frequentes, fraqueza muscular, ptose, inchaço do braço ou da face. Muito raramente, estigmas cutâneos de pênfigo paraneoplásico ou pênfigo vulgar/foliáceo |
O prurido generalizado em neoplasias malignas é geralmente multifatorial.2 Pode ser sintoma paraneoplásico verdadeiro, característica das dermatoses paraneoplásicas, secundário à neuropatia paraneoplásica, consequência do envolvimento secundário da pele por tumores primários cutâneos ou não cutâneos ou efeito colateral do tratamento oncológico.2 O prurido paraneoplásico é definido como prurido que surge no início da neoplasia maligna ou mesmo precede seu diagnóstico clínico. Não é causado pela invasão ou compressão da massa neoplásica e geralmente apresenta resolução após a remoção do tumor.42 As doenças de pele paraneoplásicas associadas a prurido de intensidade variável podem ser classificadas em dois grupos: (i) síndromes paraneoplásicas, que incluem eritrodermia, síndrome de Bazex, doença de Grover, sinal de Lesser‐Trélat, granuloma anular generalizado, dermatomiosite e acantose nigricans maligna, e (ii) neoplasias malignas associadas, que abrangem neoplasias malignas hematológicas e cânceres de cabeça e pescoço, vias aéreas superiores, trato digestivo, cólon, mama, ovários e nasofaringe.43 Embora se acredite que o prurido seja sintoma incomum em outras neoplasias sólidas, houve relatos de casos de prurido ocorrendo em pacientes com carcinoma de pulmão de células não pequenas, insulinoma, tumores carcinoides gástricos e outras neoplasias sólidas.39 Sensação de prurido e queimação é relatada por pacientes com síndrome de glucagonoma. Pacientes com PC não explicado que sugere a possibilidade de neoplasia maligna subjacente incluem idade avançada, gênero masculino, possível doença hepática e uso crônico de tabaco.2 Além disso, vários tratamentos contra o câncer, incluindo radioterapia, podem levar ao prurido por uma variedade de mecanismos.2
Prurido paraneoplásico deve ser suspeitado em especial quando o PC tem duração menor do que 12 meses.2 Muitos tratamentos contra o câncer, incluindo a radioterapia, podem levar ao prurido por uma variedade de mecanismos. O tratamento da neoplasia maligna subjacente geralmente pode aliviar o prurido. Quando ocorre o prurido induzido por medicamentos anticancerígenos, pode ser necessário modificar ou interromper a medicação desencadeante. E terapias biológicas agora são comumente usadas em oncologia.2 Uma metanálise recente de 33 ECRs concluiu que o prurido foi efeito colateral significante do tratamento do câncer com essa classe de agente.44 O prurido é efeito colateral comum dos inibidores do fator de crescimento epidérmico, que têm mecanismos de ação biológicos ou intracelulares.2 Pacientes oncológicos que recebem terapias biológicas ou quimioterapia (que podem causar prurido por mecanismos distintos, por exemplo, induzindo neuropatia de fibras pequenas) devem ser questionados sobre o prurido na revisão.2
Prurido crônico relacionado a distúrbios renaisO prurido é sintoma comum na doença renal crônica avançada, afetando 40% a 90% dos pacientes em hemodiálise. O prurido associado à doença renal crônica está ligado à xerose urêmica e/ou neuropatia, inflamação sistêmica e desequilíbrio no sistema receptor opioide, caracterizado pelo aumento da atividade do receptor μ‐opioide e diminuição da atividade do receptor κ‐opioide. O hiperparatireoidismo secundário decorrente de doença renal crônica também foi sugerido como causa potencial de prurido generalizado, embora o mecanismo permaneça obscuro. Essa hipótese é apoiada por pequenos estudos de coorte que observaram melhora no prurido após a paratireoidectomia.19,39
Prurido crônico relacionado a distúrbios endócrinosO prurido é mais prevalente em pacientes diabéticos do que em controles saudáveis, com taxas de 26% em comparação com 15%. O prurido no diabetes mellitus (DM) pode resultar dos efeitos deletérios dos níveis elevados de glicose nas fibras nervosas cutâneas, muitas vezes manifestando‐se como consequência da polineuropatia diabética, particularmente da neuropatia de fibras pequenas. Outros distúrbios endócrinos que podem desencadear o prurido incluem hipertireoidismo e hipotireoidismo.39
Prurido crônico relacionado a distúrbios hepatobiliaresA colestase de doenças hepatobiliares é causa comum de prurido. Essas condições incluem causas primárias e secundárias de obstrução biliar, como colangite biliar primária, colangite esclerosante primária, hepatite autoimune, colestase intra‐hepática da gravidez, hepatite viral e cirrose. O prurido colestático surge de interação complexa de fatores, incluindo ácidos biliares, ácido lisofosfatídico, bilirrubina e aumento da atividade do receptor μ‐opioide.39 O prurido colestático é frequentemente caracterizado por coceira que afeta inicialmente as palmas das mãos e as solas dos pés, tornando‐se mais generalizada à medida que a doença progride. Acredita‐se que os mecanismos por trás do prurido associado ao HCV envolvam colestase induzida pelo HCV e a indução de genes estimulados por interferona em virtude de sobrecarga viral.20
Na população pediátrica existem algumas etiologias distintas associadas ao PC: colangite esclerosante primária (prurido em 30% desses pacientes), atresia biliar, síndrome de Alagille (45% dos pacientes têm prurido), colestase intra‐hepática familiar progressiva (prurido em 76% a 100%) e colestase intra‐hepática recorrente benigna.39
Outras etiologias sistêmicas para prurido crônico, incluindo infestações e infecçõesEmbora sua fisiopatologia exata ainda não tenha sido totalmente elucidada, outras etiologias potenciais de prurido podem incluir exposição a metais pesados, deficiências vitamínicas, HIV e outras infecções virais. Níveis sanguíneos elevados de metais pesados, como cádmio e chumbo, têm sido associados à PC. Além disso, baixos níveis de vitamina D foram observados em pacientes com doenças crônicas pruriginosas da pele, incluindo DA, psoríase e urticária crônica. Baixos níveis de vitamina B12 foram observados em pacientes com prurido generalizado por várias causas sistêmicas.39
O prurido é comumente relatado em pacientes com infecções virais, particularmente aqueles que vivem com HIV, onde se correlaciona diretamente com a carga viral e pode estar associado à eosinofilia e foliculite eosinofílica. PC é comorbidade significante em pacientes HIV‐positivos, afetando 13% a 45% dessa população.39 Muitos pacientes HIV‐positivos também apresentam distúrbios pruriginosos concomitantes, incluindo líquen simples crônico, PN, sarna, dermatite seborreica, micose fungoide e psoríase. Além disso, o prurido nesses pacientes pode ser causado por xerose, terapias medicamentosas e fotossensibilidade.2
Eosinofilia e prurido generalizado são características de infecções parasitárias, notadamente helmintos como Strongyloides stercoralis, mas também oncocercose, dermatite por cercárias (decorrente de penetração na pele por cercárias de esquistossomos ou Trichobilharzia spp. na Europa Ocidental).2 Em áreas tropicais, o prurido pode ser característica de arbovírus como dengue, Zika e, menos frequentemente, infecção por Chikungunya.2,45
Um estudo prospectivo francês acompanhou 95 pacientes com prurido sine materia durante período de cinco anos (1996 a 2001). Em 40% dos casos (38 pacientes), foi identificada causa sistêmica. As principais condições incluíram toxocaríase (oito casos), doenças hematológicas (sete casos), insuficiência renal crônica (seis casos), hipotireoidismo (cinco casos) e deficiência de ferro (cinco casos). Neoplasias foram encontradas em oito casos (8,42%): sete envolviam neoplasias hematológicas (três mieloma, dois doença de Hodgkin, dois síndromes mieloproliferativas) e um envolvia tumor sólido (adenocarcinoma pulmonar). A toxocaríase, doença frequentemente subestimada, foi a condição mais frequentemente identificada.46
A toxocaríase humana é doença parasitária caracterizada pela presença de larvas do gênero Toxocara em tecidos humanos.47Toxocara canis e T. cati, encontrados nos intestinos de cães e gatos, respectivamente, são os agentes causadores mais comuns da doença.47 As larvas de Toxocara geralmente causam duas síndromes graves: larva migrans visceral e larva migrans ocular, dependendo da localização das larvas.47
- iii)
Prurido crônico relacionado a condições neurogênicas, neuropáticas ou do sistema nervoso central
As condições pruriginosas neuropáticas podem ser originadas do sistema nervoso periférico ou do SNC.21
As condições originadas do sistema nervoso periférico são:21
- a)
Neuropatia de fibras pequenas: metabólica, induzida por medicamentos, infecciosa ou de origem genética (o prurido começa geralmente distalmente e pode se generalizar);
- b)
Cicatrizes e queimaduras: iatrogênicas ou traumáticas (prurido na pele lesionada);
- c)
Radiculopatias: compressão de um nervo periférico por alterações degenerativas ou lesões que ocupam espaço (prurido e disestesias no dermátomo afetado);
- d)
Neuralgia pós‐herpética: lesão do nervo periférico pelo vírus varicela‐zóster (prurido e disestesias no dermátomo afetado);
- e)
Síndrome trófica do trigêmeo: lesão das fibras sensoriais do nervo trigêmeo (disestesia unilateral e hipoestesia da face central. Ulceração autoinduzida da asa nasal, região bucinadora e lábio superior).
As condições originadas do sistema nervoso central são:21
- a)
Lesões que ocupam espaço: tumores, abscessos, lesões vasculares, siringomielia (características clínicas de acordo com as estruturas neurais afetadas);
- b)
Acidente vascular encefálico: isquêmico ou hemorrágico (prurido generalizado ou unilateral);
- c)
Esclerose múltipla: doença desmielinizante (prurido generalizado ou localizado na cabeça e parte superior das costas);
- d)
Neuromielite óptica: doença desmielinizante (dependendo do nível da coluna vertebral lesada);
- e)
Doenças infecciosas: meningite, encefalite, doença priônica;
- f)
Lesões traumáticas do cérebro ou da medula espinhal: acidentes ou lesões iatrogênicas.
Em geral, inclui prurido braquiorradial, notalgia parestésica, meralgia parestésica, prurido do couro cabeludo (excluindo doenças dermatológicas), gonalgia parestésica (lesão do nervo safeno), prurido anogenital e outras condições.48 Este último é causado por danos diretos ao próprio nervo.48 Embora condições específicas de prurido tenham contribuintes predominantes para sua patogênese, é mais provável que haja várias etiologias.48
O prurido neuropático refere‐se a um grupo de distúrbios caracterizados por PC causado por disfunção ou danos aos pruriceptors.48 Nessas condições, o prurido não é desencadeado por estímulos externos, como irritantes ou alérgenos, mas surge espontaneamente.20 O prurido neuropático pode ocorrer por danos nos nervos que podem ser causados por lesões mecânicas, metabólicas, inflamatórias ou citopáticas.48
A hipersensibilidade neural do prurido é exibida condições comuns de prurido neuropático como as mencionadas a seguir.20 Prurido braquiorradial é caracterizado por prurido nos braços bilateralmente. É frequentemente associado à compressão ou irritação dos nervos da coluna cervical.20 Notalgia parestésica é condição comum de PC caracterizada por coceira localizada ou sensação de queimação na região subescapular e pode ser causada por danos no nervo torácico ou irritação na área afetada.20 O prurido pós‐herpético é complicação do herpes‐zóster em virtude de danos aos nervos causados por alterações citopáticas virais.20 Por fim, o prurido do couro cabeludo é neuropático quando ocorre independentemente de qualquer erupção cutânea observável (p. ex., dermatite seborreica).20 O dano aos nervos occipitais da coluna cervical causa prurido no couro cabeludo.20
A automutilação indolor causada pelo prurido neuropático é muito mais comum na face do que em qualquer outra parte do corpo.49 O prurido é muito mais comum após o zóster afetar a face do que o tronco, por exemplo.49 A face também está despida e facilmente acessível aos dedos.49
A compressão das fibras nervosas pode causar prurido no dermátomo correspondente, e degeneração das fibras nervosas (como neuropatia de fibras pequenas) pode causar prurido localizado ou generalizado.4 A neuropatia de fibras pequenas pode ocorrer em doenças sistêmicas, como DM, síndrome de Guillain‐Barré, sarcoidose, neurofibromatose tipo 1 e HIV.2 A neuropatia diabética pode causar prurido regional que afeta o tronco.2 A neuropatia de fibras pequenas pode ser muito pequena para produzir alterações clínicas ou eletrofisiológicas, e a única investigação que pode revelar algo é a histopatologia da pele com coloração imuno‐histoquímica das fibras nervosas cutâneas.2
Sistema nervoso central, prurido e infestação deliranteLesões do SNC que afetam as vias sensoriais, como derrames, esclerose múltipla e hemangiomas cavernosos, podem causar prurido central. Danos aos neurônios que fazem a transdução, conduzem ou processam o prurido podem resultar em prurido neuropático. Há relatos de pacientes que desenvolveram novas lesões autoinfligidas décadas após derrames ou cirurgia do trigêmeo, muitas vezes exacerbadas pela demência, que causa coceira descontrolada. Causas menos comuns de prurido central incluem esclerose múltipla, tumores, abscessos cerebrais e síndrome de Sjögren. Casos raros também foram associados a derrames comprometendo a circulação anterior, particularmente aqueles que afetam o tálamo.49
Prurido neurogênicoNeurogênico é termo amplo que engloba processo patológico decorrente de alteração no nervo.20 Em outras palavras, tumores do nervo ou outras condições que nada têm a ver com sensação ou transmissão aferente ainda podem ser chamados de neurogênicos.20
Os nervos sensoriais podem contribuir para a neuroinflamação liberando neuropeptídeos, que inflamam os tecidos através de vias eferentes. Existem duas maneiras principais pelas quais os neurônios sensoriais podem causar prurido: (i) prurido neuropático, no qual a alteração do nervo leva à transmissão excessiva aferente de prurido para o SNC, e (ii) processos neuroinflamatórios, nos quais os neurônios sensoriais ativam células imunes ou outros intermediários para desencadear o prurido. Claro exemplo disso é a liberação da SP pelos neurônios sensoriais, que se liga ao membro X2 do receptor acoplado à proteína G relacionada a Mas nos mastócitos, levando à liberação de fatores pruritógenos, como histamina e LTC4 dos mastócitos.20
Excelente exemplo de prurido neurogênico é a urticária crônica induzível (CIndU, do inglês chronic inducible urticaria). Nessa condição, vários gatilhos neurológicos, incluindo estímulos térmicos (calor, frio), estímulos mecânicos (fricção, pressão, vibração) e estímulos autonômicos (acetilcolina), desencadeam urticária e prurido associado. CIndU exemplifica o prurido neurogênico, em que a coceira é iniciada pelo sistema nervoso na ausência de prurido neuropático clinicamente definido, provavelmente por meio da ativação de mastócitos intermediários. Além disso, acredita‐se amplamente que o PN também envolve processos neurogênicos subjacentes de prurido que desencadeiam o desenvolvimento de nódulos cutâneos.20
- iv)
Prurido crônico secundário a distúrbios somatoformes (psiquiátricos/psicossomáticos)
PC generalizado é comumente associado a vários transtornos psiquiátricos, incluindo depressão, transtornos de ansiedade, transtorno obsessivo‐compulsivo, abuso de substâncias e infestação delirante. O prurido somatoforme é caracterizado por prurido no qual fatores psicológicos, psiquiátricos e psicossomáticos desempenham papel crucial no início, intensidade, exacerbação ou persistência da condição.50
- v)
Prurido crônico de origem indeterminada/desconhecida (CPUO)
Uma vez que a doença cutânea pruriginosa subjacente e outras causas secundárias de prurido tenham sido excluídas, um indivíduo pode ser considerado portador de CPUO.2 A prevalência de prurido de causa desconhecida em indivíduos com prurido generalizado varia de 3,6% a 44,5%, com maior prevalência entre os idosos.13,51
A abordagem clínica inicial inclui história médica detalhada e exame físico completo (incluindo exame da pele total do corpo, palpação dos gânglios linfáticos, exame do fígado e do baço, ausculta pulmonar e cardíaca, palpação do abdome e da pelve).51 A investigação inicial deve incluir não apenas amostras de sangue, mas também urinálise, exame de rotina de fezes e sangue oculto, bem como radiografia de tórax (com relatório do radiologista a relatar), ultrassonografia de abdome e biopsia de pele para imunofluorescência direta.52 A tabela 6 descreve os principais exames laboratoriais e abordagens diagnósticas complementares para o paciente com CPUO.28
Investigação direcionada para pacientes com prurido crônico de origem desconhecida (CPUO)28
| Exames laboratoriais para todos os pacientes | Exames complementares em caso de lesões cutâneas primárias ou secundárias, se necessário | Prurido durante a gravidez | Outros exames/testes possíveis | Técnica de imagem (mesmo que o histórico médico, o exame físico e os exames laboratoriais não resultem em suspeita clínica específica, radiografia de tórax e ultrassonografia abdominal podem ser realizadas para procurar evidências de uma possível neoplasia maligna) | Cooperações interdisciplinares |
|---|---|---|---|---|---|
| Velocidade de hemossedimentação (VHS) e proteína C reativa (PCR) | Swabs bacteriológicos/micológicos | Em caso de achados cutâneos proeminentes: exame dermatológico para descartar erupção polimórfica da gravidez (EPG), penfigoide gestacional | Em caso de prurido anal: parasitas, ovos de vermes, toque retal, PSA | Raio X do tórax | Achados neurológicos e/ou psiquiátricos |
| Hemograma completo com ferritina diferencial, | Biopsia de pele (histopatologia, imunofluorescência direta, microscopia eletrônica) | Em caso de prurido aquagênico e genital, prurido de origem desconhecida: teste de intolerância à lactose/sorbitol | Ultrassonografia abdominal (incluindo linfonodos retroperitoneais) | ||
| Bilirrubina, transaminases (GPT [ALT], GOT [AST]), gamaglutamil transpeptidase (GGT), fosfatase alcalina, | Detecção de ácaros da sarna | Na ausência de achados cutâneos proeminentes: exames laboratoriais básicos (ver acima) associados a ácidos biliares (jejum) | Em caso de anormalidades no hemograma (p. ex., bicitopenia)/suspeita de doenças linfoproliferativas: vitamina B12, ácido fólico, eletroforese de proteínas, imunofixação, imunofenotipagem do sangue periférico (painel proliferativo), status de JAK2, biopsia da medula óssea (se necessário) com (imuno)citologia e histopatologia | Ultrassonografia de linfonodos (cervical, supraclavicular, axilar, inguinal), punção/extirpação (se necessário) | Cooperação com outros médicos e especialistas: medicina geral, alergologia, dermatologia, medicina interna (gastroenterologia, hepatologia, endocrinologia, hematologia e oncologia médica), urologia, ginecologia e outros |
| Ultrassom da tireoide | |||||
| Creatinina, ureia, taxa de filtração glomerular estimada (egfr), K+, urinálise (tira de teste) | Gastroscopia (com biopsia e pesquisa de Helicobacter pylori, se necessário), colonoscopia (com biopsia, se necessário) | ||||
| Nível de glicose no sangue (jejum) | Em caso de deficiência de ferro/irregularidades nas fezes: pesquisa de guaiaco nas fezes | TC, RM, CPRM, cintilografia (se necessário), CPRE (se necessário), biopsia hepática (se necessário) | |||
| Lactato Desidrogenase (LDH) | Em caso de suspeita de doença hepatobiliar: sorologia para hepatite (anti‐HAV, HBsAg, anti‐HBc, anti‐HCV), ácidos biliares, anticorpos antimitocondriais (AMA), anticorpos anticitoplasma de neutrófilos perinucleares (pANCA), anticorpos antinucleares | ||||
| Hormônio estimulante da tireoide (TSH) | (ANA), anticorpos anti‐músculo liso (SMA), anticorpos anti‐antígeno hepático solúvel (SLA), anticorpos microssomais anti‐fígado‐rim (LKM), anticorpos anti‐transglutaminase tecidual, alfafetoproteína (em caso de cirrose hepática/massa hepática) | ||||
| Hemograma completo com ferritina diferencial | |||||
| Em caso de níveis anormais de glicose em jejum: HbA1c, teste de tolerância à glicose | |||||
| Em caso de alterações cutâneas primárias ou secundárias: imunofluorescência direta e indireta, autoanticorpos contra proteínas dérmicas (BP180, BP230, desmogleína) | |||||
| Em caso de suspeita de alergia: IgE total, IgE específica (se necessário), teste de puntura, teste de contato | |||||
| Em caso de suspeita de doenças endócrinas: hormônio da paratireoide, fosfato, Ca2+, fT3, fT4, colecalciferol 25‐OH, anticorpos antirreceptor de TSH (TRAb), anticorpos antitireoperoxidase (TPO‐Ab) | |||||
| Em caso de suspeita de HIV: sorologia para HIV, sorologia para sífilis (se necessário) | |||||
| Em caso de suspeita de mastocitose: níveis de triptase | |||||
| ‐ Em caso de suspeita de tumores neuroendócrinos: cromogranina A | |||||
| ‐ Coleta de urina de 24h: porfirinas (porfiria), ácido 5‐hidroxi‐indolacético (tumores neuroendócrinos), ácido metilimidazol‐acético (mastocitose) |
Entretanto, em alguns casos, a causa subjacente permanece obscura e é chamada de CPUO.51 Como o CPUO é diagnóstico de exclusão, os pacientes que sofrem com essa condição são reexaminados periodicamente.51
CPUO pode afetar pacientes mais jovens, mas é altamente prevalente naqueles com mais de 65 anos.2 Embora acredite‐se que muitos fatores estejam subjacentes à CPUO, as alterações fisiológicas associadas ao envelhecimento provavelmente contribuem, incluindo disfunção da barreira epidérmica, neuropatia sensorial, imunossenescência e envelhecimento, caracterizados por estado pró‐inflamatório com respostas imunes tipo 2 aprimoradas e imunidade tipo 1 reduzida.53
Nos idosos, além da possibilidade de neoplasia maligna interna e linfoma cutâneo, há duas condições crônicas de prurido que devem ser lembradas: formas atípicas de penfigoide bolhoso54,55 e dermatoses eosinofílicas em relação com neoplasia maligna hematológica (fig. 5) (tabela 7).56
- vi)
Prurido crônico induzido por medicamentos
Condições pruriginosas crônicas incomuns encontradas em pacientes idosos: penfigoide bolhoso atípico (PBA) (A) e dermatoses eosinofílicas com neoplasia maligna hematológica (B). Lesões atípicas de penfigoide bolhoso. A1: Lesões semelhantes à urticária anular com lesões crostosas hemáticas escoriadas. A2: Placas urticariformes semelhantes a vasculite urticariforme. A3: Lesões crostosas eczematosas eritematosas, com pápulas escoriadas exibindo crostas hemáticas e lesões residuais hipercrômicas. A4: Imunofluorescência direta positiva para IgG em padrão granular na zona da membrana basal da pele, obtida em pele de aparência normal de paciente do sexo feminino de 69 anos com queixa de dois anos de prurido crônico. Dermatose eosinofílica em neoplasia maligna hematológica: imagem de paciente com prurido crônico por dois anos após Covid‐19, com contagem progressiva elevada de linfócitos no hemograma total e diagnóstico de leucemia linfocítica crônica. B1: Imagem mostrando lesões eritematosas escoriadas e ulceradas nos tornozelos. B2: Lesão urticariforme semelhante à picada de insetos. B3: Várias lesões escoriadas nas pernas devido ao prurido crônico intenso.
Condições especiais associadas ao prurido em pacientes idosos46–48
| Condição da pele | Características distintas |
|---|---|
| Penfigoide bolhoso atípico (PBA) | Em até 20% dos casos de PB o início é caracterizado por uma fase não bolhosa.47 Manifestações atípicas de PB descritas como:47 PB não bolhoso, anular‐símile; eritema multiforme‐símile; penfigoide nodular; líquen plano penfigoide; eritrodérmico esfoliativo; PB vegetante; PB pré‐tibial e PB induzido por medicamentos ou pós‐irradiação (PUVA, terapia UVB de banda estreita, terapia fotodinâmica ou radioterapia) |
| Entretanto, todos os casos de PB atípico têm as mesmas características imunopatológicas da forma clássica.46 Os achados histopatológicos e de imunofluorescência direta (IFD) e a detecção de autoanticorpos circulantes, por imunofluorescência indireta (IFI), ensaio de imunoadsorção enzimática (ELISA) ou immunoblotting são os elementos‐chave para o diagnóstico correto.46,47 A IFD da pele perilesional mostra deposição linear contínua de IgG (70% a 90% dos pacientes) ou C3 (90% a 100% dos pacientes), ou ambos, ao longo da zona da membrana basal (ZMB).47 Estudos de IFI podem demonstrar em 60% a 80% dos pacientes a presença de autoanticorpos IgG circulantes que normalmente se ligam ao lado epidérmico da pele humana normal submetida à técnica de salt‐split skin.47 Os autoanticorpos circulantes podem ser detectados por ensaio imunoenzimático (ELISA), com sensibilidade de até 100% quando vários ELISAs usando o domínio NC16A e outras porções extracelulares de BP180 ou de BP230 são usados juntos. Hoje em dia, o ELISA substituiu principalmente as técnicas de immunoblotting e imunoprecipitação, que são técnicas válidas, mas não muito fáceis para testes de rotina | |
| Cozzani et al. sugeriram critérios diagnósticos para penfigoide bolhoso atípico: | |
| Critérios principais: | |
| a) IFD de pele perilesional mostrando deposição linear contínua de IgG, C3 ou ambas | |
| b) Detecção de anticorpos circulantes contra BP 180 e/ou 230 por ELISA e/ou IFI em pele submetida à técnica de salt‐split skin (com deposição de IgG e C3 no teto da bolha) | |
| Critérios menores: | |
| c) Prurido (coceira) | |
| d) Achados histopatológicos: | |
| Fases iniciais: fendas subepidérmicas, espongiose eosinofílica e/ou infiltrado de eosinófilos na derme superior e na junção dermoepidérmica | |
| Lesões estabelecidas: bolhas subepidérmicas, ausência de acantólise, infiltrado dérmico superficial de eosinófilos | |
| Aspectos clínicos polimórficos: bolhas grandes, tensas serosas ou bolhas hemorrágicas disseminadas na pele pruriginosa eritematosa, urticariforme ou aparentemente normal; placas eritematosas ou urticariformes; lesões policíclicas, anulares, figuradas; nódulos escoriados hiperceratóticos; pápulas planas, púrpuras poligonais, pruriginosas; pequenas vesículas; eritrodermia; lesões purulentas vegetantes, crostosas | |
| O diagnóstico definitivo de PB requer: 2 critérios maiores ou 1 critério maior e 2 critérios menores | |
| Dermatose eosinofílica associada a neoplasia hematológica (DENH) | As lesões cutâneas compostas por eosinofilia tecidual que surgem no contexto de doença hematológica são conhecidas como dermatose eosinofílica de neoplasia hematológica. A neoplasia maligna mais associada é a leucemia linfocítica crônica (LLC), embora também tenha sido relatada em associação com outras neoplasias hematológicas de células B (linfoma de células do manto, leucemia linfoblástica aguda, linfoma de grandes células, mieloma múltiplo) e com leucemia monocítica aguda, mielofibrose e processos não malignos, como infecção por HIV e agamaglobulinemia congênita |
| A DENH é condição rara com ampla variedade de apresentações clínicas, desde pápulas, nódulos eritematosos ou bolhas que simulam picadas de artrópodes, até a formação de placas verdadeiras de diferentes tamanhos. A apresentação clínica assume a forma de pápulas pruriginosas ou nódulos urticariformes que lembram picadas de artrópodes. Também foram relatados casos envolvendo placas verdadeiras de tamanho variável e, ocasionalmente, lesões vesicobolhosas. As lesões geralmente afetam áreas expostas e não expostas da pele e ocorrem predominantemente nos membros. Os sintomas cutâneos se repetem em situações em que picadas de insetos seriam improváveis. O exame histopatológico da pele revela a presença de eosinófilos abundantes, infiltrado linfocítico inflamatório intersticial, rico em eosinófilos, perivascular e perianexial, que ocasionalmente se estende para o tecido subcutâneo. O infiltrado linfocítico é predominantemente composto por células T (CD3+, CD43+, CD45RO+); quando células B estão presentes, elas formam agregados policlonais. Normalmente, não são observadas células leucêmicas | |
| Os critérios diagnósticos para DENH incluem: | |
| a) Pápulas, nódulos pruriginosos e/ou erupção vesicobolhosa refratária ao tratamento padrão (como anti‐histamínicos, corticosteroides tópicos para prurido) | |
| b) Infiltrado linfo‐histiocítico rico em eosinófilos na derme superior e profunda | |
| c) Exclusão de outras causas de eosinofilia tecidual | |
| d) Diagnóstico prévio ou posterior de neoplasia hematológica |
Aproximadamente 5% dos casos de prurido são causados por medicamentos. O PC induzido por medicamentos pode ocorrer com ou sem erupção cutânea.2 Os mecanismos propostos de prurido induzido por medicamentos incluem colestase, deposição direta de medicamentos ou metabólitos, alteração da sinalização neural, fotodermatoses, xerose ou estimulação celular (p. ex., codeína); entretanto, a maioria dos casos é idiopática.2,19 O prurido induzido por opioides é comum e afeta 2% a 10% dos pacientes que recebem opioides orais, 10% a 50% intravenosos e 20% a 100% opioides peridurais e intratecais.2 Os responsáveis comuns pelo prurido induzido por medicamentos incluem inibidores de checkpoint imunológico;39 agentes direcionados ao receptor do fator de crescimento epidérmico, proto‐oncogene B‐Raf, proteína 4 associada a linfócitos T citotóxicos e proteína de morte celular programada‐1/ligante de morte celular programada‐1 (PD‐1/PD‐1L).39 A tabela 8 mostra os medicamentos mais frequentes que podem induzir PC.19,34
Medicamentos que podem induzir prurido crônico34
| Antibióticos | Amoxicilina, ampicilina, cefotaxima, ceftazidima, clindamicina, ciprofloxacina, eritromicina, minociclina, metronidazol, penicilina G, rifampicina, tetraciclinas, sulfametoxazol/trimetoprima, vancomicina, antifúngicos, antimaláricos |
| Agentes antiuricosúricos | Alopurinol, colchicina, probenecida, tiopronina |
| Agentes cardiovasculares | Amlodipina, amiodarona, candesartana, captopril, clonidina, diltiazem, enalapril, flecainida, irbesartana, lisinopril, metildopa, verapamil |
| Hormônios | Contraceptivos orais, corticosteroides, clomifeno, danazol, estrogênio, progesterona, testosterona, tamoxifeno |
| Agentes redutores de glicose | Metformina, glimepirida, gliclazida, gliptinas, tolbutamida |
| Agentes hipolipemiantes | Clofibrato, fenofibrato, fluvastatina, lovastatina, pravastatina, sinvastatina |
| Imunossupressores | Ciclosporina, ciclofosfamida, metronidazol, micofenolato de mofetil, talidomida, tacrolimus |
| Agentes oncológicos e biológicos | Adalimumabe, 5‐fluoracil, cetuximabe, clorambucil, erlotinibe, gefitinibe, gencitabina, infliximabe, ipilimumabe, nilotinibe, panitumumabe, paclitaxel, rituximabe, temsirolimus, tamoxifeno, vemurafenibe |
| Opioides e analgésicos | Ácido acetilsalicílico, codeína, celecoxibe, diclofenaco, fentanil, cetoprofeno, morfina, naproxeno, oxicodona, piroxicam |
| Neurolépticos, antiepilépticos e antipsicóticos | Amitriptilina, citalopram, clorpromazina, carbamazepina, haloperidol, fluoxetina, paroxetina, fenitoína, risperidona, sertralina, topiramato |
| Variados | Antitireoidianos, contraste com iodo, enoxaparina, interleucina‐2, hidroxietilamido (HES), pentoxifilina, ticlopidina |
A terapia do PC é bastante complexa e deve ser direcionada para sua causa quando encontrada. Existem, na maioria dos pacientes, principalmente em idosos, várias causas possíveis em um mesmo paciente, dificultando a identificação da origem do PC.57 A relação temporal entre determinada causa e o início do prurido pode fornecer dicas importantes sobre sua origem.57
As opções terapêuticas podem ser restritas em determinadas populações, como crianças, gestantes e lactantes ou em pacientes idosos em virtude de eventual concomitante fase da vida, comorbidades e comedicação.57 Em pacientes idosos, particularmente, a xerose cutânea está presente na maioria dos pacientes e pode ser efetivamente tratada com emolientes.57 As terapias sistêmicas devem ser usadas com cautela, especialmente em pacientes muito jovens ou idosos após a consideração de riscos e benefícios.57 Além disso, a “polifarmácia” frequentemente observada em pacientes idosos pode dificultar a escolha das opções terapêuticas disponíveis em virtude de possíveis interações com medicamentos antipruriginosos.57
Cuidados de suporte para pacientes com pruridoAs principais atitudes incluem prescrever o uso contínuo de agentes hidratantes, especialmente adequados para pacientes com DA e/ou pele sensível (tabela 9).58
Medidas gerais e tratamentos tópicos para prurido
| Medidas gerais50 |
|---|
| Redução da exposição a altas temperaturas e baixa umidade relativa do ar |
| Aparar as unhas para evitar escoriações |
| Evitar banhos longos |
| Evitar sauna para pacientes com prurido desencadeado por esses fatores; |
| Medidas de alívio (p. ex., usar roupas leves ou de fibras não sintéticas); |
| Evitar fumo, álcool, cafeína e outros estimulantes, especiarias e estresse; |
| Tomar banho de chuveiro é melhor do que banho de banheira, com água morna, por no máximo 10 minutos |
| Tomar banho com sabonete sem detergente (Syndet), óleos de banho ou creme de limpeza |
| Evitar produtos perfumados e substâncias irritantes, como lauril sulfato de sódio |
| Evitar tomar banho com sabonetes antibacterianos/antissépticos |
| Cremes emolientes ou hipoalergênicos, livres de fragrâncias e conservantes |
| Roupas de algodão macias e folgadas |
| Tratamentos tópicos | ||
|---|---|---|
| Medicamentos | Modo de usar | Observações |
| Hidrocortisona 1%28 | 1%, 2×/dia | Face e dobras ou pacientes com pele fina |
| Valerato de betametasona 0,1%28 | Tópico ou oclusivo, 1×/dia | Áreas de extensão |
| Tacrolimus 0,03% a 0,1%28Pimecrolimus28 | 2×/dia2×/dia | Prurido sensorial ou sensação de queimação local podem se apresentar durante as primeiras aplicações e podem ser reduzidas com ácido acetilsalicílico oral 500mg, inicialmente, e evitando o consumo de álcool34 |
| Capsaicina 0,025% a 0,1% creme34 | 4 a 6×/dia | Induz a ativação do TRPV1 com subsequente depleção de SP, dessensibilizando as fibras nervosas |
| Corticosteroides19,34 | Oclusivo ou intralesional | Deve‐se ter cuidado devido aos riscos de atrofia e hipopigmentação da pele |
| Loção de mentol 1%34 | 3 a 4×/dia | Atua através da via TRPM8 |
| Anestésicos tópicos34 | Aplicação transdérmica (3×/dia) | |
| Polidocanol 2% a 10% | Aplicação em área localizada (< 10% da área de superfície corporal, ASC) | |
| Formulação: lidocaína 2,5% a 5%+amitriptilina 5%+cetamina 5% a 10% creme o/a | Nunca exceder 30% da ASC | |
| Pramoxina 1% loção, creme, espuma, géis | 3 a 4×/dia | O resfriamento potencializa o alívio do prurido no prurido neuropático, através da ativação da fibra nervosa termorreceptiva tipo Aδ e C19 |
| Lidocaína 2 a 5% | 2 a 4×/dia | Ter cuidado com a ocorrência de metahemoglobinemia quando altas doses de EMLA® (lidocaína+prilocaína) são aplicadas em pacientes pediátricos. |
| Creme de doxepina a 5%34 | 4×/dia, 4/4h | Existem riscos de dermatite de contato, sensação local de prurido/queimação e efeitos anticolinérgicos (aplicados em <10% da área de superfície corporal, ASC) |
| Neurotoxina botulínica | Intralesional 2 a 10μ | Inibe a liberação de pruritógenos, como SP, CGRP e acetilcolina.19 Pequenos estudos trataram o prurido no líquen simples crônico e etiologias neuropáticas do prurido19 |
| Gabapentina 6% a 10%19 | 2 a 4×/dia | 6% para prurido urêmico e 10% para prurido do couro cabeludo |
| Sem efeitos adversos relacionados a medicamentos | ||
| Crisaborole‐119,49 | 2×/dia | Inibidor da fosfodiesterase 4 que reduz o prurido associado à DA |
| Outras alternativas | ||
| Fototerapia UVA ou UVB49 | Eficácia na DA, linfoma cutâneo de células T e no PC decorrente de doenças sistêmicas (por exemplo, doença renal terminal, colestase). Também pode ser um método de tratamento viável para prurido de origem desconhecida. | |
Para todas as modalidades de abordagem para tratar o PC, a experiência mostrou que leva muito tempo até que os pacientes respondam ao tratamento (até 12 semanas); em caso de interrupção do prurido, o tratamento não deve ser interrompido muito rapidamente (redução gradual ao longo de pelo menos quatro semanas).13 O advento dos inibidores da Janus Quinase (JAK) deu início a uma mudança de paradigma transformadora, proporcionando rápido alívio do prurido.59
Tratamento causalA gama de tratamentos causais para o prurido inclui abordar a dermatose subjacente, evitar alérgenos de contato, interromper medicamentos e empregar terapias sistêmicas, neurológicas e psiquiátricas específicas, bem como intervenções cirúrgicas para tumores. Em casos raros, tratar ou curar a doença subjacente pode levar à resolução do PC. Entretanto, existem exceções, como prurido de curto prazo associado à doença de Hodgkin e quimioterapia inicial, em que o prurido pode não apresentar resolução total, mesmo com o tratamento da condição subjacente.13
Tratamento tópicoNo PC, recomenda‐se terapia básica com emolientes isoladamente ou em combinação com agentes tópicos sistêmicos específicos e/ou fototerapia UV.13 A primeira escolha de tratamento tópico na pele lesionada são os corticosteroides tópicos, como hidrocortisona (na face ou áreas intertriginosas),60 valerato de betametasona ou inibidores de calcineurina (não combinar com fototerapia ultravioleta [UV]).13 Os inibidores da calcineurina podem ter uso particular em áreas finas e sensíveis da pele e uso prolongado em comparação com corticosteroides tópicos.61
Outro possível agente tópico com efeito antipruriginoso com relatos apenas em séries de casos ou relatos de casos é a capsaicina, indicada no prurido neuropático (notalgia parestésica, prurido braquiorradial, prurido pós‐herpético), prurido aquagênico ou urêmico.19 No caso de nódulos únicos residuais, o uso de injeção intralesional de corticosteroide intradérmico é alternativa possível.18,19
PC localizado pode ser tratado com outros agentes, mas o nível de recomendação é baseado em estudos de caso não controlados por placebo, como loção de mentol a 1% e anestésicos tópicos,19 antidepressivos/anti‐histamínicos tópicos, neurotoxina botulínica intralesional, gabapentina 6% a 10%, e inibidores da fosfodiesterase (crisaborol, difamilaste, roflumilaste).18,57
Fototerapia para prurido crônicoA fototerapia UV (p. ex., UVB de banda estreita [NB] 311nm) constitui opção interessante para todos os pacientes, incluindo a população idosa, pois é bem tolerada, com poucos efeitos colaterais e interações medicamentosas.19,57 Longos ciclos de tratamento levam ao envelhecimento da pele e podem aumentar o risco de câncer de pele epitelial.54
As lâmpadas Excimer também diminuem a densidade das fibras nervosas intraepiteliais.19 UVA1 (340‐400nm) diminui os níveis de IL‐4, IL‐13, IL‐17 e IL‐23.19 A exposição repetida a doses sub‐eritematogênicas de UVA1 e UVB‐NB diminui a concentração de IL‐31, enquanto altas doses têm o efeito oposto, especialmente com UVB.19
Tratamentos sistêmicos- a)
Anti‐histamínicos
Medicamentos anti‐H1 de segunda geração, como cetirizina, desloratadina, bilastina, rupatadina, fexofenadina e levocetirizina, são indicados na urticária crônica. Eles causam menos sonolência do que os anti‐histamínicos de primeira geração e também interagem com menos medicamentos. Para o tratamento da CPUO, a diretriz alemã para PC indica como recomendação de primeira linha os anti‐histamínicos H1 de segunda geração (até quatro vezes a dose).13 A maioria das condições que envolvem PC tem envolvimento da via não histaminérgica, então os medicamentos anti‐H1 têm efeitos abaixo do ideal ou nenhum efeito para tratar o PC.13
Os anti‐histamínicos H1 orais de primeira geração, como difenidramina e hidroxizina, são comumente usados como opções de primeira linha para PC, exceto na urticária crônica, em crianças com casos mais leves, principalmente por suas propriedades sedativas.58 Os efeitos colaterais incluem sedação e confusão da diálise.58 A dosagem padrão para crianças é de 5mg/kg/dia de difenidramina HCl oral ou 2mg/kg/dia de hidroxizina administrada à noite para sedação.58
- b)
Agentes antidepressivos19
Esses tipos de medicamentos são indicados para prurido urêmico, colestático ou paraneoplásico. O pico do efeito é atingido após quatro a seis semanas. Os efeitos adversos limitam seu uso, particularmente no caso de inibidores seletivos do receptor de serotonina (ISRSs) e mirtazapina.19 Esses agentes são menos úteis que a gabapentina ou a pregabalina no prurido neuropático.19
Os antidepressivos devem ser usados com cautela em pacientes idosos em virtude de efeitos colaterais graves relatados, principalmente os de natureza cardíaca.57 Os inibidores da recaptação da serotonina (p. ex., paroxetina, fluvoxamina) podem ser usados no prurido somatoforme, paraneoplásico e aquagênico decorrente de doenças proliferativas hematológicas.57 A sertralina provou ser eficaz no tratamento do prurido colestático.57 Os antidepressivos tetracíclicos, a saber, mirtazapina, amitriptilina, doxepina, também mostraram efeito antipruriginoso no PC de várias origens e efeito benéfico em pacientes com qualidade do sono prejudicada em virtude do PC (mirtazapina).57
A tabela 10 apresenta os principais medicamentos antidepressivos utilizados em diferentes tipos de PC.
- c)
Gabapentinoides19
Antidepressivos usados para tratar o prurido crônico
| Antidepressivo | Usos em tipos distintos de prurido crônico | Dose para adultos | Dose para crianças |
|---|---|---|---|
| Amitriptilina | Prurido braquiorradial, líquen amiloidótico, prurido urêmico, notalgia parestésica, prurido pós‐AVE, micose fungoide, HIV | 25 mg/dia | Não indicado |
| Doxepina | Prurido urêmico, prurido de origem desconhecida | 10 a 20 mg/dia | A dose inicial de 1 mg/dia para lactentes e as doses de manutenção variam de 3mg em um bebê de 8kg com atrasos no desenvolvimento a 10mg em todas as crianças.51 A dose é aumentada em 2mg a cada três dias para dose média de manutenção efetiva de 9mg.51 Efeitos adversos na forma de efeitos colaterais comportamentais (agressão) e enurese51 |
| Fluoxetina (ISRS) | Prurido aquagênico | 20 mg/dia | Não relatado |
| Fluvoxamina | Prurido crônico, em pacientes com DA, linfomas, prurido paraneoplásico, pacientes psiquiátricos | 25 a 100 mg/dia | Não relatado |
| Paroxetina | Prurido de origem desconhecida, prurido psicogênico, prurido paraneoplásico | 20 mg/dia | Não relatado |
| Nortriptilina | Prurido vulvar de origem desconhecida | 74 mg/dia | Não relatado |
| Mirtazapina | Prurido psicogênico, prurido de origem desconhecida, prurido paraneoplásico, prurido noturno de origem desconhecida | 15 a 30 mg/dia (à noite) | Crianças>10 anos:‐ até 15mg por via oral; de preferência à noite |
| Sertralina | 1 mg/kg/dia a 4 mg/kg/dia por via oral até o máximo de 100 mg/dia |
Os sintomas de abstinência foram descritos com antidepressivos como ISRSs (inibidores seletivos da recaptação da serotonina) e IRSNs (inibidores da recaptação da serotonina‐neuroepinefrina) em crianças, adolescentes e adultos nas últimas décadas e geralmente surgem quando os antidepressivos são descontinuados abruptamente, embora os sintomas de abstinência possam ocorrer com doses esquecidas e, em alguns pacientes, após reduções significantes da dose.52 Esses sintomas podem incluir sintomas gastrointestinais (vômitos, diarreia) e sintomas semelhantes aos da gripe, disestesias, dissonia, aumento da ansiedade, agitação ou irritabilidade e devem ser diferenciados da recrudescência dos sintomas associados ao distúrbio que está sendo tratado.52.
A abordagem geral para gerenciar a retirada de antidepressivos é garantir (i) adesão e (ii) descontinuação lenta quando a interrupção de um antidepressivo é necessária. Para redução gradual em pacientes pediátricos, usando uma redução gradual típica, um paciente tomando sertralina 100mg, depois reduzido para 50mg e depois para 25mg (ou seja, 50% de redução da dose em cada ponto de titulação), todo mês.52
Os gabapentinoides, especialmente a gabapentina e a pregabalina, são indicados para o tratamento da dor neuropática e também podem ser usados para tratar formas de neuropatia com prurido localizado (p. ex., prurido braquiorradial, notalgia/meralgia/gonalgia parestésica, neuralgia pós‐herpética) e generalizado (p. ex., neuropatia de pequenas fibras em virtude de diabetes).19 Os gabapentinoides também mostraram eficácia em doenças sistêmicas, como insuficiência renal e prurido aquagênico.19 Dependendo da função renal, a dose recomendada de gabapentina para pacientes adultos é de até 900mg /dia (entretanto, doses mais altas como 3.600mg/dia podem ser necessárias) e pregabalina 75‐225mg/dia.13 Para reduzir a ocorrência de efeitos colaterais, é importante que a dose seja aumentada lentamente até que as doses terapêuticas sejam atingidas.19 Além disso, a dose deve ser reduzida em pacientes idosos e naqueles com insuficiência renal.19 Os efeitos colaterais comuns incluem cansaço, tontura e ganho ponderal.19 Os gabapentinoides têm poucas interações com outros medicamentos e, portanto, constituem opção de tratamento atraente para pacientes mais velhos. A dose de gabapentina em idosos deve ser iniciada em 100‐300mg (pregabalina 25‐75mg) à noite e lentamente titulada para cima.62
- d)
Opiáceos
Os antagonistas do receptor opioide Mu (MOR) e os agonistas do receptor opioide Kappa (KOR) têm se mostrado muito úteis em virtude de seu papel como reguladores centrais do prurido.19 Esses medicamentos são classificados como: (i) agonistas de KOR difelikefalina para uso parenteral em casos de prurido urêmico em pacientes em hemodiálise; nalfurafine para uso parental em pacientes com prurido colestático e nalmefeno para uso oral em prurido colestático; (ii) agonistas de KOR/antagonistas MOR: nalbufina para uso parenteral em pacientes com prurido urêmico e PN; butorfanol para uso intranasal e aplicado em prurido colestático intratável; (iii) antagonistas MOR: naloxona para uso parenteral (reversão dos efeitos colaterais de opioides ou embriaguez) indicada para prurido induzido por medicamentos, prurido braquiorradial e prurido colestático,19 e administração sistêmica de naloxona intravenosa (0,002‐0,02μg/kg de peso corporal/min) fornece controle rápido do prurido junto com baixo número de efeitos colaterais;62naltrexona para uso oral (50‐150mg/dia), indicada para prurido induzido por medicamentos, prurido colestático, doença de Hailey‐Hailey, líquen plano pilar, psoríase, doença de Darier.19 A naltrexona em baixas doses administrada a 2mg/dia também tem efeitos antipruriginosos e pode ser usada em pacientes que não toleram doses padrão.18 Os receptores antagonistas do MOR, como naloxona, naltrexona ou nalmefeno, demonstraram ser eficazes na redução do prurido na urticária crônica, DA, PN, bem como prurido colestático e urêmico.62 Em contraste, a ativação de KORs inibe o prurido.57 O butorfanol, um agonista kappa‐opioide com algumas propriedades antagonistas Mu‐opioides, demonstrou em séries de casos reduzir efetivamente o prurido decorrente de PN, colestase, prurido urêmico e prurido idiopático em pacientes idosos.62
Os efeitos colaterais mais comuns dos moduladores de opioides incluem desconforto gastrintestinal (como diarreia e vômito), sonolência, fadiga, tontura e insônia. Além disso, existe o risco de lesão hepática em altas doses, o que requer cautela ao prescrever esses medicamentos a pacientes idosos.18,62 Pacientes em uso de agonistas opioides devem evitar o uso concomitante de antagonistas opioides, pois isso pode desencadear sintomas de abstinência rápida. O uso prolongado de agonistas como o butorfanol também pode aumentar o risco de dependência. É importante notar que a difelikefalina – agonista seletivo do receptor kappa‐opioide – é aprovada pela FDA apenas como injeção para o tratamento de prurido moderado a intenso associado a doença renal crônica em adultos submetidos a hemodiálise. A maioria dos outros medicamentos opioides usados para PC é usada de maneira off‐label.18
- e)
Resinas de ácidos biliares e rifampicina
A colestiramina é uma resina de ácido biliar que alivia o prurido ao sequestrar ácidos biliares pruritógenos. A rifampicina, um antibiótico, ajuda a reduzir o prurido, promovendo a conversão de ácidos biliares em formas menos pruritógenas. Entretanto, em virtude de seus efeitos colaterais hepatotóxicos e nefrotóxicos, a rifampicina não é adequada para uso em longo prazo, mas pode ser tratamento eficaz de segunda linha quando a colestiramina é insuficiente.18
- f)
Talidomida
A talidomida é imunomodulador inespecífico que pode interromper a degeneração das fibras nervosas não mielinizadas do tipo C. Pode ser eficaz no tratamento do prurido urêmico e do PN. No entanto, os efeitos colaterais notáveis incluem sedação, obstrução intestinal e neuropatia periférica, que normalmente reverte após a descontinuação do medicamento. A talidomida é classificada como medicamento da categoria X na gravidez em virtude de seus graves efeitos teratogênicos, necessitando de adesão estrita ao programa de Estratégias de Avaliação e Mitigação de Risco (REMS, do inglês Risk Evaluation and Mitigation Strategies). A dosagem de talidomida em comprimidos recomendada é de 50 a 200mg / dia.18
- g)
Medicamentos imunossupressores
Os medicamentos imunossupressores sistêmicos estão bem estabelecidas no tratamento de dermatoses inflamatórias, como DA, psoríase vulgar e linfoma cutâneo de células T.57 Eles devem ser considerados após tratamento malsucedido com alternativas tópicas ou físicas e após a exclusão de contraindicações.57 Ciclosporina (2,5‐5mg/kg/dia), metotrexato (7,5‐20mg semanalmente), micofenolato (1‐2g/dia) e azatioprina (1‐3mg/kg/dia, frequentemente 50 a 100mg/dia) são as substâncias mais utilizadas.18,57 Em virtude das interações complexas e dos perfis de efeitos colaterais indesejáveis desses medicamentos, eles devem ser recomendados com cautela, principalmente para indivíduos mais velhos. Aumentos nos parâmetros de retenção, enzimas hepáticas e hipertensão são comumente observados. Portanto, uma análise de risco‐benefício deve ser realizada antes de iniciar a terapia imunossupressora sistêmica, e os pacientes devem ser completamente informados sobre os riscos potenciais e efeitos colaterais.57
- h)
Terapias biológicas e pequenas moléculas orais
O dupilumabe (600mg inicial, 300mg Q2W), anticorpo monoclonal direcionado ao receptor de IL‐4, demonstrou em grandes ensaios clínicos randomizados e controlados (ECRCs) reduzir os sintomas e melhorar a qualidade de vida em pacientes com dermatite atópica moderada a grave.18 A média de idade dos participantes desses ensaios foi inferior a 50 anos, fornecendo poucas evidências de eficácia na população idosa.18 Experiência clínica foi obtida usando esse medicamento em pacientes mais velhos com sucesso, incluindo um homem de 87 anos com prurido e PN refratário a outros tratamentos.63
Os efeitos adversos não foram especificamente detalhados para os idosos, mas na população adulta em geral, eles incluem conjuntivite, dor de cabeça e reações no local da injeção. Não há risco aumentado demonstrado de infecções secundárias, como infecções virais por herpes ou infecções do trato urinário, que seriam particularmente preocupantes ao prescrevê‐lo para pacientes idosos.18 Várias terapias biológicas adicionais, incluindo alvos de IL‐31RA (nemolizumabe para PN e DA), rocatinlimabe (anti‐OX40, em ensaio clínico para DA e PN), amlitelimabe (anti‐OX40L, em ensaio clínico para DA) e lebriquizumabe/traloquinumabe (anti‐IL‐13, para DA) anti‐OSMRβ (vixarelimabe para PN) podem controlar o PC.64
Os inibidores orais de JAK mostram‐se promissores em ensaios de fase inicial por suas propriedades antipruriginosas, particularmente várias dermatoses pruriginosas, incluindo DA, PN e prurido idiopático crônico).18,59,63 Baricitinibe (JAK1/2‐1), abrocitinibe (JAK‐1) e upadacitinibe (JAK‐1) já estão aprovados para DA em vários países. Os inibidores de JAK, como o tofacitinibe (5 a 10mg/dia), têm efeitos adversos que devem ser fortemente considerados quando usados em idosos, incluindo aumento do risco de herpes e outras infecções.18,65,66 Um ensaio clínico de fase II (NCT05038982) avaliando a eficácia do abrocitinibe 200mg durante 12 semanas para reduzir o prurido em adultos com CPUO e PN foi concluído recentemente e aguarda publicação dos resultados.66,67
Com base na identificação de que JAK1 é expressa em neurônios, juntamente com evidências de respostas imunes do tipo 2 em CPUO, pacientes com CPUO graves e refratários talvez possam se beneficiar do uso de inibidores orais de JAK (não indicados para pacientes> 65 anos no cenário de DA).53 O dupilumabe está atualmente sendo investigado em ECRs que incluem pacientes com CPUO.68,69
ConclusõesA compreensão das distintas categorias de PC, particularmente a diferenciação entre prurido com e sem lesões dermatológicas, é crucial para manejo eficaz da doença. O prurido sem lesões dermatológicas, muitas vezes subdiagnosticado ou mal diagnosticado, requer consideração e reavaliação cuidadosas. O reconhecimento dessas diferentes formas de prurido torna possível abordagem mais direcionada ao tratamento, abordando os mecanismos fisiopatológicos específicos envolvidos. Pesquisas futuras devem continuar a refinar nossa compreensão dessas categorias, potencialmente levando a estratégias terapêuticas mais eficazes e personalizadas para pacientes que sofrem de PC de várias origens.
A pesquisa e o desenvolvimento contínuos são promissores para o futuro dos medicamentos direcionados ao prurido. As vias emergentes incluem compostos moduladores de neurorreceptores, como canais de TRP e receptores opioides.70 Os avanços na compreensão das vias moleculares abrem oportunidades para o desenvolvimento de produtos biológicos direcionados e pequenas moléculas. Os inibidores de JAK, atualmente em uso, podem ter refinamento e aplicação mais ampla para condições pruriginosas.
Suporte financeiroNenhum.
Contribuição dos autoresPaulo Ricardo Criado: Idealização do estudo, escrita e aprovação do texto final.
Roberta Fachini Jardim Criado: Idealização do estudo, escrita e aprovação do texto final.
Mayra Ianhez: Idealização do estudo, escrita e aprovação do texto final.
Hélio Amante Miot: Idealização do estudo, escrita e aprovação do texto final.
Conflito de interessesDr. Paulo Criado: Conselho consultivo: Pfizer, Galderma, Takeda, Hypera, Novartis, Sanofi; Pesquisa clínica: Pfizer, Novartis, Sanofi, Amgen e Lilly; Palestrante: Pfizer, Abbvie, Sanofi‐Genzyme, Hypera, Takeda, Novartis.
Dra. Roberta Fachini Jardim Criado: Conselho consultivo: Pfizer, Takeda, Hypera, Novartis, Sanofi; Pesquisa clínica: Pfizer, Novartis, Sanofi e Lilly; Palestrante: Pfizer, Abbvie, Sanofi‐Genzyme, Hypera, Takeda, Novartis.
Dra. Mayra Ianhez: Conselho Consultivo: Galderma, Sanofi, Pfizer, Novartis, Abbvie, Janssen, UCB‐Biopharma, Boehringer‐Ingelheim; Palestrante: Galderma, Sanofi, Pfizer, Theraskin, Novartis, Abbvie, Janssen, Leopharma, FQM.
Dr. Hélio Miot: Conselho Consultivo: Johnson & Johnson, L’Oréal, Theraskin, Sanofi e Pfizer; Pesquisa clínica: Abbvie, Galderma e Merz.
Os autores gostariam de expressar sua sincera gratidão aos Drs. Manuel Fernandes Lobo Pereira, Martin Metz e Marcus Maurer do Charité Service em Berlim, Alemanha, por suas valiosas contribuições para o desenvolvimento deste trabalho. A ausência do Prof. Marcus Maurer é profundamente sentida por todos que tiveram a honra de trabalhar ao seu lado. Sua liderança e dedicação foram fundamentais, e este trabalho é, em parte, um reflexo de seu legado.