A infância e a adolescência são os períodos mais ativos para o desenvolvimento de nevos, o que fornece informações sobre a nevogênese.
ObjetivosAvaliar as características clínicas e dermatoscópicas de nevos melanocíticos adquiridos em crianças turcas (com idade ≤ 10 anos) e adolescentes (com idade >10 anos) em relação a fatores demográficos, constitucionais e ambientais.
MétodosEstudo transversal em participantes com idade <18 anos examinados para nevos melanocíticos adquiridos entre janeiro e junho de 2023.
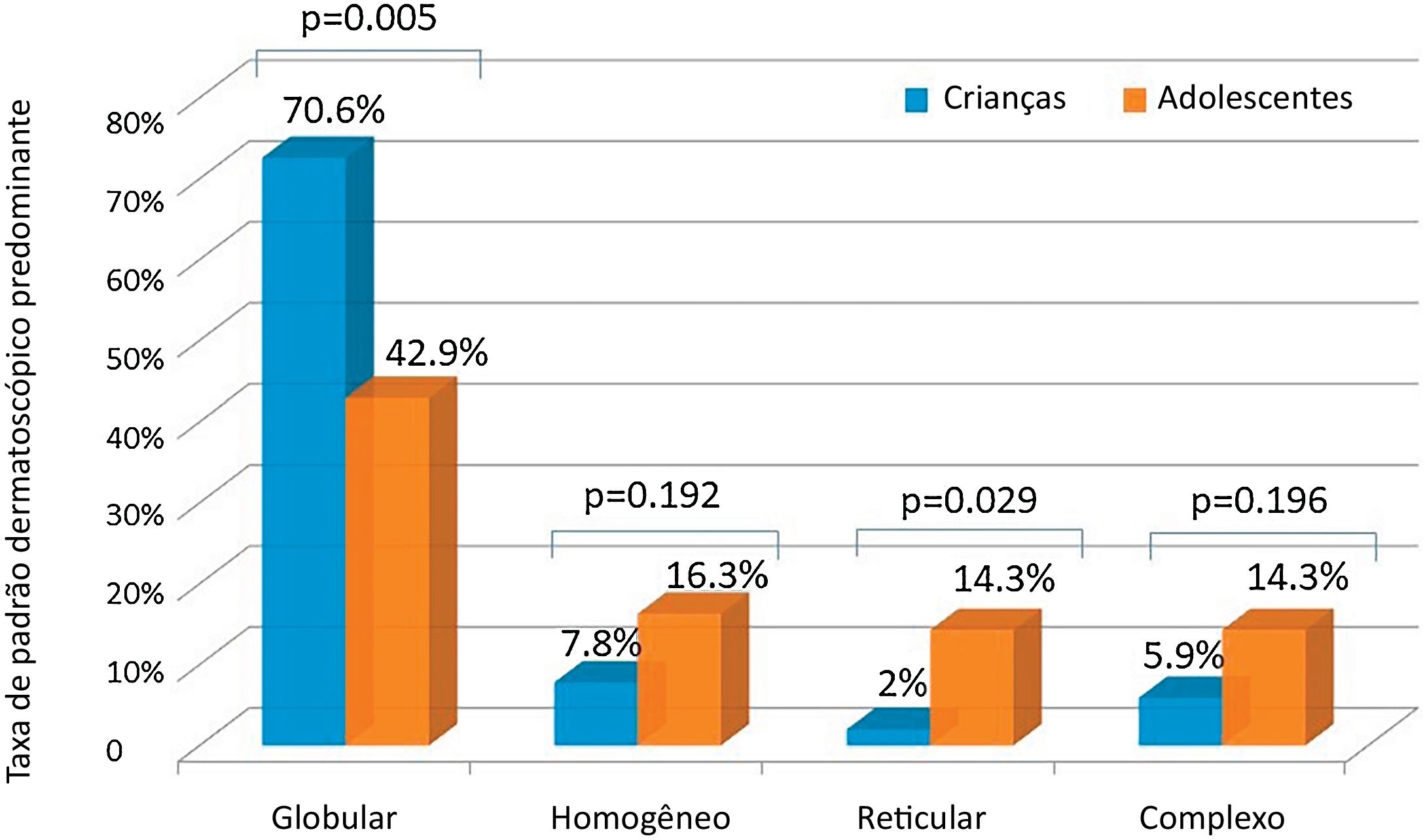
ResultadosCem participantes (razão gênero feminino:masculino=1:1; mediana de idade: 10) foram avaliados. O número mediano de nevos foi significantemente maior em adolescentes do que em crianças (6 vs. 4; p<0,05). As extremidades superiores (n=68) e o tronco (n=67) foram as regiões anatômicas mais comumente afetadas. O gênero feminino apresentou uma taxa significantemente maior de nevos nas extremidades superiores do que o masculino (80% vs. 56%; p<0,05). O tronco foi afetado um pouco mais frequentemente no gênero masculino (76% vs. 58%; p=0,06). O padrão globular foi mais frequente em crianças do que em adolescentes (70,6% vs. 42,9%; p<0,05), enquanto um aumento marcante foi observado no padrão reticular da infância (2%) para a adolescência (14,3%; p<0,05). O padrão globular foi o principal padrão dermatoscópico em todas as localizações anatômicas, exceto nas extremidades inferiores, onde o padrão homogêneo prevaleceu. O uso de protetor solar não teve impacto no número de nevos ou no padrão dermatoscópico.
Limitações do estudoNúmero limitado de participantes.
ConclusõesA idade e o local anatômico foram os fatores mais relevantes que influenciaram o número e os padrões dermatoscópicos dos nevos. O padrão de distribuição dos nevos relacionado ao gênero, sem qualquer efeito do uso de protetor solar na contagem de nevos ou no padrão dermatoscópico, sugere predisposição genética.
Os nevos melanocíticos são fatores de risco bem conhecidos e que podem simular melanoma.1–3 Durante as três últimas décadas, as características clínicas e os padrões de distribuição anatômica de nevos na faixa etária pediátrica e sua associação com fatores demográficos, constitucionais e ambientais foram amplamente investigados.4–12Após a introdução da dermatoscopia na prática clínica de rotina, o aumento dos relatos sobre as características dermatoscópicas dos nevos durante a infância e a adolescência, os períodos mais ativos em termos de desenvolvimento do nevo,13 resultaram na criação de conhecimento básico sobre esse tema.3,14–25 Para entender o conceito de nevogênese, um esforço especial foi investido na análise dos padrões dermatoscópicos relacionados à idade dos pacientes com nevos melanocíticos.3,14–25Estar familiarizado com os padrões dermatoscópicos benignos orientaria o manejo clínico adequado dos nevos, facilitaria o diagnóstico precoce do melanoma e evitaria biopsias desnecessárias realizadas para descartar transformação maligna.13,15,19 Entretanto, os estudos foram realizados principalmente em populações pediátricas da Europa, Austrália e América, dificultando a generalização dos achados para outras regiões geográficas.17
O objetivo do presente estudo foi avaliar as características clínicas e dermatoscópicas de nevos melanocíticos adquiridos em crianças e adolescentes turcos e investigar a influência de fatores demográficos, constitucionais e ambientais nessas lesões.
MétodosNeste estudo transversal, unicêntrico, pacientes com idade <18 anos admitidos no ambulatório de dermatologia de centro de referência terciário localizado na região da Turquia Ocidental foram convidados para exame de nevos melanocíticos com o consentimento de seus responsáveis legais entre janeiro e junho de 2023. Pacientes com pelo menos uma lesão de qualquer tamanho compatível com nevo melanocítico, tanto clínica quanto dermatoscopicamente, foram consecutivamente incluídos no estudo. Foram excluídos pacientes com histórico de exposição solar prolongada quatro semanas antes do exame, nevos da unidade ungueal, região genital ou mucosa, nevos congênitos diagnosticados com base na morfologia e presença durante o primeiro ano de vida, lesões suspeitas que necessitaram de biópsia para excluir transformação maligna e nevos especiais, como nevo de Spitz, nevo agminado, nevo halo ou nevo azul.
Os consentimentos verbais e escritos foram obtidos dos responsáveis legais dos participantes. Achados demográficos (gênero, idade), histórico pessoal e familiar de câncer de pele, práticas de proteção solar através do uso de protetor solar e histórico de queimaduras solares (em termos de número e gravidade [discreta‐moderada ou grave caracterizada pela presença de eritema ou bolhas dolorosas, respectivamente]) foram registrados.
Os participantes foram avaliados em duas faixas etárias: crianças (pacientes com idade ≤ 10 anos) e adolescentes (pacientes com idade >10 anos). Eles foram examinados quanto à cor dos olhos e do cabelo. O fototipo foi avaliado de acordo com a escala de Fitzpatrick.26
Os nevos melanocíticos foram examinados em termos de número, tamanho (diâmetro) e região anatômica. A avaliação dermatoscópica dos nevos melanocíticos foi realizada primeiramente com um dermatoscópio portátil (DermLite DL4®, 3Gen, Califórnia, EUA), seguido pela documentação com uma câmera digital (Canon EOS 5D®, Canon Inc., Tóquio, Japão) acoplada a uma lente dermatoscópica (DermLite FOTO II Pro®, 3Gen, Califórnia, EUA). Três dermatologistas avaliaram as lesões de modo independente.
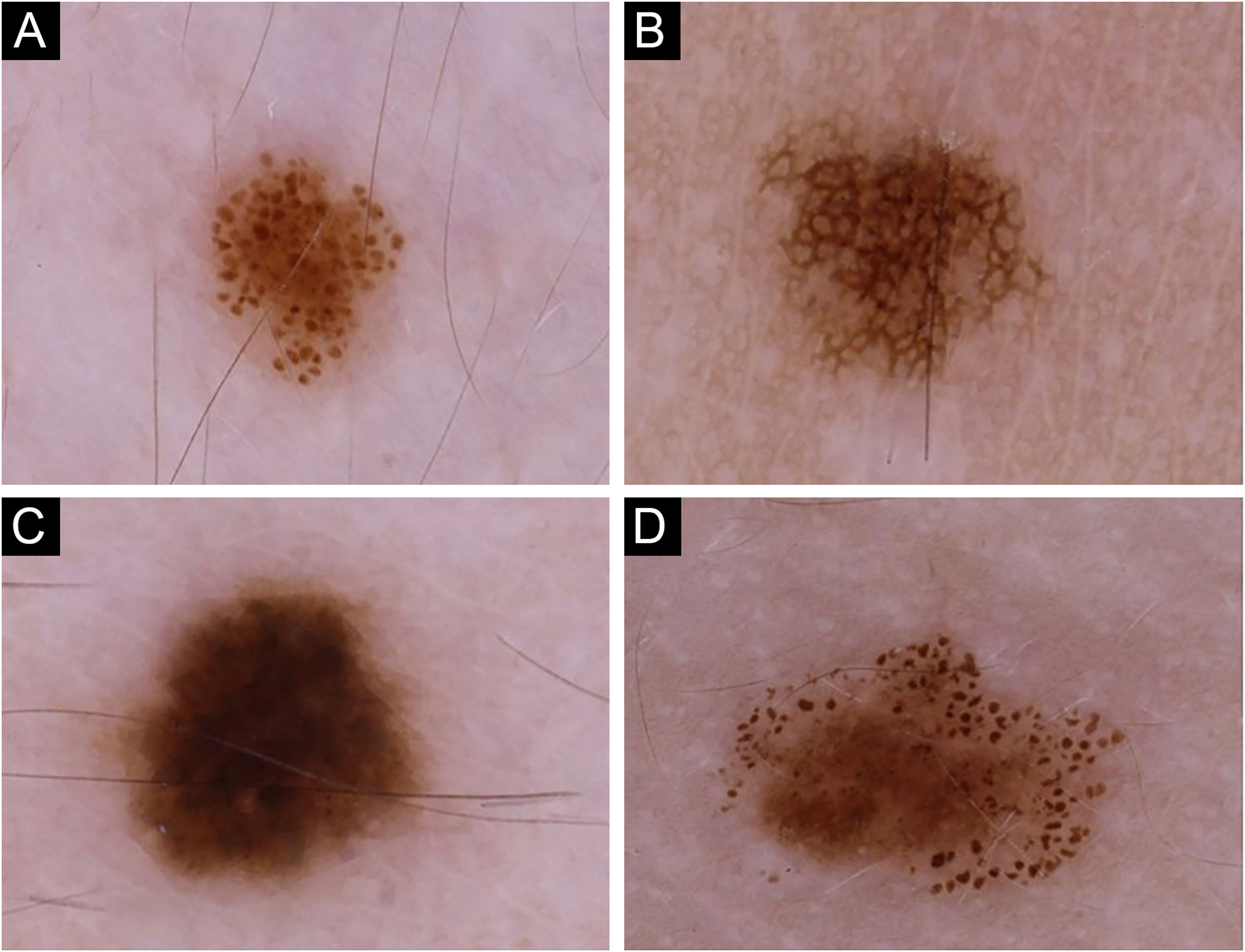
Os padrões dermatoscópicos foram categorizados em quatro grupos principais:27 globular, reticular, homogêneo e complexo (fig. 1) – este último, uma combinação de padrões globular, reticular e homogêneo,28 compreendendo globular‐reticular, globular‐homogêneo e reticular‐homogêneo. Para cada indivíduo, o padrão observado em mais de 40% da superfície dos nevos melanocíticos foi aceito como o padrão dermatoscópico predominante.27 Os indivíduos que não preenchiam esse critério eram designados como tendo padrão não especificado. Os nevos no couro cabeludo e em localização acral foram incluídos apenas na contagem total de nevos, mas avaliados separadamente em termos de características dermatoscópicas para determinar o padrão dermatoscópico predominante.
O programa IBM SPSS® Statistics versão 26 foi usado para armazenar e analisar os dados. O teste de Shapiro‐Wilks foi usado para avaliar a normalidade da distribuição das variáveis. Estatísticas descritivas foram calculadas como média±desvio padrão e valores de mediana [mínimo–máximo] foram utilizados para variáveis contínuas e frequência e porcentagem para variáveis categóricas. O teste de qui‐quadrado ou teste exato de Fisher foi usado para avaliar as diferenças na distribuição de variáveis categóricas entre dois grupos independentes. O teste U de Mann‐Whitney foi usado para a comparação de grupos sem distribuição normal. O valor de p<0,05 foi considerado estatisticamente significante.
O estudo foi aprovado pelo comitê de ética institucional (protocolo de aprovação: 2022/14‐24) e conduzido de acordo com a Declaração de Helsinque.
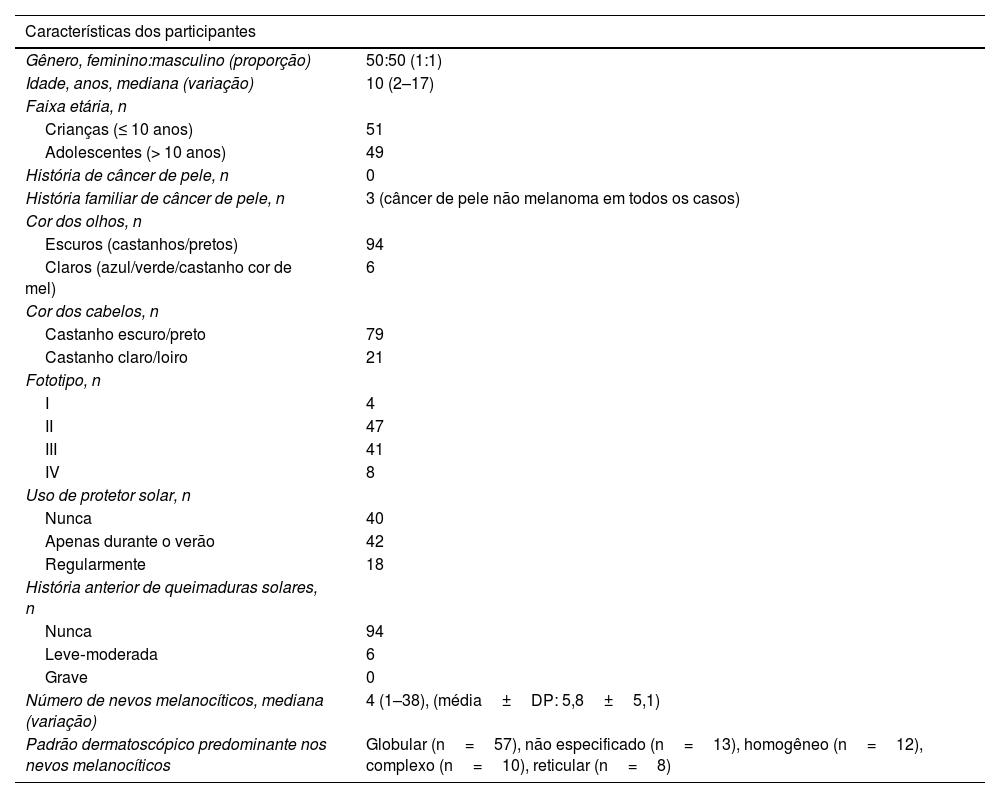
ResultadosUm total de 574 nevos melanocíticos adquiridos de 100 participantes foi avaliado. As características demográficas e fenotípicas da população do estudo estão resumidas na tabela 1. O grupo de estudo consistiu em 50 mulheres e 50 homens com medianas de idade de 9,5 e 11,5 anos, respectivamente (p=0,41). A mediana da idade e as distribuições de gênero e fototipo foram semelhantes em ambos os grupos que usaram protetor solar e aqueles que nunca usaram (tabela 2).
Características demográficas, fenotípicas e clínicas de crianças e adolescentes com nevos melanocíticos adquiridos (n=100)
| Características dos participantes | |
|---|---|
| Gênero, feminino:masculino (proporção) | 50:50 (1:1) |
| Idade, anos, mediana (variação) | 10 (2–17) |
| Faixa etária, n | |
| Crianças (≤ 10 anos) | 51 |
| Adolescentes (> 10 anos) | 49 |
| História de câncer de pele, n | 0 |
| História familiar de câncer de pele, n | 3 (câncer de pele não melanoma em todos os casos) |
| Cor dos olhos, n | |
| Escuros (castanhos/pretos) | 94 |
| Claros (azul/verde/castanho cor de mel) | 6 |
| Cor dos cabelos, n | |
| Castanho escuro/preto | 79 |
| Castanho claro/loiro | 21 |
| Fototipo, n | |
| I | 4 |
| II | 47 |
| III | 41 |
| IV | 8 |
| Uso de protetor solar, n | |
| Nunca | 40 |
| Apenas durante o verão | 42 |
| Regularmente | 18 |
| História anterior de queimaduras solares, n | |
| Nunca | 94 |
| Leve‐moderada | 6 |
| Grave | 0 |
| Número de nevos melanocíticos, mediana (variação) | 4 (1–38), (média±DP: 5,8±5,1) |
| Padrão dermatoscópico predominante nos nevos melanocíticos | Globular (n=57), não especificado (n=13), homogêneo (n=12), complexo (n=10), reticular (n=8) |
DP, desvio padrão.
Comparação entre participantes que usavam protetor solar e aqueles que nunca usaram em relação a gênero, idade e fototipo
Um número mediano significantemente maior de nevos melanocíticos foi detectado em adolescentes em comparação com crianças (6 vs. 4; p<0,05). Por outro lado, o número mediano de nevos não mostrou nenhuma diferença em relação ao gênero (feminino 4,5 vs. masculino 4; p=0,424), fototipo (tipo I–II 5 vs. tipo III–IV 4; p=0,155) ou uso de protetor solar (presente 4 vs. ausente 5; p=0,345).
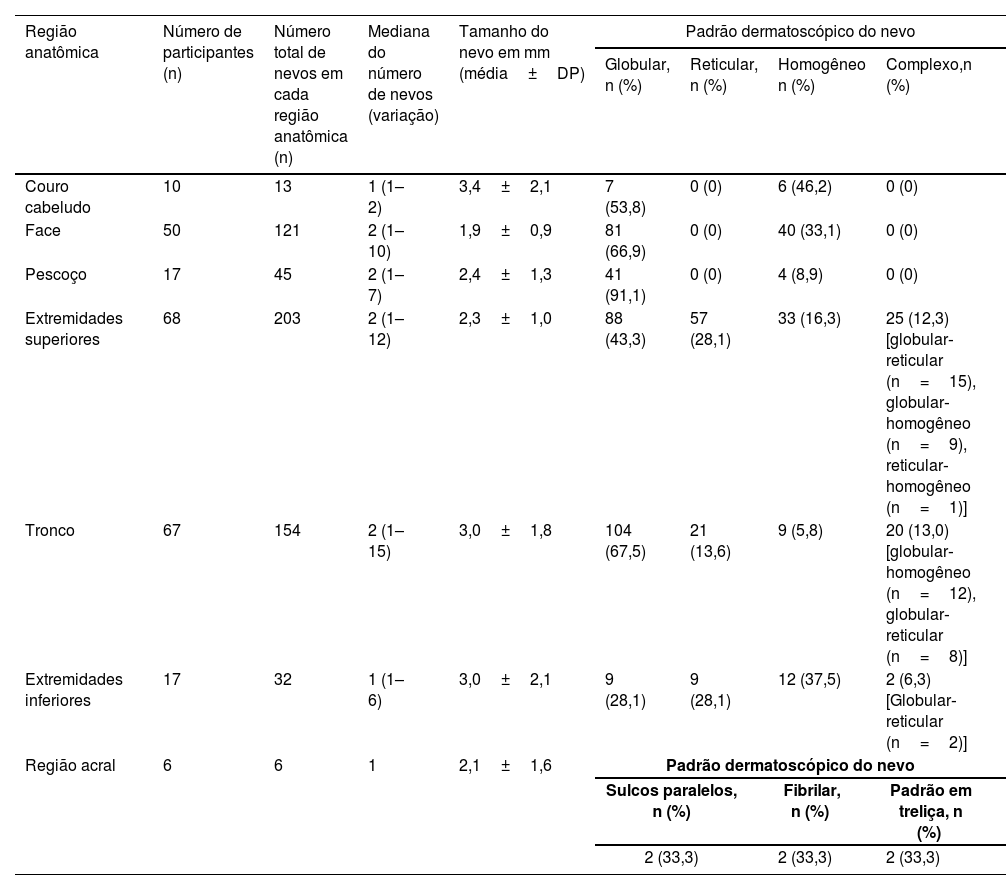
As extremidades superiores foram a região anatômica que mais comumente apresentaram nevos melanocíticos em 68 participantes, seguida pelo tronco (n=67) e face (n=50) – tabela 3. A prevalência de nevos melanocíticos nas extremidades superiores foi significantemente maior no gênero feminino do que no masculino [80% (n=40/50) vs. 56% (n=28/50); p<0,05]. O tronco foi afetado com mais frequência no gênero masculino, embora sem significância estatística (tabela 4).
Número, tamanho e padrões dermatoscópicos (globular, reticular, homogêneo ou complexo28) de nevos melanocíticos adquiridos de acordo com a distribuição anatômica
| Região anatômica | Número de participantes (n) | Número total de nevos em cada região anatômica (n) | Mediana do número de nevos (variação) | Tamanho do nevo em mm (média±DP) | Padrão dermatoscópico do nevo | |||
|---|---|---|---|---|---|---|---|---|
| Globular, n (%) | Reticular, n (%) | Homogêneo n (%) | Complexo,n (%) | |||||
| Couro cabeludo | 10 | 13 | 1 (1–2) | 3,4±2,1 | 7 (53,8) | 0 (0) | 6 (46,2) | 0 (0) |
| Face | 50 | 121 | 2 (1–10) | 1,9±0,9 | 81 (66,9) | 0 (0) | 40 (33,1) | 0 (0) |
| Pescoço | 17 | 45 | 2 (1–7) | 2,4±1,3 | 41 (91,1) | 0 (0) | 4 (8,9) | 0 (0) |
| Extremidades superiores | 68 | 203 | 2 (1–12) | 2,3±1,0 | 88 (43,3) | 57 (28,1) | 33 (16,3) | 25 (12,3) [globular‐reticular (n=15), globular‐homogêneo (n=9), reticular‐homogêneo (n=1)] |
| Tronco | 67 | 154 | 2 (1–15) | 3,0±1,8 | 104 (67,5) | 21 (13,6) | 9 (5,8) | 20 (13,0) [globular‐homogêneo (n=12), globular‐reticular (n=8)] |
| Extremidades inferiores | 17 | 32 | 1 (1–6) | 3,0±2,1 | 9 (28,1) | 9 (28,1) | 12 (37,5) | 2 (6,3) [Globular‐reticular (n=2)] |
| Região acral | 6 | 6 | 1 | 2,1±1,6 | Padrão dermatoscópico do nevo | |||
| Sulcos paralelos, n (%) | Fibrilar, n (%) | Padrão em treliça, n (%) | ||||||
| 2 (33,3) | 2 (33,3) | 2 (33,3) | ||||||
DP, desvio padrão.
Distribuição anatômica dos nevos melanocíticos adquiridos em relação ao gênero (valores estatisticamente significantes são destacados em negrito)
O padrão globular foi o padrão dermatoscópico predominante (n=57; fig. 1A; tabela 1). Em 13 pacientes, nenhum padrão dermatoscópico específico predominou, enquanto padrões complexos foram detectados na maioria dos nevos em 10 pacientes [globular‐reticular (n=7) e globular‐homogêneo (n=3)].
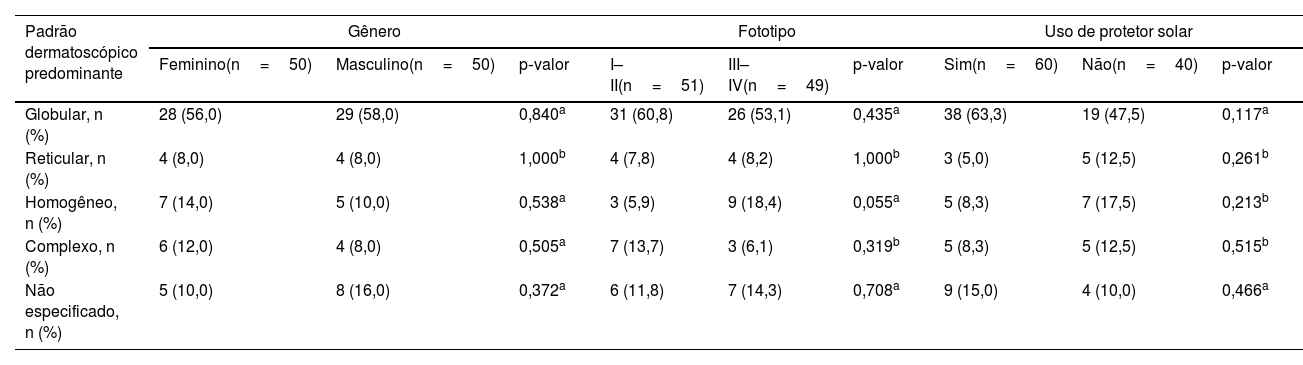
Embora ambas as faixas etárias tivessem o padrão globular como padrão dermatoscópico predominante, os adolescentes apresentaram uma taxa significantemente menor desse padrão do que as crianças (fig. 2). Por outro lado, um aumento notável no padrão reticular foi observado em adolescentes (fig. 2). Nenhuma diferença no padrão dermatoscópico predominante foi observada em relação ao gênero, fototipo ou uso de protetor solar (tabela 5).
Distribuição do padrão dermatoscópico predominante quanto ao gênero, fototipo e uso de protetor solar
| Padrão dermatoscópico predominante | Gênero | Fototipo | Uso de protetor solar | ||||||
|---|---|---|---|---|---|---|---|---|---|
| Feminino(n=50) | Masculino(n=50) | p‐valor | I–II(n=51) | III–IV(n=49) | p‐valor | Sim(n=60) | Não(n=40) | p‐valor | |
| Globular, n (%) | 28 (56,0) | 29 (58,0) | 0,840a | 31 (60,8) | 26 (53,1) | 0,435a | 38 (63,3) | 19 (47,5) | 0,117a |
| Reticular, n (%) | 4 (8,0) | 4 (8,0) | 1,000b | 4 (7,8) | 4 (8,2) | 1,000b | 3 (5,0) | 5 (12,5) | 0,261b |
| Homogêneo, n (%) | 7 (14,0) | 5 (10,0) | 0,538a | 3 (5,9) | 9 (18,4) | 0,055a | 5 (8,3) | 7 (17,5) | 0,213b |
| Complexo, n (%) | 6 (12,0) | 4 (8,0) | 0,505a | 7 (13,7) | 3 (6,1) | 0,319b | 5 (8,3) | 5 (12,5) | 0,515b |
| Não especificado, n (%) | 5 (10,0) | 8 (16,0) | 0,372a | 6 (11,8) | 7 (14,3) | 0,708a | 9 (15,0) | 4 (10,0) | 0,466a |
O padrão globular foi o principal padrão dermatoscópico em todas as localizações anatômicas, exceto nas extremidades inferiores, onde o padrão homogêneo predominou (tabela 3). Além disso, os padrões globular e homogêneo detectados em participantes com nevos faciais foram acompanhados por um padrão de pseudorrede em 86% (n=43/50) desses indivíduos.
DiscussãoAs evidências sobre as características clínicas e dermatoscópicas dos nevos melanocíticos na população jovem estão crescendo.3–25 Entretanto, ainda é desafiador comparar esses estudos em virtude das diferenças nas faixas etárias e fototipos dos participantes, a frequência e o grau de exposição solar dependendo da região geográfica onde o estudo foi conduzido. Além disso, alguns estudos incluíram apenas nevos de locais anatômicos específicos, como a região dorsal,21,23 enquanto outros examinaram apenas lesões >2mm de diâmetro.9,22
Região geográficaEm estudos que avaliaram a contagem total de nevos corporais em crianças e adolescentes, o número médio de nevos mostrou ampla faixa de variação, de 1 a mais de 70,6,11 fato explicado parcialmente pela latitude. Um estudo comparativo conduzido em crianças do ensino médio de ascendência europeia que viviam em diferentes latitudes (da Austrália e Escócia) mostrou número significantemente maior de nevos em crianças da Austrália.5 Diferença semelhante foi observada em estudo que investigou o desenvolvimento de nevos durante os três primeiros anos de vida em duas coortes de crianças da Austrália e Escócia.29 English et al. usaram a irradiação eritêmica como medida da exposição ultravioleta ambiente em vez da latitude em seu estudo e demonstraram que crianças de seis anos que viviam em Perth, Austrália, desde o nascimento, tinham contagem menor de nevos na região dorsal em comparação com aquelas que se mudaram para Perth de outras regiões com maior irradiação eritêmica.30 Estudo anterior em crianças e adolescentes turcos do leste da Turquia relatou contagem média de nevos de 1,1,11 que foi quase seis vezes menor do que o valor detectado na presente série. Essa diferença entre regiões de um mesmo país pode estar ligada a outros possíveis fatores contribuintes, como a proximidade da costa marítima, já que a população deste estudo reside principalmente ao longo do litoral.
Fatores genéticosA contagem total de nevos também demonstrou ser determinada por fatores genéticos.31,32 Além disso, a associação entre polimorfismos genéticos específicos e padrões dermatoscópicos particulares foi recentemente demonstrada em crianças.33
IdadeO aumento na contagem de nevos da infância para a adolescência é um achado bem estabelecido,3,4,12,13,17,19 também apoiado pela presente série. O padrão globular foi relatado como o padrão dermatoscópico predominante em crianças.3,19 Zalaudek et al. indicaram o padrão globular como o principal padrão observado em participantes com idades entre 3 e 20 anos em seu estudo avaliando os padrões dermatoscópicos de nevos localizados no tronco. Os autores também observaram aumento significante na prevalência do padrão reticular na adolescência.19 Apesar de ser o padrão mais comum em ambas as faixas etárias, o padrão globular foi mais prevalente em crianças do que em adolescentes na presente série, em virtude da tendência crescente do padrão reticular com o avanço da idade. De acordo com o conceito duplo de nevogênese, os nevos com padrão globular representam nevos congênitos de início tardio geneticamente determinados, aparecendo principalmente durante a primeira infância e persistindo ao longo da vida. Os nevos com padrão reticular, por outro lado, são considerados lesões melanocíticas adquiridas “verdadeiras”, que surgem após a puberdade em resposta à radiação ultravioleta e desaparecem eventualmente.15,34 Essa teoria também foi apoiada por estudos longitudinais recentes, onde mudança do padrão globular para o reticular mostrou ser pouco frequente.18,25 Por outro lado, pesquisadores italianos relataram taxa notável de transição de um padrão para outro (principalmente do globular para o globular‐reticular), particularmente na faixa etária de 3 a 6 anos.20
GêneroAlguns autores não indicaram nenhuma diferença relacionada ao gênero na contagem total de nevos,3,14 semelhante aos achados do presente estudo. Em contraste, foi relatado que os indivíduos do gênero masculino geralmente tinham número maior de nevos.9,17,22 Um relato recente observou que essa diferença é marcante após a puberdade.12
FototipoIndivíduos com fototipos de pele clara demonstraram possuir nevos com padrão globular predominante e têm número maior de nevos do que aqueles com fototipos de pele mais escuros, principalmente nevos de padrão reticular.3,9,10,12,16,21 Assim, em estudos conduzidos em populações pediátricas com fototipos de pele mais escuros, o padrão reticular prevaleceu.21,24 Isso foi atribuído à alta atividade melanocítica e ao aumento da transferência de melanina para os queratinócitos, resultando em padrão de crista epidérmica aumentada visto como padrão reticular nesses indivíduos.16 A ausência de qualquer impacto significante do fototipo de pele na contagem de nevos ou padrão dermatoscópico predominante na presente série pode estar relacionada à distribuição não equilibrada de participantes com diferentes fototipos de pele, a maioria classificada como fototipo II ou III.
Local anatômicoTanto os fatores genéticos quanto a radiação ultravioleta influenciam a distribuição dos nevos por região anatômica.35 A exposição ultravioleta intermitente foi associada a contagem maior de nevos em comparação à exposição ultravioleta crônica.4,9,35 Isso foi relacionado ao efeito nevogênico da exposição intermitente nos melanócitos, bem como ao efeito protetor da exposição crônica contra o desenvolvimento de nevos.8,9,35 Compatível com essas descobertas, os locais do corpo expostos à radiação ultravioleta de maneira intermitente (extremidades superiores e tronco) foram as regiões mais frequentemente afetadas no presente grupo de estudo.
Em vários estudos, um número significantemente maior de nevos melanocíticos foi relatado no tronco em indivíduos do gênero masculino e nas extremidades no gênero feminino,3,4 em concordância com os achados do presente estudo. Esse padrão de distribuição é semelhante ao observado para nevos e melanoma em adultos,4,35 embora a relação direta entre a contagem de nevos e o desenvolvimento de melanoma em local anatômico específico não seja clara.36 As diferenças nos padrões de exposição solar pelo estilo de roupa e atividades ao ar livre foram consideradas responsáveis por essa diferença relacionada ao gênero,3 bem como efeitos hormonais.9 Entretanto, um padrão de distribuição de nevos semelhante foi observado em crianças huteritas canadenses com exposição ultravioleta limitada em virtude de suas roupas ditadas pela religião.7 Os autores deste estudo, que identificaram esse padrão mesmo em crianças pré‐púberes, sugeriram possível diferença biológica regional nos melanócitos em vez do efeito da radiação ultravioleta ou de efeito hormonal.7 Consequentemente, a alta contagem de nevos nas extremidades inferiores em indivíduos do gênero feminino demonstrou recentemente ser influenciada por efeitos genéticos específicos desse gênero.37
Os nevos melanocíticos mostraram padrões dermatoscópicos distintos dependendo do local anatômico.22,23 Em análise transversal dos nevos da região dorsal e membros inferiores de adolescentes, conduzida como parte de um estudo populacional, o padrão globular foi observado com mais frequência na região dorsal do que o padrão reticular, que era mais prevalente nos membros inferiores.23 Da mesma maneira, em uma série conduzida na Itália, lesões na região cervical, tronco e extremidades superiores mostraram taxa maior de padrão globular, enquanto o padrão reticular foi mais prevalente nas extremidades inferiores.22 Isso foi atribuído à migração cefálica para caudal e à parada de melanoblastos na derme durante a embriogênese, o que resultou na formação de nevos globulares. Os nevos reticulares, por outro lado, são considerados derivados de melanócitos epidérmicos após radiação ultravioleta intermitente em locais anatômicos expostos ao sol.23 Em consonância com esses achados, o padrão globular predominou no tronco e nas partes superiores do corpo na presente série. Entretanto, o padrão homogêneo foi o padrão mais comum observado nas extremidades inferiores em vez do padrão reticular. Isso pode ser explicado pela inclusão de todos os nevos de qualquer tamanho, em contraste com os estudos citados, nos quais até seis nevos por participante23 ou nevos maiores que 2mm de diâmetro foram selecionados de cada região anatômica.22
Exposição ultravioletaA exposição ultravioleta8,10 e histórico de queimadura solar3,8,12,17 foram associados a aumento no número de nevos melanocíticos. As evidências sobre o impacto do uso de protetor solar na contagem total de nevos durante a infância são controversas.12,38 Entretanto, os estudos variaram em metodologia, incluindo o desenho do estudo, as faixas etárias e o limite inferior do tamanho do nevo examinado. Além disso, o fator de proteção solar, a resistência à água e os detalhes sobre a aplicação do protetor solar nem sempre foram questionados.12,38 Os relatos indicando aumento na contagem de nevos com o uso do protetor solar podem ser explicados pelo uso do protetor solar principalmente em crianças com fototipos de pele clara, que são mais propensas a queimaduras solares e já têm propensão maior ao desenvolvimento de nevos. A exposição prolongada ao sol de crianças após a aplicação do protetor solar e as respostas tendenciosas dos pais em relação à sua estratégia real de uso do protetor solar em seus filhos em virtude da pressão social podem ser outras causas.8,12,38
Maior número de nevos globulares e menor número de nevos reticulares foram associados ao uso de protetor solar com FPS >30 em estudo recente na Grécia.3 Essa observação reforça ainda mais a relação entre o padrão reticular e a exposição ultravioleta proposta no conceito duplo de nevogênese. No presente estudo, nenhum impacto do uso do protetor solar no número ou padrão dermatoscópico de nevos melanocíticos foi observado, o que também pode estar relacionado aos fatores enganosos discutidos acima.
O pequeno tamanho da amostra foi a principal limitação do presente estudo. Além disso, houve possível viés de resposta nas respostas dos pais sobre o uso de protetor solar e o histórico de queimaduras solares. O número limitado de pais relatando histórico de queimaduras solares em seus filhos dificultou a avaliação do seu impacto no número de nevos e no padrão dermatoscópico. O principal ponto forte do presente estudo foi o exame corporal completo dos participantes e a inclusão de todos os nevos, independentemente do tamanho. Além disso, o grupo de estudo representa a população pediátrica turca em geral, pois os participantes foram selecionados entre pacientes de uma clínica ambulatorial geral, não de uma clínica de seguimento para lesões melanocíticas.
ConclusõesA nevogênese é um processo complexo decorrente da interação significante entre fatores genéticos e ambientais. A idade e o local anatômico foram os fatores mais relevantes que influenciaram o número e os padrões dermatoscópicos dos nevos no presente estudo. A predominância do padrão globular na infância e a taxa crescente do padrão reticular na adolescência apoiam o conceito duplo de nevogênese.34 Os padrões dermatoscópicos diferentes nas diversas regiões anatômicas também confirmam a presença de vias de desenvolvimento distintas. O padrão de distribuição de nevos relacionado ao gênero, sem qualquer efeito do uso de protetor solar na contagem de nevos ou no padrão dermatoscópico, sugere ainda predisposição genética.
Suporte financeiroNenhum.
Contribuição dos autoresZeynep Keskinkaya: Concepção e planejamento do estudo, obtenção, análise e interpretação dos dados, análise estatística, elaboração e redação do manuscrito, revisão crítica de conteúdo intelectual importante, participação efetiva na orientação da pesquisa, participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados, revisão crítica da literatura, aprovação da versão final do manuscrito.
Özge Kaya: Concepção e planejamento do estudo, análise e interpretação dos dados, elaboração e redação do manuscrito, revisão crítica de conteúdo intelectual importante, participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados, aprovação da versão final do manuscrito.
Selda Işık Mermutlu: Concepção e planejamento do estudo, análise e interpretação dos dados, elaboração e redação do manuscrito, revisão crítica de conteúdo intelectual importante, participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados, aprovação da versão final do manuscrito.
Hilay Garipcan Karaemir: Concepção e planejamento do estudo, obtenção, análise e interpretação dos dados, elaboração e redação do manuscrito, revisão crítica de conteúdo intelectual importante, participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados, aprovação da versão final do manuscrito.
Sevilay Oğuz Kılıç: Concepção e planejamento do estudo, análise e interpretação dos dados, elaboração e redação do manuscrito, revisão crítica de conteúdo intelectual importante, participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados, aprovação da versão final do manuscrito.
Como citar este artigo: Keskinkaya Z, Kaya Ö, İsik Mermutlu S, Karaemir HG, Kılıç SO. Clinical and dermoscopic patterns of acquired melanocytic nevi in children and adolescents: a cross‐sectional study from Turkey. An Bras Dermatol. 2025;100:22–30.
Trabalho realizado na Faculdade de Medicina, Çanakkale Onsekiz Mart University, Çanakkale, Turquia.