Avaliar a segurança e eficácia do dupilumabe no tratamento do penfigoide bolhoso moderado a grave.
MétodosFoi realizada revisão sistemática e metanálise de estudos comparativos de dupilumabe combinado com corticosteroides e corticoterapia convencional isolada em pacientes com penfigoide bolhoso moderado a grave. As bases de dados PubMed, Embase e Cochrane foram pesquisadas para estudos publicados até dezembro de 2023. Os dados foram extraídos de relatos publicados e a avaliação da qualidade foi realizada de acordo com as recomendações da Cochrane.
ResultadosNo total, quatro estudos envolvendo 127 pacientes foram incluídos, dos quais 53 receberam dupilumabe combinado com corticosteroides, enquanto os outros 74 receberam corticosteroides isoladamente. Em relação à eficácia, o dupilumabe diminuiu o tempo até a interrupção da formação de novas bolhas (DM=−5,13 dias; IC95% −7,12 a −3,15; p<0,0001) e demonstrou maior redução no Bullous Pemphigoid Disease Area Index (DM=−3,90; IC95% −5,52 a −2,27; p<0,0001) e na Numeric Rating Scale for Pruritus (DMP=−1,37; IC95% −2,02 a −0,72; p<0,0001) em comparação com pacientes que receberam terapia convencional. Quanto aos desfechos de segurança, eventos adversos (RR=0,78; IC95% 0,58 a 1,05; p=0,10) e recorrências (RR=0,50; IC95% 0,19 a 1,36; p=0,17) não houve significância. As principais limitações foram estudos retrospectivos com amostras pequenas, e resultados limitados na prática clínica e risco geral moderado de viés.
ConclusãoEm comparação com a terapia convencional, o dupilumabe diminuiu o tempo até a interrupção da formação de novas bolhas em 5,13 dias, bem como melhora do Disease Area Index e prurido, sem interferir nos eventos adversos e na recorrência.
O penfigoide bolhoso (PB) é a doença bolhosa autoimune mais comum em pacientes idosos, apresentando prurido e bolhas tensas.1,2 É comumente associada a neoplasias, medicamentos e outras doenças autoimunes, como lúpus eritematoso sistêmico e esclerodermia.3 O tratamento convencional do PB é feito com base em corticosteroides sistêmicos associados ou não a imunossupressores. Essa terapia é limitada devido aos eventos adversos causados pelas comorbidades associadas e ao longo tempo de uso em pacientes idosos.4,5
Embora a fisiopatologia não seja clara, o PB é mediado por anticorpos que têm como alvo as proteínas hemidesmossomos – BP180 e BP230. Estudos identificaram que as células T auxiliares (Th2) respondem produzindo citocinas como as interleucinas (IL)‐4, ‐5, ‐9 e ‐13, que poderiam induzir a produção de IgE em linfócitos B, contribuindo para a perda de tolerância contra BP180 e eosinofilia.6,7
O dupilumabe (DP) é anticorpo monoclonal humanizado recombinante diretamente direcionado à subunidade alfa do receptor da IL‐4 que foi aprovado para dermatite atópica moderada a grave. Além disso, o DP bloqueia a transdução de sinal a jusante das citocinas fundamentais IL‐4 e IL‐13 na inflamação tipo 2 e na gênese do prurido.8
Considerando a correlação entre a fisiopatologia do PB e a farmacocinética do DP, bem como seu papel emergente no tratamento da dermatite atópica, é necessária investigação mais aprofundada para avaliar o potencial do DP como nova terapia para doenças bolhosas autoimunes. A última revisão sistemática e metanálise sobre o assunto avaliou diversos agentes biológicos para o PB, uma vez que os dados eram limitados.3 Desde então, dois estudos recentes foram publicados, aumentando substancialmente a população avaliada.9,10 Outra revisão sistemática analisou rituximabe, omalizumabe e dupilumabe, incluindo apenas 36 pacientes tratados com dupilumabe e sem grupo controle para comparação adequada.11 A escassez de ensaios clínicos randomizados nesse campo destaca múltiplos desafios e implicações, com base no uso de longa data de corticosteroides como tratamento primário para o PB.4,5 Preocupações éticas emergem ao projetar‐se ensaios comparando terapias mais recentes, como o dupilumabe, com os padrões estabelecidos, dada a eficácia bem documentada dos corticosteroides e a raridade do PB, bem como investimentos financeiros e de recursos significantes para tais estudos.
À luz dessa questão, foi realizada revisão sistemática e metanálise avaliando a eficácia e a segurança do DP combinado com corticosteroides e terapia convencional com corticosteroides isoladamente, explorando populações com PB moderado a grave.
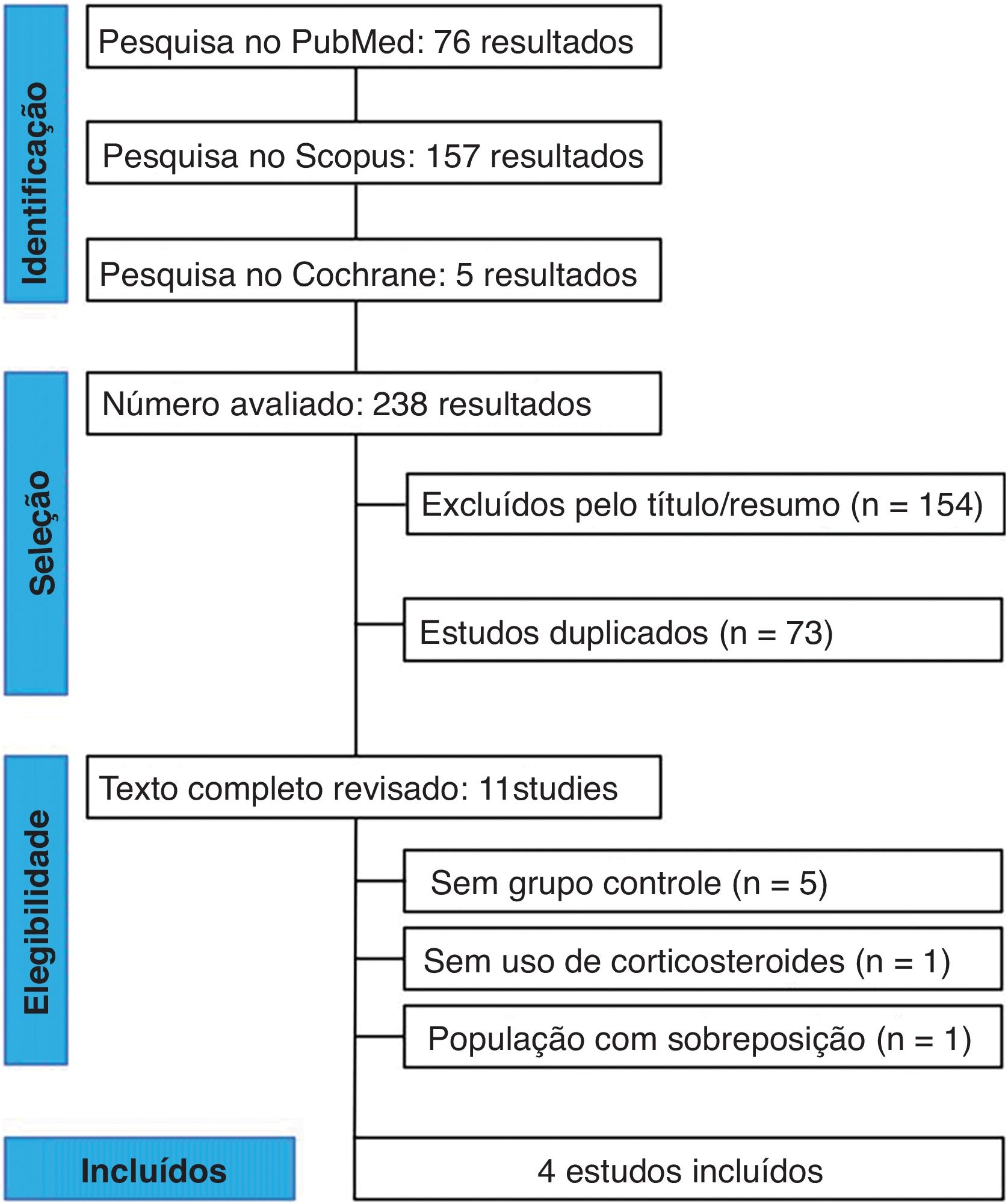
MétodosA inclusão nesta metanálise foi restrita a estudos que atenderam a todos os seguintes critérios, de acordo com a estratégia PICOS: 1) população: pacientes com PB moderado a grave; 2) intervenção: DP associado à metilprednisolona; 3) comparação: corticosteroide isolado; 4) desfechos (outcomes): qualquer um dos desfechos desejados descritos abaixo; 5) tipo de estudo: estudos de coorte ou ensaios clínicos escritos em inglês. Foram excluídos estudos sem grupo controle, população com sobreposição, entrada apenas de registro de ensaios clínicos, estudos não humanos e estudos relatados apenas como resumos.
Foi realizada busca sistemática no registro central de ensaios controlados dos bancos de dados PubMed, Embase e Cochrane desde o início até dezembro de 2023 com a seguinte estratégia de pesquisa: “Dupilumab” AND “bullous pemphigoid”. As referências de todos os estudos incluídos também foram pesquisadas manualmente para quaisquer estudos adicionais. Dois autores (J.O.N. e R.R.S.) extraíram os dados de maneira independente, seguindo critérios de busca predefinidos e avaliação de qualidade. O protocolo de metanálise prospectiva foi registrado no PROSPERO sob o número de registro CRD42024498942.
Os resultados incluíram: tempo até a interrupção de formação de novas bolhas (dias), Bullous Pemphigoid Disease Area Index (BPDAI), Numeric Rating Scale (NRS) para coceira/prurido, tempo para reduzir a metilprednisolona (dias), dosagem cumulativa e de manutenção de metilprednisolona (miligramas), qualquer resultado adverso e recorrência.
Foi avaliado o risco de viés usando a ferramenta ROBINS‐I (Risk Of Bias In Non‐Randomised Studies – of Interventions).12 Dois autores independentes completaram a avaliação do risco de viés (R.R.S e J.O.N.S). As discordâncias foram resolvidas por meio de consenso após discutir os motivos das discrepâncias. Cada estudo recebeu risco geral de viés baixo, moderado, grave, crítico ou nenhuma informação de acordo com sete domínios: fatores de confundimento, seleção, classificação da intervenção, desvio da intervenção pretendida, dados ausentes, mensuração dos desfechos e seleção dos resultados relatados.
A publicação da avaliação de viés com gráficos de funil não é indicada para metanálise com menos de dez estudos incluídos, de acordo com a diretriz da Cochrane Collaboration. Portanto, os autores utilizaram um checklist, desenvolvido para facilitar a avaliação da certeza das evidências de acordo com o sistema “Grading of Recommendations Assessment, Development and Evaluation” (GRADE), incluindo um questionário sobre viés de publicação.13 Essa ferramenta compreende pesquisa abrangente, avaliação da literatura cinzenta, restrição na base do idioma na seleção do estudo, indicação de grande influência da indústria, assimetria do gráfico de funil e discrepância com os ensaios publicados.
A certeza da evidência foi classificada de acordo com o método GRADE, e uma tabela de resumo dos achados foi gerada pelo GRADEpro GDT. A revisão sistemática e a metanálise foram realizadas e relatadas de acordo com o Cochrane Collaboration Handbook for Systematic Review of Interventions, e as diretrizes da declaração Preferred Reporting Items for Systematic Reviews and Meta‐analysis (PRISMA).14,15
O software Review Manager 5.3 (Cochrane Center, The Cochrane Collaboration, Dinamarca) foi utilizado para análise estatística. Razões de risco (RR) com intervalos de confiança de 95% foram usadas para comparar o efeito do tratamento para desfechos categóricos. Os desfechos contínuos foram comparados com a diferença média (DM) e a diferença média padronizada (DMP). Quando os estudos não relataram desvio padrão, o valor de p foi usado para inferir a medida de dispersão, de acordo com as recomendações da Cochrane.12 Foi avaliada a heterogeneidade com estatística I2 e teste Q de Cochran; valores de p<0,1 e I2>25% foram considerados significantes para heterogeneidade. Foi utilizado o modelo de efeito fixo para desfechos com baixa heterogeneidade (I2 < 25%). Caso contrário, o modelo de efeitos aleatórios de DerSimonian e Laird foi usado. Também foram realizadas análises de sensibilidade excluindo estudos individuais para avaliar o impacto de um único estudo em cada desfecho.
ResultadosComo detalhado na figura 1, a pesquisa inicial produziu 238 resultados. Após a remoção dos registros duplicados e estudos com critério de exclusão com base na revisão de título/resumo, 11 estudos permaneceram e foram totalmente revisados para os critérios de inclusão e exclusão; cinco estudos foram excluídos por falta de grupo controle.16–20 Além disso, um estudo foi descartado em virtude de não terem sido usados corticosteroides, e um estudo apresentou sobreposição de populações.21,22 Em última análise, um total de 127 pacientes de quatro estudos foram incluídos nessa revisão sistemática e metanálise: 53 tratados com DP combinado com corticosteroides e outros 74 com corticoterapia convencional.1,7,9,10
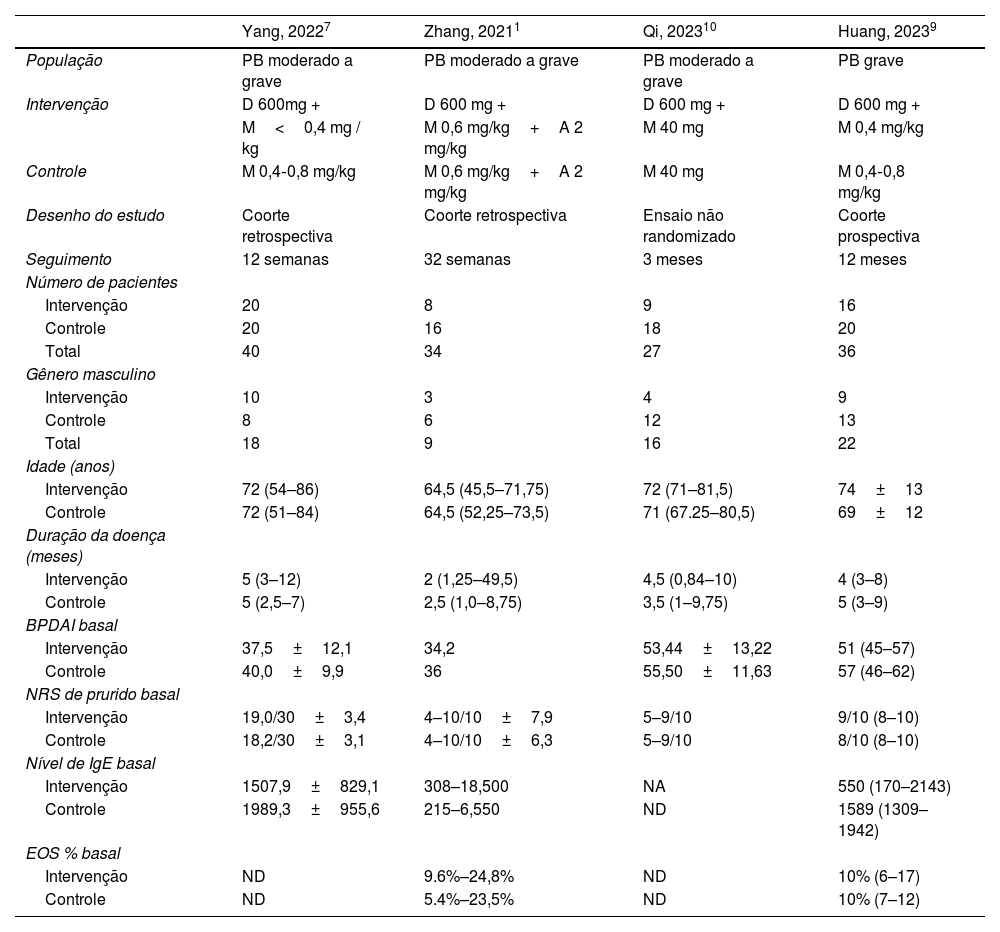
Dentro dessa coorte, a mediana da idade da coorte de pacientes nos estudos incluídos tendeu a indivíduos na faixa dos 70 anos (média de idade de 74 anos na intervenção e 69 no controle). As características basais das populações de cada estudo são apresentadas na tabela 1.
Características basais dos estudos incluídos na metanálise
| Yang, 20227 | Zhang, 20211 | Qi, 202310 | Huang, 20239 | |
|---|---|---|---|---|
| População | PB moderado a grave | PB moderado a grave | PB moderado a grave | PB grave |
| Intervenção | D 600mg + | D 600 mg + | D 600 mg + | D 600 mg + |
| M<0,4 mg / kg | M 0,6 mg/kg+A 2 mg/kg | M 40 mg | M 0,4 mg/kg | |
| Controle | M 0,4‐0,8 mg/kg | M 0,6 mg/kg+A 2 mg/kg | M 40 mg | M 0,4‐0,8 mg/kg |
| Desenho do estudo | Coorte retrospectiva | Coorte retrospectiva | Ensaio não randomizado | Coorte prospectiva |
| Seguimento | 12 semanas | 32 semanas | 3 meses | 12 meses |
| Número de pacientes | ||||
| Intervenção | 20 | 8 | 9 | 16 |
| Controle | 20 | 16 | 18 | 20 |
| Total | 40 | 34 | 27 | 36 |
| Gênero masculino | ||||
| Intervenção | 10 | 3 | 4 | 9 |
| Controle | 8 | 6 | 12 | 13 |
| Total | 18 | 9 | 16 | 22 |
| Idade (anos) | ||||
| Intervenção | 72 (54–86) | 64,5 (45,5–71,75) | 72 (71–81,5) | 74±13 |
| Controle | 72 (51–84) | 64,5 (52,25–73,5) | 71 (67.25–80,5) | 69±12 |
| Duração da doença (meses) | ||||
| Intervenção | 5 (3–12) | 2 (1,25–49,5) | 4,5 (0,84–10) | 4 (3–8) |
| Controle | 5 (2,5–7) | 2,5 (1,0–8,75) | 3,5 (1–9,75) | 5 (3–9) |
| BPDAI basal | ||||
| Intervenção | 37,5±12,1 | 34,2 | 53,44±13,22 | 51 (45–57) |
| Controle | 40,0±9,9 | 36 | 55,50±11,63 | 57 (46–62) |
| NRS de prurido basal | ||||
| Intervenção | 19,0/30±3,4 | 4–10/10±7,9 | 5–9/10 | 9/10 (8–10) |
| Controle | 18,2/30±3,1 | 4–10/10±6,3 | 5–9/10 | 8/10 (8–10) |
| Nível de IgE basal | ||||
| Intervenção | 1507,9±829,1 | 308–18,500 | NA | 550 (170–2143) |
| Controle | 1989,3±955,6 | 215–6,550 | ND | 1589 (1309–1942) |
| EOS % basal | ||||
| Intervenção | ND | 9.6%–24,8% | ND | 10% (6–17) |
| Controle | ND | 5.4%–23,5% | ND | 10% (7–12) |
PB, penfigoide bolhoso; D, dupilumabe; M, metilprednisolona; A, azatioprina; BPDAI, Bullous Pemphigoid Disease Area Index; NRS, NumericRating Scale; EOS, eosinofilia; ND, não disponível.
* Número absoluto (porcentagem) e mediana (desvio padrão).
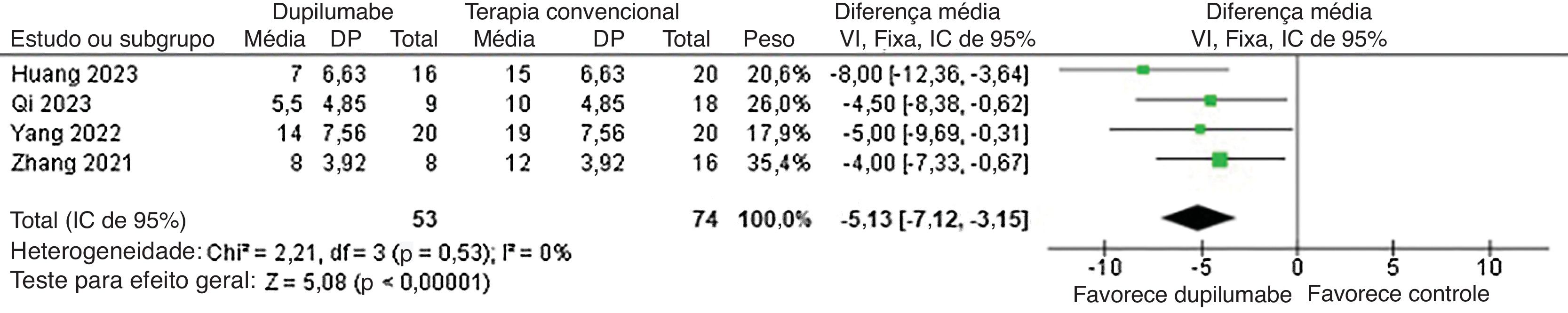
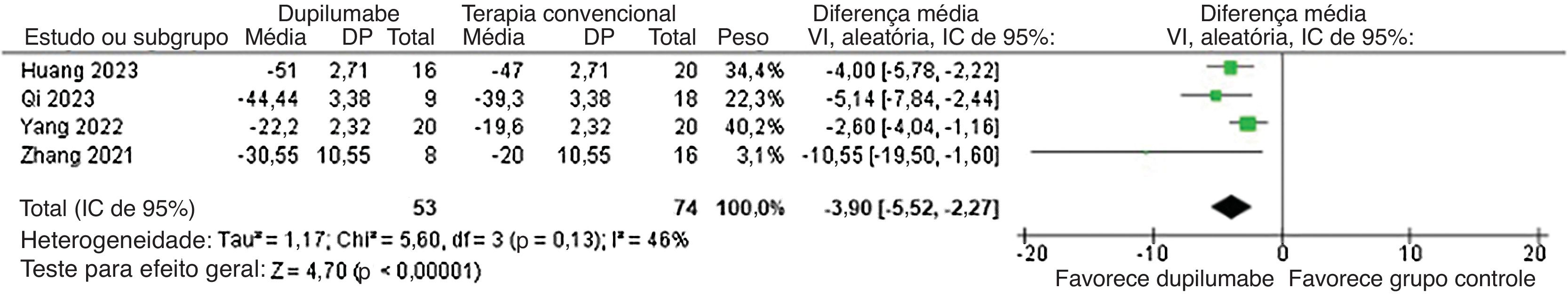
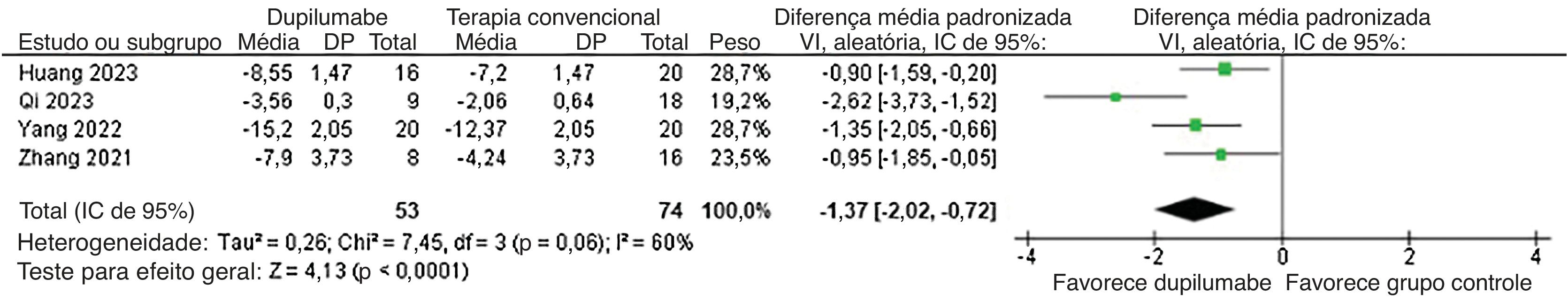
Com relação à eficácia, o DP diminuiu o tempo até a interrupção da formação de novas bolhas (DM=−5,13 dias; IC95% −7,12 a −3,15; p<0,0001; I2=0%; fig. 2) e mostrou redução maior no BPDAI (DM=−3,90; IC95% −5,52 a −2,27; p<0,0001; I2=46%; fig. 3) e na mudança do escore de prurido NRS (DMP=−1,37; IC95% −2,02 a −0,72; p<0,0001; I2=60%; fig. 4) da linha basal em comparação com pacientes que receberam terapia convencional.
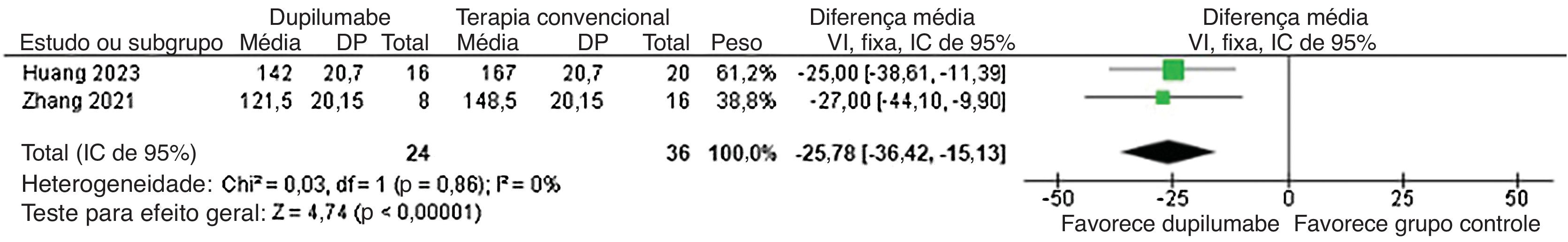
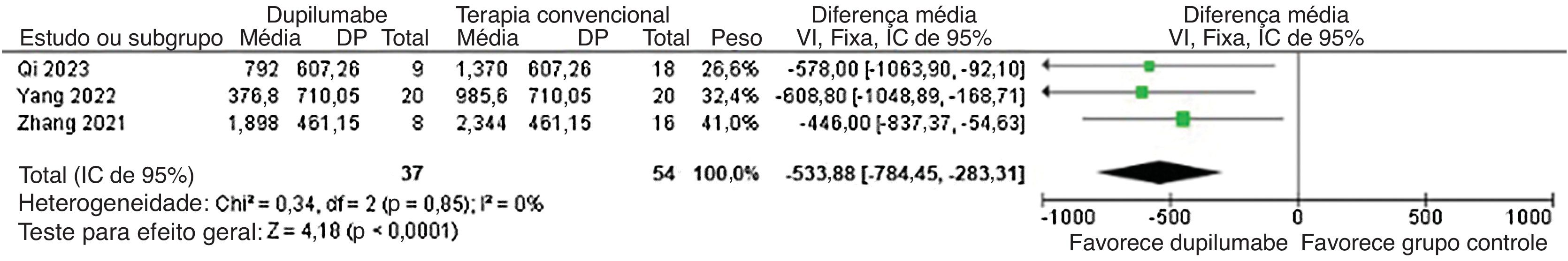
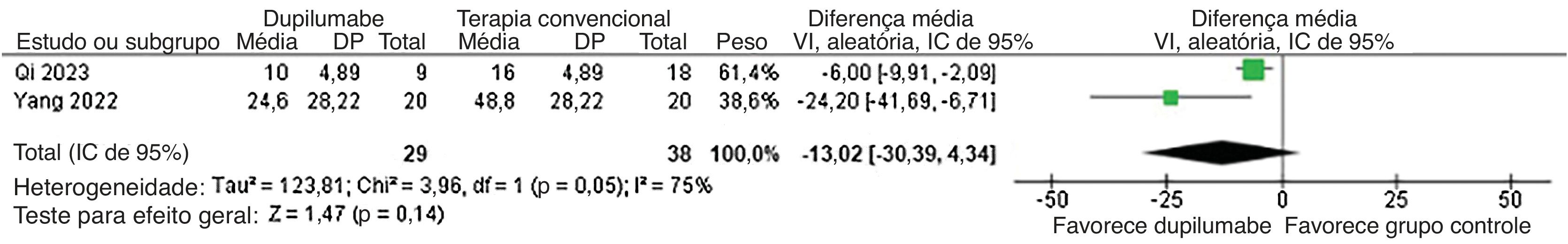
Além disso, o tempo para reduzir a metilprednisolona (DM=−25,78 dias; IC95% −36,42 a −15,13; p<0,0001; I2=0%; fig. 5) e dosagem cumulativa de metilprednisolona (DM=−533,88mg; IC95% −784,45 a −283,31; p<0,0001, I2=0%; fig. 6) foi menor no grupo DP. Enquanto isso, a dose de manutenção (DM=−13,02mg; IC95% −30,39 a 4,34; p=0,14; I2=75%; fig. 7) não mostrou significância. Já para os resultados relatados nas figuras 5 e 7, apenas dois estudos participaram da análise em decorrência da falta de dados.
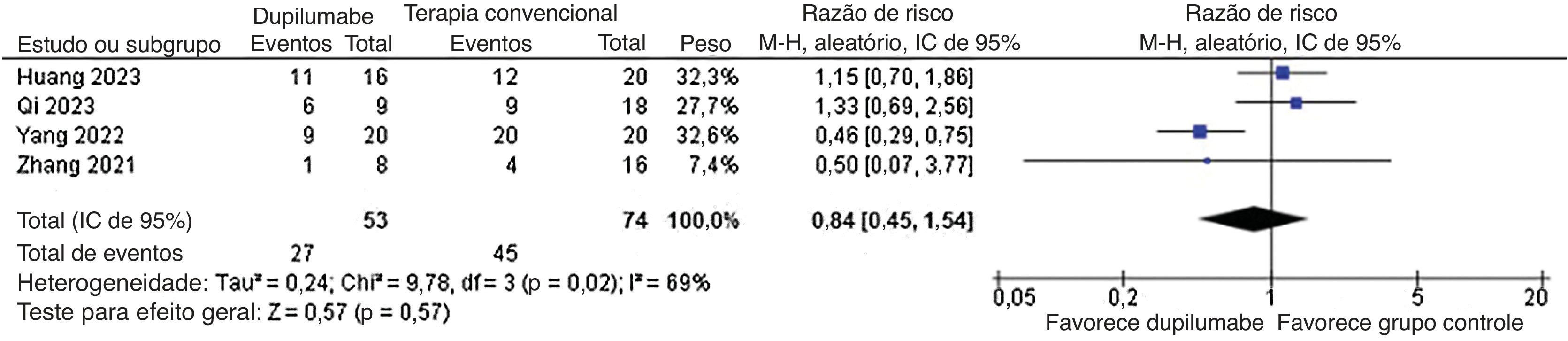
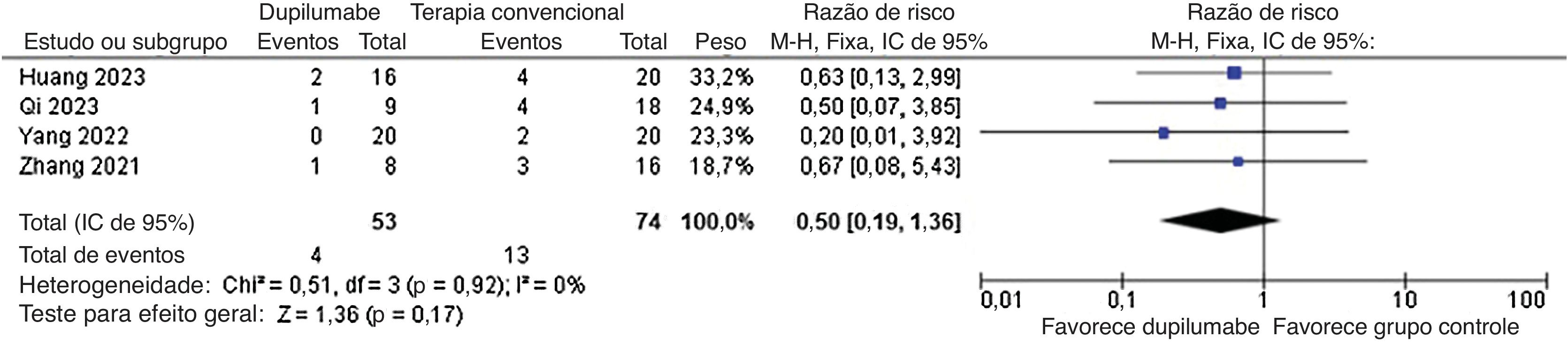
Quanto aos desfechos de segurança, qualquer evento adverso (RR=0,78; IC95% 0,58 a 1,05; p=0,10; I2=69%; fig. 8) e recorrência (RR=0,50; IC95% 0,19 a 1,36; p=0,17; I2=0%; fig. 9) não mostraram significância. Nenhum evento adverso grave como morte foi relatado pelos estudos incluídos.
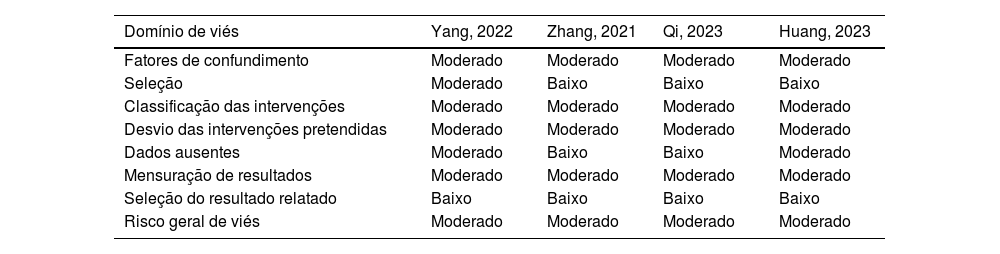
A tabela 2 descreve a avaliação individual de cada artigo incluído na metanálise. Em geral, todos os estudos foram considerados com risco moderado de viés. Os principais motivos foram os seguintes: ensaios não randomizados levando a algumas preocupações sobre fatores de confundimento, dois estudos tiveram análises retrospectivas, esquemas de tratamento não completamente expostos na seção de métodos, regularidade da medida de desfecho não claramente declarada e perda de seguimento. Após o uso do checklist, o viés de publicação foi considerado não detectado. Na análise de sensibilidade, não houve impacto de estudos únicos em nenhum dos desfechos relatados.
Avaliação de risco de viés dos estudos incluídos na metanálise
| Domínio de viés | Yang, 2022 | Zhang, 2021 | Qi, 2023 | Huang, 2023 |
|---|---|---|---|---|
| Fatores de confundimento | Moderado | Moderado | Moderado | Moderado |
| Seleção | Moderado | Baixo | Baixo | Baixo |
| Classificação das intervenções | Moderado | Moderado | Moderado | Moderado |
| Desvio das intervenções pretendidas | Moderado | Moderado | Moderado | Moderado |
| Dados ausentes | Moderado | Baixo | Baixo | Moderado |
| Mensuração de resultados | Moderado | Moderado | Moderado | Moderado |
| Seleção do resultado relatado | Baixo | Baixo | Baixo | Baixo |
| Risco geral de viés | Moderado | Moderado | Moderado | Moderado |
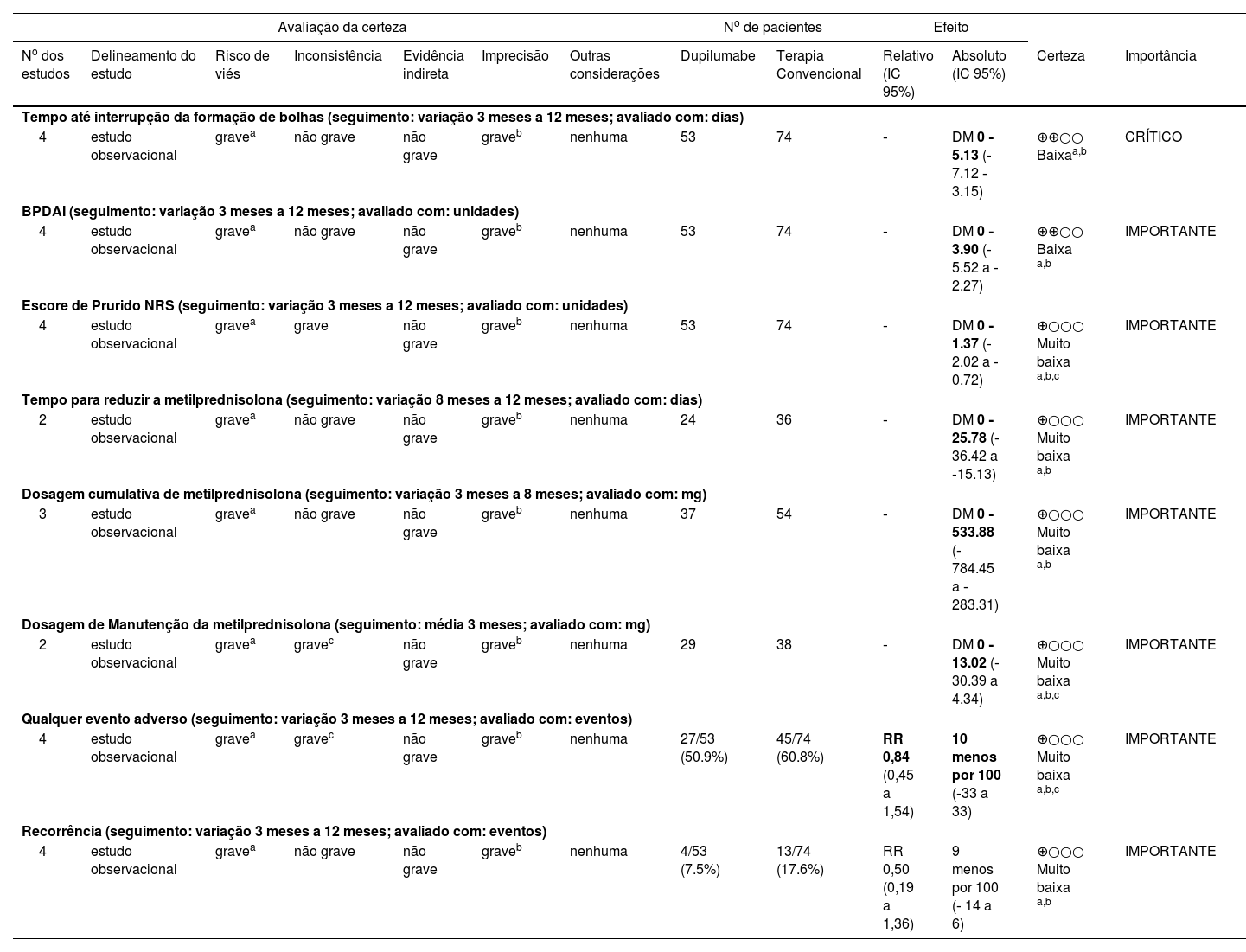
A avaliação da Certeza da Evidência de acordo com o método GRADE revelou baixa certeza para o tempo até a interrupção de formação de bolhas e alteração do BPDAI desde a linha basal; os demais desfechos foram considerados de muito baixa certeza. Os detalhes são encontrados no Resumo dos Achados (tabela 3).
Resumo dos achados e certeza das evidências de acordo com o Grading of Recommendation Assessment, Development and Evaluation (GRADE)
| Avaliação da certeza | No de pacientes | Efeito | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| No dos estudos | Delineamento do estudo | Risco de viés | Inconsistência | Evidência indireta | Imprecisão | Outras considerações | Dupilumabe | Terapia Convencional | Relativo (IC 95%) | Absoluto (IC 95%) | Certeza | Importância |
| Tempo até interrupção da formação de bolhas (seguimento: variação 3 meses a 12 meses; avaliado com: dias) | ||||||||||||
| 4 | estudo observacional | gravea | não grave | não grave | graveb | nenhuma | 53 | 74 | ‐ | DM 0 ‐5.13 (‐7.12 ‐3.15) | ⊕⊕○○ Baixaa,b | CRÍTICO |
| BPDAI (seguimento: variação 3 meses a 12 meses; avaliado com: unidades) | ||||||||||||
| 4 | estudo observacional | gravea | não grave | não grave | graveb | nenhuma | 53 | 74 | ‐ | DM 0 ‐3.90 (‐5.52 a ‐2.27) | ⊕⊕○○ Baixa a,b | IMPORTANTE |
| Escore de Prurido NRS (seguimento: variação 3 meses a 12 meses; avaliado com: unidades) | ||||||||||||
| 4 | estudo observacional | gravea | grave | não grave | graveb | nenhuma | 53 | 74 | ‐ | DM 0 ‐1.37 (‐2.02 a ‐0.72) | ⊕○○○ Muito baixa a,b,c | IMPORTANTE |
| Tempo para reduzir a metilprednisolona (seguimento: variação 8 meses a 12 meses; avaliado com: dias) | ||||||||||||
| 2 | estudo observacional | gravea | não grave | não grave | graveb | nenhuma | 24 | 36 | ‐ | DM 0 ‐25.78 (‐36.42 a ‐15.13) | ⊕○○○ Muito baixa a,b | IMPORTANTE |
| Dosagem cumulativa de metilprednisolona (seguimento: variação 3 meses a 8 meses; avaliado com: mg) | ||||||||||||
| 3 | estudo observacional | gravea | não grave | não grave | graveb | nenhuma | 37 | 54 | ‐ | DM 0 ‐533.88 (‐784.45 a ‐283.31) | ⊕○○○ Muito baixa a,b | IMPORTANTE |
| Dosagem de Manutenção da metilprednisolona (seguimento: média 3 meses; avaliado com: mg) | ||||||||||||
| 2 | estudo observacional | gravea | gravec | não grave | graveb | nenhuma | 29 | 38 | ‐ | DM 0 ‐13.02 (‐30.39 a 4.34) | ⊕○○○ Muito baixa a,b,c | IMPORTANTE |
| Qualquer evento adverso (seguimento: variação 3 meses a 12 meses; avaliado com: eventos) | ||||||||||||
| 4 | estudo observacional | gravea | gravec | não grave | graveb | nenhuma | 27/53 (50.9%) | 45/74 (60.8%) | RR 0,84 (0,45 a 1,54) | 10 menos por 100 (‐33 a 33) | ⊕○○○ Muito baixa a,b,c | IMPORTANTE |
| Recorrência (seguimento: variação 3 meses a 12 meses; avaliado com: eventos) | ||||||||||||
| 4 | estudo observacional | gravea | não grave | não grave | graveb | nenhuma | 4/53 (7.5%) | 13/74 (17.6%) | RR 0,50 (0,19 a 1,36) | 9 menos por 100 (‐ 14 a 6) | ⊕○○○ Muito baixa a,b | IMPORTANTE |
IC, Intervalo de confiança; DM, Diferença média; RR, Razão de risco.
Explicações
Nesta revisão sistemática e metanálise de quatro estudos e 127 pacientes, o DP combinado com corticosteroides foi comparado à corticoterapia convencional isolada em pacientes com PB moderado a grave. Os principais achados foram os seguintes: 1) DP diminuiu o tempo até a interrupção de formação de novas bolhas com DM de −5,13 dias; 2) houve redução 3,90 maior do BPDAI no grupo DP; 3) o DP reduziu significantemente o escore de prurido NRS com DMP de −1,37, em comparação com a terapia convencional; 4) não houve diferenças em relação a eventos adversos e recorrência.
Os corticosteroides tópicos de alta potência são considerados tratamento de primeira linha para o PB, como demonstrado em ensaio clínico randomizado e controlado, que encontrou eficácia semelhante com redução dos efeitos colaterais e da taxa de mortalidade quando comparados à terapia sistêmica.23,24 No entanto, a dificuldade de um paciente idoso ou cuidador em aplicar corticosteroides tópicos diariamente em áreas extensas pode levar à seleção de corticosteroide oral para terapia inicial.24,25 Nesse sentido, a terapia sistêmica representa um desafio, uma vez que regimes prolongados causam eventos adversos graves.23
Além disso, a mortalidade do PB variou de 9,3% a 41%, com associação significante com metilprednisolona sistêmica, revelando a importância do desenvolvimento de terapia poupadora de corticosteroide23,26,27. Os imunossupressores devem ser considerados tratamento de segunda linha para reduzir a dose de corticosteroides, dependendo do perfil de segurança, da experiência do médico e das comorbidades dos pacientes. Azatioprina, doxiciclina e metotrexato foram as opções mais estudadas, e a imunoglobulina também foi avaliada para casos refratários.23,28–30 Wiliams et al. conduziram ensaio clínico randomizado com 132 pacientes para analisar a eficácia da doxiciclina em comparação com a prednisolona no tratamento do PB.31 A doxiciclina não foi tão eficaz quanto a terapia com corticoides, com taxa 18,6% menor no controle da doença na 6ª semana, embora tenha apresentado redução de 18,1% (p=0,002) em eventos adversos graves, potencialmente fatais ou fatais em 52 semanas.
Não há evidências de qualidade que apontem para terapia poupadora de corticosteroides eficaz sem a elevação de eventos adversos para o PB, demonstrando a necessidade de investigar novos medicamentos.23 Considerando o impacto do anti‐BP180 no controle da doença, principalmente dos anticorpos IgG4 e IgE, a inibição da IL‐4 pode ser opção adequada no tratamento do PB, por exemplo, o DP.32
Uma revisão Cochrane publicada recentemente recomenda corticosteroide tópico para PB localizado como alternativa à prednisolona oral em relação a eventos adversos. Além disso, a doxiciclina também pode ser utilizada como abordagem inicial para a maioria dos pacientes com PB. Entretanto, não há recomendação para dupilumabe, provavelmente em virtude da falta de evidências. Outros agentes biológicos não foram superiores ao placebo, como o mepolizumabe.33
Em relação ao perfil de segurança, um grande ensaio clínico observou que os principais eventos adversos associados ao DP foram infecções de tecidos moles e eosinofilia, enquanto conjuntivite, eritema facial, psoríase e pneumonia foram incomuns, relacionados à idade avançada e comorbidades.32 Por outro lado, a presente metanálise não encontrou significância em relação aos eventos adversos, indicando o DP como opção de tratamento viável.
Um painel internacional de especialistas definiu a remissão parcial com terapia mínima como a presença de novas lesões transitórias que cicatrizam em uma semana, enquanto o paciente está recebendo terapia mínima por pelo menos dois meses. Além disso, remissão completa com terapia mínima é a ausência de lesões novas ou estabelecidas ou prurido enquanto o paciente estiver recebendo terapia mínima por pelo menos dois meses. Além disso, os especialistas classificam recorrência/exacerbação como o aparecimento de três ou mais lesões em um mês ou uma lesão eczematosa grande (> 10cm) que não cicatriza em uma semana, ou extensão de lesões estabelecidas ou prurido diário em paciente que alcançou o controle da doença.34 Considerando esse período, o seguimento dos estudos incluídos foi apropriado para a análise de eficácia, embora períodos mais longos pudessem avaliar melhor a recorrência e outros eventos adversos de longo prazo.
Como o PB causa exacerbações autolimitadas, que duram de vários meses a anos, o manejo envolve melhora na qualidade de vida com eventos adversos mínimos.23 Em estudos que avaliaram o DP em dermatite atópica, o controle do prurido mostrou aumento importante na satisfação do paciente; portanto, achados semelhantes podem ser esperados para o tratamento do PB.35,36
Após a interrupção do tratamento, aproximadamente metade dos pacientes apresenta recorrência, mais comumente nos primeiros três meses.23,37 A literatura sugere que a descontinuação da terapia inicial antes de 16 semanas leva a taxas de recorrência mais altas; portanto, a terapia prolongada pode mostrar resultados superiores.31 Desse modo, a terapia de manutenção desempenha papel importante no PB, que consiste em corticosteroides em baixas doses ou clobetasol tópico continuado por até seis meses após a remissão clínica.23 Entretanto, não houve diferença nas taxas de recorrência entre os grupos na presente metanálise.
A alta heterogeneidade demonstrada nos resultados do presente estudo deve‐se a diferentes fatores. O prurido e os eventos adversos do NRS, por exemplo, podem ser afetados pelo não cegamento de indivíduos e examinadores. Enquanto isso, Zhang et al. adicionaram azatioprina a ambos os regimes de tratamento, o que poderia ter impactado os resultados de tempo para redução gradual e dosagem cumulativa de metilprednisolona.1
Além disso, os desfechos em relação à dosagem e redução gradual de corticosteroides não foram relatados por todos os estudos incluídos, limitando os achados do presente estudo em virtude do viés da falta de dados. A impossibilidade de coletar dados dos estudos referentes à eosinofilia e à dosagem do nível de IgE não impactou os resultados do presente estudo, uma vez que esses eram desfechos secundários e não representavam desfechos clínicos.
Considerando que a presente metanálise incluiu estudos retrospectivos com amostras pequenas, os resultados têm implicações limitadas na prática clínica. Outra limitação é que a análise de desfechos secundários, como remissão parcial e tempo até a remissão, não foi viável, pois não havia dados suficientes acessíveis. Além disso, o risco geral de viés foi considerado moderado para os quatro estudos, o que levanta preocupações quanto à validade das evidências apresentadas. Esses dados podem ser importantes para orientar ensaios posteriores, uma vez que há apenas um ensaio clínico randomizado em andamento registrado em clinicaltrials.gov.38
Portanto, o DP demonstrou resultados promissores, com redução relevante no tempo até a interrupção de formação de novas bolhas e desfechos clínicos como prurido de acordo com o BPDAI e NRS, sem aumentar a recorrência ou eventos adversos. No entanto, a qualidade das evidências ainda é baixa e ensaios randomizados controlados devem ser conduzidos para atestar a real eficácia e segurança do DP no tratamento do PB moderado a grave.
Suporte financeiroNenhum.
Contribuição dos autoresJúlia Opolski Nunes da Silva: Concepção e planejamento do estudo; elaboração e redação do manuscrito ou revisão crítica de conteúdo intelectual importante; revisão crítica da literatura; aprovação da versão final do manuscrito.
Rodrigo Ribeiro e Silva: Obtenção dos dados, ou análise e interpretação dos dados; análise estatística; obtenção, análise e interpretação dos dados; aprovação da versão final do manuscrito.
Paulo Victor Zattar Ribeiro: Concepção e planejamento do estudo; elaboração e redação do manuscrito ou revisão crítica de conteúdo intelectual importante; revisão crítica da literatura; aprovação da versão final do manuscrito.
Patrícia Silva Farah: Concepção e planejamento do estudo; participação efetiva na orientação da pesquisa; aprovação da versão final do manuscrito.
Raquel Bissacotti Steglich: Concepção e planejamento do estudo; participação efetiva na orientação da pesquisa; aprovação da versão final do manuscrito.
Conflito de interessesNenhum.
Como citar este artigo: Silva JON, Silva RR, Zattar Ribeiro PV, Farah PS, Steglich RB. Efficacy and safety of dupilumab in patients with moderate‐to‐severe bullous pemphigoid: a systematic review and meta‐analysis. An Bras Dermatol. 2025;100:429–38.
Trabalho realizado na Universidade da Região de Joinville, Joinville, SC, Brasil.