As vantagens clínicas da terapia com diodo emissor de luz (LED) na cicatrização da pele e seu mecanismo subjacente permanecem assuntos de debate contínuo.
ObjetivoEste estudo visa explorar o impacto da terapia com LED em queratinócitos da pele normal (HaCaT) e no reparo de feridas dorsais de espessura total em ratos Wistar.
MétodosA viabilidade das células HaCaT (ensaio SRB) e a migração (scratch assay) foram avaliadas sob terapia com LED, comparando condições de estresse (2,5% de SFB) com irradiação simulada (sham) e condições ideais (10% de SFB). In vivo, 50 ratos com feridas induzidas foram divididos em grupos Sham e LED (tratamento diário). A eutanásia ocorreu em 3, 5, 10, 14 e 21 dias para análises clínicas, morfológicas, de estresse oxidativo (MDA, SOD e GSH) e de citocinas (IL‐1β, IL‐10, TNF‐α).
ResultadosA terapia com LED aumentou significantemente a viabilidade dos queratinócitos em comparação à irradiação simulada, com impacto mínimo na migração celular. Os benefícios clínicos foram proeminentes no dia 10, influenciando a progressão e a resolução da inflamação nos dias 3 e 10. A reepitelização permaneceu inalterada. Redução do nível de MDA e aumento do GSH foram observados ao longo do tempo, enquanto os níveis de SOD variaram temporalmente. Notavelmente, no dia 10, o LED diminuiu significantemente IL‐1β, IL‐10 e TNF‐α.
Limitações do estudoEmbora translacional, a confirmação dos benefícios observados no ensaio clínico é necessária.
ConclusõesA terapia com LED acelera a cicatrização cutânea no modelo experimental, modulando principalmente a inflamação e aumentando a atividade antioxidante.
Feridas na pele representam sobrecarga à assistência médica. As projeções de custo do Medicare para todas as feridas no conjunto de dados de 2014 variaram de US$ 28,1 a US$ 96,8 bilhões.1 Também é estimado que quase 2,5% da população total dos EUA enfrenta comprometimento da qualidade de vida associado a feridas crônicas, e isso provavelmente aumentará nas próximas décadas.2 Uma infinidade de fatores de risco ligados a feridas crônicas persistem ou estão em ascensão em nossa sociedade. Esses fatores incluem o envelhecimento da população, diabetes, obesidade e o surgimento de infecções resistentes a antibióticos. É fundamental identificar terapias que sejam seguras e eficazes do ponto de vista clínico. Do mesmo modo, compreender os mecanismos pelos quais essas terapias operam nos níveis celular e tecidual pode fornecer informações valiosas, permitindo sua aplicação com base em uma sólida justificativa biológica.
A fotobiomodulação (FBM) é abordagem terapêutica bem estabelecida para tratar processos inflamatórios, como feridas.3 Assim como para qualquer outra terapia medicamentosa, a dosagem, nessa circunstância chamada dosimetria, é de suma importância para a eficácia da terapia. Inclui comprimento de onda, densidade de potência, fluência, pulso, área irradiada (tamanho do ponto), tempo e número de sessões, entre outros. O grupo dos autores mostrou anteriormente que mudanças na densidade de energia4 ou comprimento de onda e potência5 influenciam a resposta celular e tecidual. A maioria dos estudos desenvolvidos avaliando FBM na cicatrização de feridas se concentrou em protocolos utilizando irradiação com laser luz vermelha ou próximo do infravermelho, mostrando resultados promissores.6–8 Ainda parece haver uma lacuna na literatura sobre os efeitos da irradiação de diodo emissor de luz (LED, do inglês Light‐Emitting Diode) vermelha.
A irradiação com LED e laser diferem em coerência e direcionalidade da luz. Outras diferenças podem ser vistas como vantagens do LED e justificam pesquisas adicionais sobre ele. Por exemplo, o tamanho tipicamente maior do spot dos dispositivos de LED geralmente facilita uma irradiação abrangente de toda a área da ferida, garantindo cobertura eficaz.9 Os aparelhos de LED também são consideravelmente mais baratos em comparação ao laser.10,11 Com base nessas vantagens e na falta de pesquisas profundas nessa área, o objetivo do presente estudo foi determinar os efeitos da terapia com LED vermelho na cicatrização de feridas cutâneas. Queratinócitos normais foram usados para avaliar os efeitos na proliferação e migração celular. Também foi investigado o impacto clínico e tecidual do LED vermelho usando modelos de feridas de espessura total. Mecanismos‐chave como estresse oxidativo e liberação de citocinas também foram examinados.
Material e métodosIrradiação com LEDPara modelos in vitro e in vivo, os grupos de irradiação receberam tratamento com aparelho de LED (Oncollux, Cosmedical, São Paulo, SP, Brasil) em formato de placa medindo 6×3×0,6cm e composto por seis spots de emissão de luz com comprimento de onda de 660 ±20nm e potência de 5 Mw. Cada irradiação durou sete minutos, fornecendo densidade de energia de 2,7J/cm2 de energia, 2J por spot.
Experimentos in vitroCultivo de célulasA linhagem de células de queratinócitos humanos imortalizados HaCaT (#T002000; AddexBio, San Diego, CA, EUA) foi adquirida no Banco de Células e Tecidos do Rio de Janeiro, Brasil. As células foram cultivadas em meio Eagle modificado por Dulbecco (meio de cultura DMEM‐high glucose; GIBCO, Thermo Fisher Scientific Inc, Waltham, MA, EUA), suplementado com 10% de soro fetal bovino (SFB; GIBCO) e 1% de penicilina‐estreptomicina (GIBCO). As células foram mantidas a 37°C, com 95% de umidade relativa e 5% de CO2. Todos os procedimentos de cultura foram realizados em condições estéreis em uma capela de fluxo laminar (Thermo Scientific 1300 série A2).
Divisão dos grupos experimentaisTrês grupos experimentais foram utilizados:
Controle de irradiação simulada 10% (Sham 10%): As células não foram irradiadas e foram cultivadas em meio completo (DMEM) com 10% de SFB.
Controle de irradiação simulada 2,5% (Sham 2,5%): As células não foram irradiadas e foram cultivadas em DMEM deficiente em nutrientes com 2,5% de SFB, simulando condição de estresse.
LED: As células foram irradiadas com LED e cultivadas em DMEM deficiente em nutrientes com 2,5% de SFB. A irradiação foi realizada em ambiente escuro, com o dispositivo LED colocado em contato direto com as placas de cultura. Para evitar qualquer dispersão de luz que pudesse afetar outros grupos, cada grupo experimental foi semeado em placas separadas. Os grupos Sham foram submetidos aos mesmos procedimentos que o grupo irradiado, com a diferença de que o dispositivo LED permaneceu desligado.
Avaliação da viabilidade celularA viabilidade celular foi determinada usando o ensaio de sulforrodamina B (SRB) como relatado anteriormente.5 Resumidamente, as células HaCaT foram semeadas em placa de 96 poços (Kasvi). Após a fixação adequada, o meio de cultura para todos os grupos (exceto Sham 10%) foi alterado para 2,5% de SFB. Após 2 horas, foi realizada a irradiação com LED e 24 horas depois as células foram submetidas ao ensaio SRB. A absorbância foi medida em comprimento de onda de 560nm usando leitor de microplacas (Synergy 2, BioTek Instruments, Inc). Esse ensaio foi realizado em sextuplicata.
Ensaio de migraçãoA migração celular foi avaliada usando o ensaio de arranhão (cicatrização de feridas). As células HaCaT foram cultivadas em placas de 12 poços até atingirem a confluência. Duas horas antes da irradiação com LED, o meio para grupos Sham 2,5% e LED foi substituído por meio de SFB 2,5%. Uma ponta de pipeta p200 foi utilizada para criar uma ferida na monocamada de células raspando duas linhas retas (vertical e horizontal), resultando em ferida em forma de cruz. Os resíduos celulares foram removidos por lavagens com PBS, e meio fresco foi adicionado de acordo com o grupo experimental. O grupo LED foi irradiado uma vez ao dia. Fotografias de áreas padrão da ferida foram tiradas nos tempos de 0h, 12h, 24h, 36h e 48h utilizando microscópio invertido. O software ImageJ (Fiji versão 1.44a, National Institutes of Health, Bethesda, MD, EUA) foi usado para medir a área da ferida aberta em cada tempo. Esse ensaio foi realizado em triplicata.
Estudo in vivoModelo animal e procedimento experimentalO presente estudo recebeu aprovação do Comitê de Ética para Uso de Animais do Hospital Universitário de Porto Alegre (HCPA, Brasil) sob o protocolo n° 2018‐0624. Todos os experimentos foram conduzidos seguindo as diretrizes descritas no “Guia para o Cuidado e Uso de Animais de Laboratório”. Os animais foram manuseados com tratamento humanizado. O tamanho da amostra foi determinado com base em estudos anteriores empregando metodologias semelhantes.4,5 Um total de 55 ratos machos de 8 semanas de idade (Rattus norvegicus albinus, Rodentia, Mammalia, linhagem Wistar), pesando entre 250g a 300g, foram usados. Os ratos foram alojados em grupos de dois a quatro animais sob condições de temperatura padrão (20° a 24°C) e um ciclo claro/escuro de 12 horas. Eles tinham acesso ad libitum a ração sólida e água. Para o procedimento da ferida, os animais foram anestesiados utilizando isoflurano inalável, e a futura área da ferida foi depilada. Feridas circulares de espessura total, com 10mm de diâmetro, foram criadas nas costas dos animais usando técnica de biopsia por punch. Para controlar a dor sem influenciar a resposta inflamatória, os animais receberam duas doses intraperitoneais diárias de tramadol (20mg/kg).
Os animais foram alocados aleatoriamente (com base no peso corporal) em dois grupos: Grupo Simulado (Sham; n=25) e Grupo LED (n=25). A terapia LED começou imediatamente após o procedimento cirúrgico e foi realizada diariamente até os dias de eutanásia predeterminados. O dispositivo LED foi colocado em contato com a úlcera cutânea, enquanto os animais no grupo Sham receberam tratamento idêntico sem irradiação de LED. Nos dias 3, 5, 10, 14 e 21, cinco ratos de cada grupo foram sacrificados utilizando anestesia inalatória com isoflurano. As lesões nas regiões dorsais foram fotografadas, excisadas e os espécimes foram processados para estudo histopatológico e análise de citocinas e atividade antioxidante.
Avaliação clínicaAs feridas foram documentadas ao lado de um objeto de referência com medidas preestabelecidas (1cm por 1cm). Um avaliador cego quantificou a área da ferida em pixels utilizando o software ImageJ 1.48v (National Institutes of Health, EUA). Posteriormente, os valores foram convertidos para milímetros quadrados (mm2) utilizando o objeto de referência como escala padrão.
Avaliação histopatológicaAmostras preservadas em formalina a 10% foram processadas para inclusão em parafina seguindo protocolo convencional. Cortes histológicos de 5μm de espessura foram obtidos e corados pelo método da hematoxilina e eosina para análise histopatológica. Dois patologistas experientes realizaram avaliação semiquantitativa da reepitelização e da inflamação, chegando a um escore final consensual.4 As avaliações foram realizadas de forma cega.
Os escores de reepitelização foram definidos da seguinte maneira:
Grau 0: Sem reepitelização.
Grau 1: Reepitelização cobrindo menos da metade da ferida.
Grau 2: Reepitelização cobrindo mais da metade da ferida.
Grau 3: Reepitelização cobrindo toda a ferida com espessura irregular.
Grau 4: Reepitelização cobrindo toda a ferida com espessura normal.
Os escores do processo inflamatório incluíram:
Grau 1: Inflamação aguda (exsudato fibrinoleucocitário na área superficial da ferida sem alterações vasculares no tecido conjuntivo subjacente).
Grau 2: Predominância de inflamação aguda difusa (fenômenos vasculares como edema e hiperemia predominantes).
Grau 3: Predominância de processo inflamatório crônico (presença de células inflamatórias, angiogênese e fibroplasia).
Grau 4: Resolução e cura (redução ou desaparecimento da inflamação crônica).
Análise redoxO estado redox foi avaliado medindo os níveis de malonaldeído (MDA), glutationa (GSH) e conteúdo de superóxido dismutase (SOD) como descrito anteriormente.5 O MDA é um subproduto da peroxidação lipídica, e níveis mais altos de MDA indicam aumento da atividade oxidativa, enquanto os níveis de GSH e SOD foram avaliados para determinar a atividade antioxidante. Os resultados foram expressos em nanomoles de MDA por grama de tecido, unidades de GSH por miligrama de tecido e U por grama de proteína para conteúdo de SOD.
Imunoensaios de citocinaOs níveis de citocinas foram quantificados seguindo as instruções do fabricante. Resumidamente, amostras de pele foram homogeneizadas e processadas. Os níveis de interleucina (IL)‐1β, IL‐10 e fator de necrose tumoral (TNF)‐α foram determinados usando kits comerciais de ensaio imunoenzimático (R & D Systems, Minneapolis, MN). Os resultados foram expressos em picogramas por mililitro (pg/mL).
Análise estatísticaOs dados in vitro e in vivo foram analisados usando o software estatístico GraphPad Prism 8.0 (GraphPad Software, San Diego, CA, EUA). As comparações entre os grupos foram realizadas usando análise de variância (ANOVA) unidirecional. Testes post‐hoc de Bonferroni foram empregados para verificar a significância das diferenças entre os grupos experimentais. Todos os dados foram apresentados como média e desvio padrão (±DP). Um valor de p <0,05 foi considerado indicativo de significância estatística, denotado por asteriscos (*p <0,05; **p <0,01; ***p <0,001; ****p <0,0001).
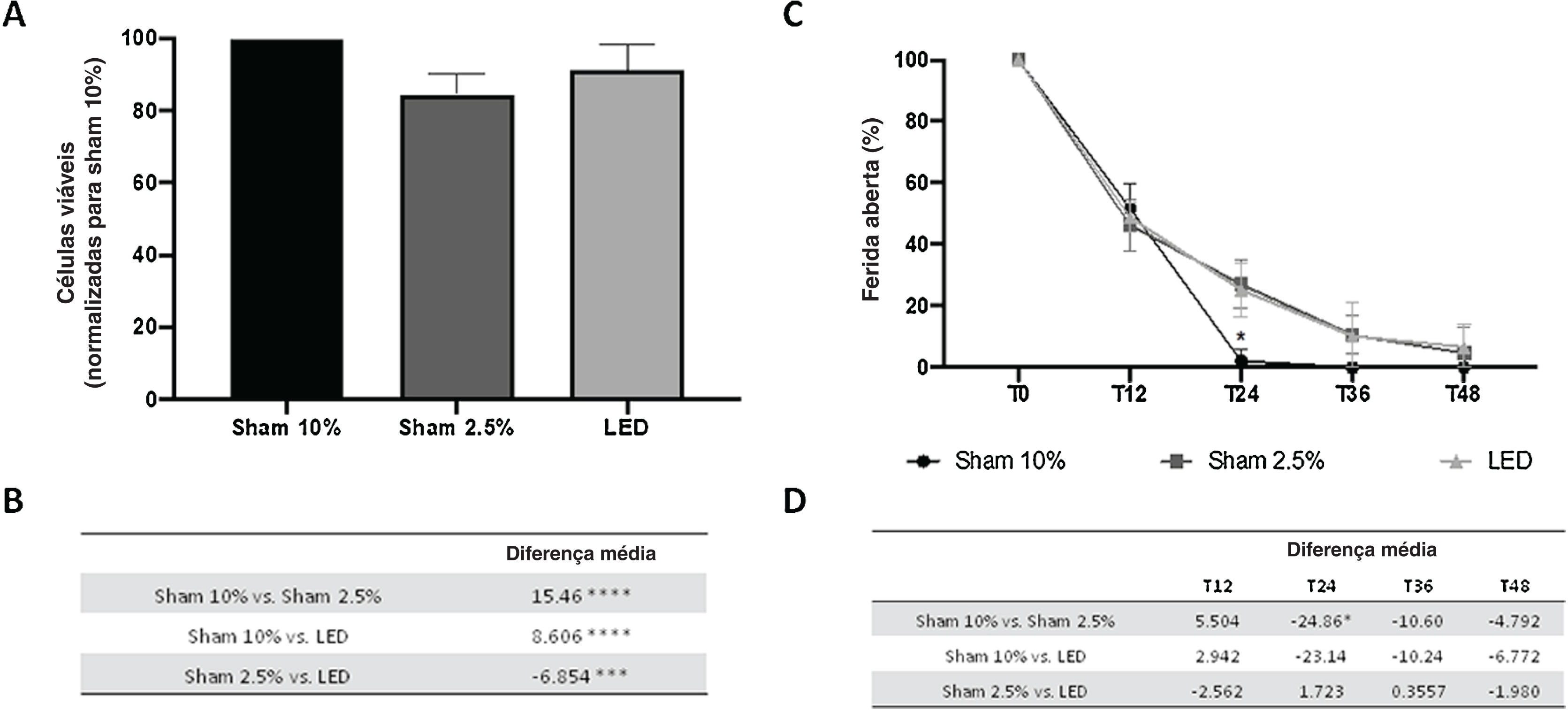
ResultadosTerapia com LED aumenta a viabilidade dos queratinócitos in vitroFoi comparada a viabilidade das células HaCat sob condições ideais (Sham 10%) e de estresse (Sham 2,5%) com irradiação com LED sob as mesmas condições de estresse, o que estimula o estresse do ambiente de cicatrização e permite o efeito da terapia de fotobiomodulação (PBMT, do inglês Photobiomodulation therapy). Observou‐se que após a irradiação com LED houve aumento da viabilidade celular em comparação com o grupo Sham 2,5% (p <0,001; fig. 1A e B). Entretanto, mesmo tendo impacto significante, a terapia com LED não foi capaz de restaurar a viabilidade celular ao seu valor basal em condições ideais (grupo Sham 10%, p <0,0001).
Efeitos do LED na viabilidade e migração de queratinócitos humanos in vitro. (A) Porcentagem de células viáveis com base na absorbância do ensaio SRB normalizada para o grupo Sham 10%. (B) Principal diferença na viabilidade celular entre os grupos experimentais. (C) Porcentagem de ferida aberta normalizada para análise basal (T0) em diferentes tempos experimentais. (D) Principal diferença na migração celular entre os grupos experimentais, descartando os tempos experimentais. Asteriscos denotam resultados significantes.
A migração celular foi avaliada por meio de ensaio de arranhão. As condições de estresse (2,5% de SFB) prejudicaram apenas a migração celular em T24 em comparação ao grupo Sham 10% (p <0,05; fig. 1C e D). Nesse mesmo momento, as células HaCaT tratadas com LED apresentaram área de ferida semelhante à dos dois grupos controle (Sham 10% e Sham 2,5%; fig. 1C e D). Esse resultado sugere efeito limitado da terapia com LED na migração de queratinócitos. Em todos os outros tempos de avaliação, todos os grupos apresentaram valores estatisticamente semelhantes.
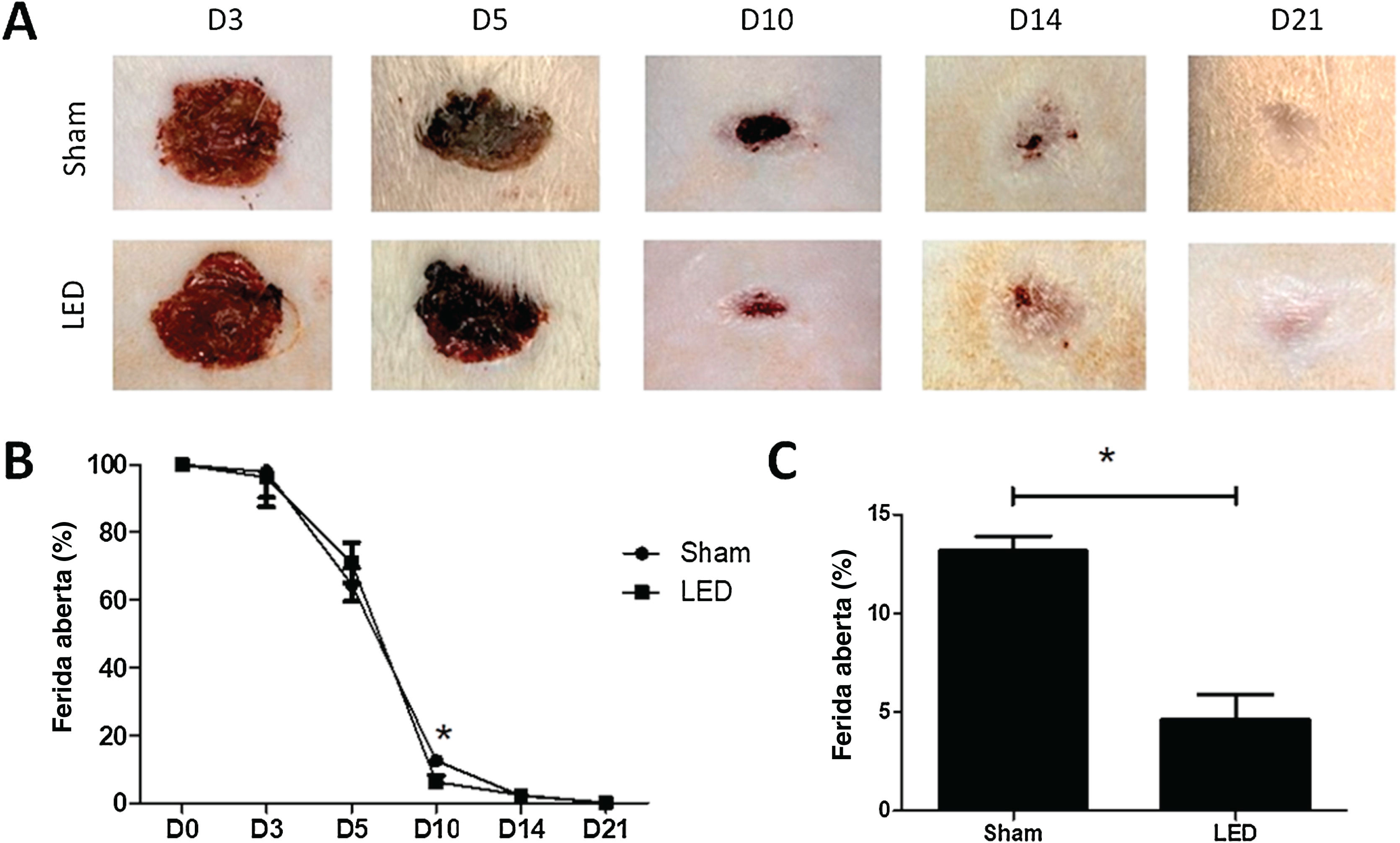
Terapia com LED acelera o fechamento da ferida observado clinicamente em um tempo intermediárioOs efeitos clínicos da terapia com LED na cicatrização cutânea foram avaliados nos dias 3, 5, 10, 14 e 21. Somente no dia 10, a área da ferida no grupo LED foi significantemente menor em comparação ao grupo Sham (p <0,05; fig. 2A e B). Neste dia, enquanto o grupo Sham teve média de 13,16% (± 1,50) de área de ferida aberta, os animais tratados com LED tiveram média de apenas 4,62% (± 2,53; fig. 2C). Nos outros tempos experimentais, ambos os grupos tiveram porcentagem semelhante de fechamento da ferida (fig. 2B).
Efeito da terapia com LED na cicatrização cutânea de ratos Wistar. (A) Imagens clínicas representativas do processo de cicatrização de feridas de espessura total induzidas nos grupos experimentais durante os diferentes períodos de análise. Observe que no dia 10 o grupo LED apresentou uma área de ferida significantemente menor em comparação ao grupo Sham. (B) Porcentagem de fechamento da ferida em diferentes tempos experimentais normalizada para a área basal da ferida (dia 0). (C) Porcentagem principal e DP de fechamento da ferida no dia 10 nos grupos Sham (13,16±1,50) e LED (4,62±2,53). Asteriscos denotam resultados significantes.
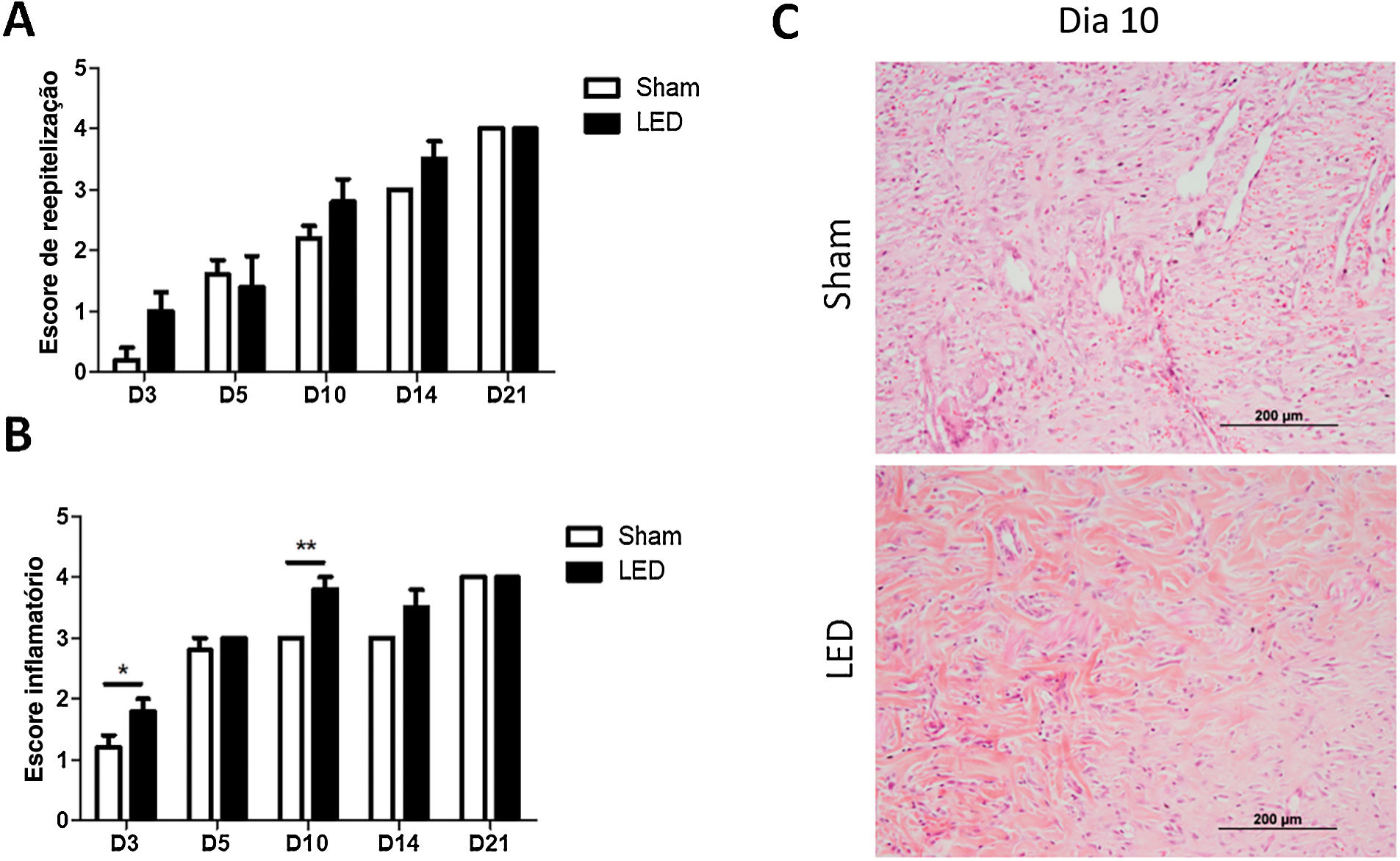
Foi avaliado, ainda, como a terapia com LED influencia a cicatrização do tecido cutâneo por meio da análise morfológica da reepitelização e inflamação. Não foram observadas diferenças significantes para os escores de reepitelização em nenhum dos períodos experimentais (fig. 3A). Entretanto, uma tendência de processo de reepitelização mais avançado (escore mais alto) foi observada no grupo LED nos dias 3, 10 e 14 (fig. 3A).
Avaliação histopatológica da cicatrização cutânea. (A) Principais escores (±DP) de reepitelização de acordo com os grupos experimentais durante os diferentes períodos de análise. (B) Principais escores (±DP) de inflamação de acordo com os grupos experimentais durante os diferentes períodos de análise. Asteriscos denotam resultados significantes. (C) Local de cicatrização da ferida nos grupos Sham e LED no dia 10. Observe a abundância de deposição de colágeno e aumento na angiogênese na ferida tratada com LED (Coloração pelo método da Hematoxilina & eosina, 100×).
A terapia com LED teve impacto na modulação do processo inflamatório. Os animais tratados com LED apresentaram escores inflamatórios significantemente maiores, o que representa um processo de cicatrização mais avançado, nos dias 3 e 10 (fig. 3B). A terapia com LED acelerou a cronificação e resolução do processo inflamatório, como pode ser evidenciado nas fotomicrografias no dia 10, nas quais as feridas do grupo Sham ainda apresentam células inflamatórias e a deposição de colágeno é menos evidente, enquanto as feridas irradiadas com LED apresentam maior deposição de colágeno, angiogênese evidente e infiltrado inflamatório menor (fig. 3C).
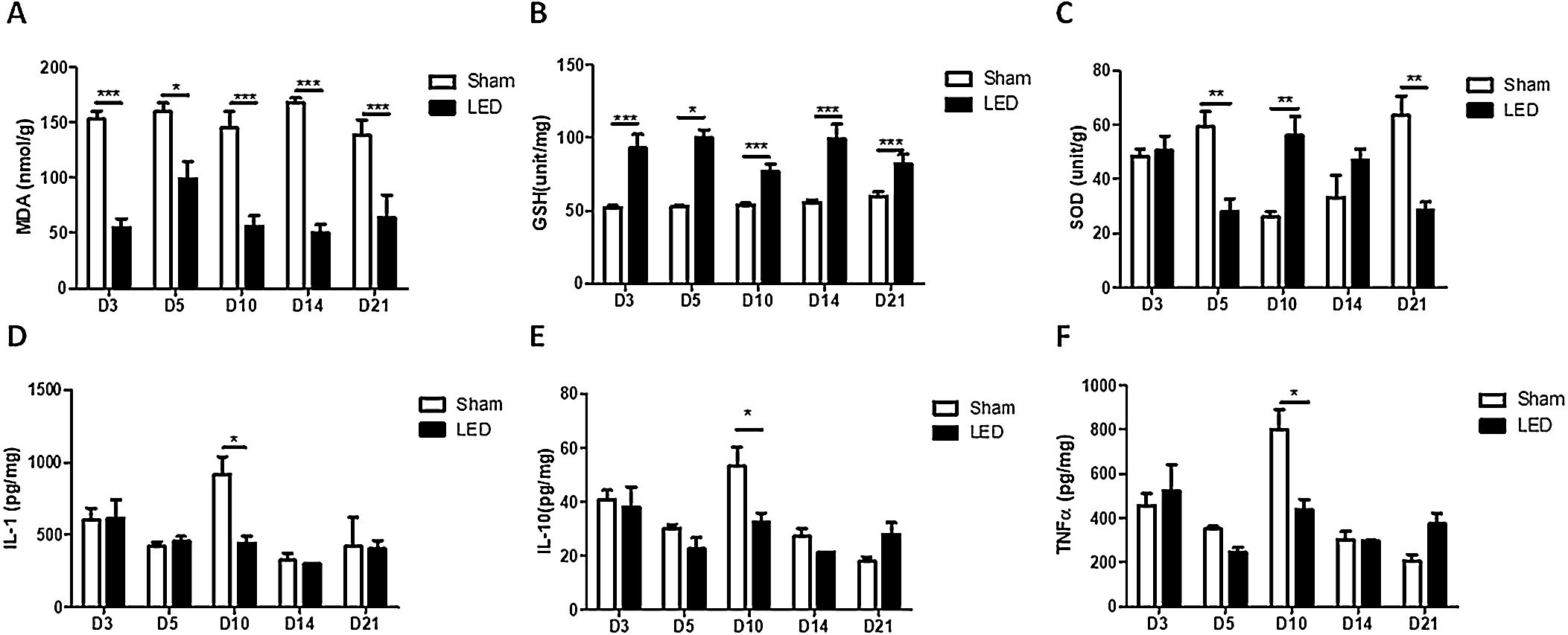
Terapia com LED desencadeia atividade antioxidante e modula a liberação de citocinas inflamatórias durante a cicatrização de feridas cutâneas in vivoO LED induziu um efeito antioxidante em todos os tempos experimentais, como evidenciado por níveis significantemente mais baixos de MDA (marcador oxidativo) e níveis mais altos de GSH (enzima antioxidante) no grupo LED em comparação com o grupo Sham (fig. 4A e B). Os efeitos da terapia com LED nos níveis de SOD (enzima antioxidante) não foram constantes: o LED induziu aumento dos níveis de SOD no dia 10 (corroborando os outros marcadores), mas teve efeito inibitório intrigante nos dias 5 e 21 (fig. 4C).
Os efeitos significantes da terapia com LED nas citocinas inflamatórias ocorreram apenas no dia 10. Nesse tempo experimental, o LED induziu uma diminuição dos níveis de todas as citocinas avaliadas: IL‐1β, IL‐10 e TNF‐α (fig. 4D, E e F). Nos demais tempos experimentais os efeitos foram variáveis, apresentando tendência de aumento ou diminuição dependendo da citocina/tempo avaliado, porém sem diferenças significantes entre os grupos experimentais.
DiscussãoO tratamento inadequado de feridas cutâneas pode ter consequências de longo alcance, incluindo tempos de cicatrização prolongados, risco elevado de recorrência ou infecção e complicações potenciais que podem necessitar de hospitalização.12 Várias abordagens terapêuticas foram exploradas com o objetivo de agilizar o fechamento de feridas. Neste estudo, os efeitos da terapia com LED na cicatrização da pele foram aprofundados. Os achados ressaltaram vários pontos fortes da terapia com LED, incluindo sua capacidade de modular o estado redox. Entretanto, certas limitações associadas a essa abordagem terapêutica também foram descobertas, como a ausência de impacto na migração de queratinócitos.
A pele atua como barreira protetora contra microrganismos, com queratinócitos protegendo o tecido conjuntivo.13 A restauração rápida da camada de queratinócitos perdida em úlceras cutâneas, conhecida como reepitelização, é crucial para evitar infecções. O presente estudo descobriu que o LED influenciou a proliferação de queratinócitos, mas não a migração celular. Isso contrasta com os achados de Sutterby et al. (2022), que demonstraram que a irradiação com LED vermelho (660nm) promoveu a proliferação e migração de células HaCat. Para o ensaio de arranhão, os autores realizaram uma única exposição de 10 minutos ao LED (0,8 mW, 0,3J/cm2). Diferenças significantes entre o LED e o grupo de controle foram observadas em 48 e 72 horas.9 A disparidade nos resultados pode ser atribuída, em parte, às diferenças nos parâmetros dosimétricos. Notavelmente, a dose utilizada naquele estudo foi significantemente menor do que a utilizada no presente estudo. Pesquisas anteriores mostraram que doses mais baixas de irradiação com laser vermelho (4J/cm2) podem ter efeitos mais pronunciados em comparação com doses mais altas (20J/cm2).4 Entretanto, vários fatores metodológicos, como tamanho da ferida, condições de cultura e atividade metabólica basal, também podem ter desempenhado um papel na variabilidade desses resultados. Para mitigar a influência potencial da proliferação celular durante o ensaio de arranhão, é aconselhável implementar condições de privação de soro (como foi feito no presente estudo) ou induzir a parada do ciclo celular usando agentes farmacológicos.14 Infelizmente, não está claro se Sutterby et al. empregaram algum desses métodos, deixando espaço para a possibilidade de que o fechamento da área de ferida observada em seu estudo pudesse, em parte, ser atribuído ao efeito da terapia com LED na proliferação celular. Outras condições que foram testadas na pesquisa de FBM incluem meios condicionados por IL‐4 ou TNF‐α e IFN‐γ para imitar ambiente inflamatório. Foi demonstrado que a FBM com laser vermelho aumenta a proliferação de células HaCaT em um ensaio de arranhão sob essas condições.15
A presente avaliação in vivo também não mostrou impacto significante da irradiação com LED nos escores de reepitelização, consistente com os resultados in vitro. Pode‐se concluir que o LED tem eficácia limitada em acelerar o fechamento da barreira epitelial segundo os parâmetros utilizados aqui. As vantagens clínicas da terapia com LED no espectro vermelho parecem estar associadas à sua capacidade de modular o processo inflamatório e outros mecanismos, como evidenciado no presente estudo. No dia 10, o exame histopatológico indicou claramente aumento acentuado na deposição de colágeno no grupo tratado com LED em comparação com o grupo controle. Essa observação está alinhada com as descobertas de Kim et al. (2015), que demonstraram que a irradiação com LED vermelho a 660nm aumentou a atividade metabólica dos fibroblastos.16 Os benefícios clínicos da terapia com LED em um modelo murino utilizado aqui estão alinhados com estudos anteriores em animais.17,18 O desfecho clínico primário do presente estudo foi o tamanho da ferida, e nenhuma avaliação quantitativa ou qualitativa do tecido cicatricial foi realizada, o que representa uma limitação. A formação de cicatrizes apresenta implicações estéticas e funcionais importantes para os pacientes, e estudos anteriores mostraram efeitos positivos da terapia com LED, particularmente em altas doses de energia, na graduação das cicatrizes observadas.19 Mais estudos são necessários para confirmar o efeito positivo da terapia na LED na formação de cicatrizes.
De acordo com o conhecimento dos autores do presente estudo, ele marca a primeira exploração experimental do impacto da terapia com LED no REDOX e na liberação de citocinas ao nível tecidual durante a cicatrização da pele.3 No dia 10, a terapia com LED reduziu significantemente os níveis de IL‐1β, IL‐10 e TNF‐α. Essa observação sugere que o LED tem a capacidade de atenuar a fase aguda pró‐inflamatória e facilitar a progressão da fase proliferativa. Notavelmente, observou‐se a capacidade de modular o estresse oxidativo ao longo dos períodos experimentais, promovendo ambiente antioxidante por meio da diminuição de MDA e liberação de GSH. As observações do presente estudo se alinham com estudos in vitro que investigaram o impacto da irradiação com LED vermelho no estresse oxidativo. Por exemplo, a irradiação com LED a 625nm por 60 minutos diminuiu significantemente as espécies reativas de oxigênio (EROs) intracelulares em células HaCat, conforme medido pela fluorescência de 2’‐7’‐diclorofluoresceína diacetato (DCF‐DA).20 Reduções semelhantes em EROs após exposição ao LED vermelho (630–670nm) foram observadas em fibroblastos da polpa21 e células gliais de Müller.22 Úlceras em pacientes diabéticos estão principalmente associadas ao estresse oxidativo e à liberação de citocinas pró‐inflamatórias.23 Os achados inovadores do presente estudo colocam a irradiação com LED como abordagem terapêutica promissora para feridas diabéticas. Investigações futuras com foco no uso de irradiação com LED em modelos animais diabéticos têm valor translacional claro e são necessárias.
À medida que as pesquisas explorando os benefícios da terapia a laser vermelho e infravermelho para a cicatrização de feridas, incluindo úlceras diabéticas,24 continuam a se expandir, o potencial da terapia com LED permanece subestimado. O presente estudo revelou respostas biológicas significantes que indicam fortemente a adoção da terapia com LED. Além disso, vale ressaltar que os aparelhos de LED oferecem vantagens adicionais, como custo‐efetividade. Por exemplo, o custo por miliwatt (mW) dos aparelhos de LED é, em média, 100 vezes menor em comparação aos lasers.11 Essa acessibilidade financeira facilita a aquisição desses dispositivos por clínicas e hospitais ou mesmo pacientes, aumentando a acessibilidade, especialmente em países de baixa renda. A conveniência da aplicação é outro fator‐chave. Os aparelhos de LED podem emitir luz sobre uma área de superfície mais ampla em virtude de sua largura de banda espectral mais ampla.9 Esse recurso é particularmente vantajoso para o tratamento de feridas na pele, que muitas vezes podem ser substanciais, especialmente no contexto de úlceras no pé diabético. Na verdade, resultados clínicos positivos em úlceras no pé diabético com aparelhos de LED vermelho que podem ser usados com segurança em ambiente domiciliar e manuseados pelo paciente foram publicados, confirmando a presente hipótese.25
Em conclusão, a terapia com LED sob as condições específicas testadas aqui acelerou significantemente o processo de cicatrização cutânea in vivo quando comparada à irradiação simulada. Os benefícios clínicos parecem ser atribuídos à capacidade do LED de modular a liberação de citocinas inflamatórias, levando a uma redução notável nos sinais pró‐inflamatórios no dia 10. Simultaneamente, ele promoveu ambiente antioxidante ao longo de toda a trajetória de cicatrização. Por outro lado, os achados da presente pesquisa indicam que o protocolo de LED testado teve impacto limitado na migração de queratinócitos, conclusão apoiada por análises de dados in vitro e in vivo.
Suporte financeiroEste estudo foi financiado pelo Grupo de Pesquisa do Hospital de Clínicas de Porto Alegre (DIPE/HCPA: 2018‐0624) e por Azena Medical, que forneceu o equipamento de laser e financiamento para pesquisa. Os financiadores não tiveram nenhum papel no planejamento do estudo, obtenção e análise dos dados, decisão de publicação ou preparação do artigo.
Contribuição dos autoresTuany Rafaeli Schmidt: Obtenção, análise e interpretação dos dados; redação do manuscrito original.
Belkiss Câmara Mármora: Concepção e planejamento do estudo; obtenção, análise e interpretação dos dados; redação, revisão e edição do manuscrito.
Fernanda Thomé Brochado: Obtenção e análise dos dados; redação, revisão e edição do manuscrito.
Lucas Gonçalves: Obtenção e análise dos dados; redação, revisão e edição do manuscrito.
Paloma Santos Campos: Obtenção e análise dos dados; redação, revisão e edição do manuscrito.
Marcelo Lazzaron Lamers: Análise e interpretação dos dados; redação, revisão e edição do manuscrito.
Aurigena Antunes de Araújo; Análise e interpretação dos dados; redação, revisão e edição do manuscrito.
Caroline Addison Carvalho Xavier de Medeiros: Análise e interpretação dos dados; redação, revisão e edição do manuscrito.
Susana Barbosa Ribeiro: Análise e interpretação dos dados; redação, revisão e edição do manuscrito.
Marco Antonio Trevizani Martins: Análise e interpretação dos dados; redação, revisão e edição do manuscrito.
Emily Ferreira Salles Pilar: Análise e interpretação dos dados; redação, revisão e edição do manuscrito.
Manoela Domingues Martins: Concepção e planejamento do estudo; análise e interpretação dos dados; aquisição de financiamento; supervisão; redação, revisão e edição do manuscrito.
Vivian Petersen Wagner: Concepção e planejamento do estudo; análise e interpretação dos dados; análise estatística; redação do manuscrito original.
Conflito de interessesNenhum.
Este estudo foi financiado pelo Grupo de Pesquisa Hospital de Clínicas de Porto Alegre (DIPE/HCPA: 2018‐0624) e Fundação Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES, código 001). Azena Medical forneceu o equipamento de laser e os consumíveis. Os financiadores não desempenharam nenhum papel no planejamento do estudo, na obtenção e análise dos dados, na preparação do manuscrito ou na decisão de publicação. Aurigena Antunes de Araújo e Manoela Domingues Martins são bolsistas de pesquisa financiadas pelo Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq).
Como citar este artigo: Schmidt TR, Mármora BC, Brochado FT, Gonçalves L, Campos PS, Lamers ML, et al. Red light‐emitting diode on skin healing: an in vitro and in vivo experimental study. An Bras Dermatol. 2025;100:54–62.
Trabalho realizado no Departamento de Patologia, Faculdade de Odontologia, Universidade Federal do Rio Grande do Sul, Porto Alegre, RS, Brasil e Unidade de Animais Experimentais, Hospital das Clínicas de Porto Alegre, Universidade Federal do Rio Grande do Sul, Porto Alegre, RS, Brasil.