Urticária crônica espontânea (UCE) é condição clínica que afeta a qualidade de vida do paciente. O omalizumabe é preferido em casos de UCE resistentes a anti‐histamínicos. O Urticaria Activity Score‐7 (UAS‐7) é uma escala que mostra a gravidade da doença.
ObjetivosO objetivo foi comparar a eficácia em longo prazo (60 meses) e os efeitos colaterais de doses de omalizumabe nas doses de 150mg e 300mg em pacientes com UCE.
MétodosForam incluídos neste estudo 108 pacientes acompanhados na clínica com o diagnóstico de UCE. O tratamento com omalizumabe foi iniciado em pacientes resistentes ao tratamento convencional para UCE. Foram formados dois grupos para usar omalizumabe nas doses de 150 e 300mg. Foram comparados o UAS‐7, o uso de anti‐histamínicos, o tempo até o estágio livre de crises, as recaídas após o tratamento e os efeitos colaterais do tratamento com omalizumabe nos dois grupos.
ResultadosNão houve diferenças estatisticamente significantes entre os grupos em relação às características basais e aos achados laboratoriais. O tempo médio de seguimento foi de 60 meses. Os escores UAS‐7 foram semelhantes no seguimento. Não houve eventos adversos em nenhum dos dois grupos.
Limitações do estudoEstudo retrospectivo e de centro único para atingir um número mais significante de pacientes. Ausência de pacientes recebendo a dose mais baixa 75mg e a dose mais alta 600mg de omalizumabe. Ausência de índices de massa corporal total de todos os pacientes. Além disso, o uso de medicamentos distintos pode contribuir para resultados não confiáveis.
ConclusãoComo não há diferença significante entre as doses de 150 e 300mg de omalizumabe em relação à eficácia do tratamento em longo prazo e os efeitos colaterais em pacientes com UCE, pode ser adequado iniciar com 150mg como dose de tratamento. Em pacientes que não respondem a 150mg, a dose de omalizumabe pode ser aumentada para 300mg. Isso evitará complicações imprevisíveis dependentes da dose e do tempo e será abordagem custo‐efetiva mesmo em economias fortes.
A urticária é caracterizada por prurido, eritema, desenvolvimento de angioedema ou ambos. As apresentações clínicas que duram menos de seis semanas são chamadas de urticária aguda, enquanto as apresentações clínicas que duram seis semanas ou mais são chamadas de urticária crônica.1 Mais de 1% dos pacientes podem apresentar sintomas por período de cinco a dez anos.2,3 Aproximadamente 60% e 30% dos pacientes com doença moderada a grave ainda apresentam sintomas após dois e cinco anos, respectivamente.4
Uma forma de urticária crônica é a urticária idiopática, também conhecida como urticária crônica espontânea (UCE). A UCE não tem gatilho externo conhecido, embora base autoimune tenha sido amplamente investigada. Aproximadamente dois terços dos pacientes com urticária crônica são diagnosticados com UCE.5
O tratamento anti‐histamínico é administrado na urticária e pode ter a dose aumentada em até quatro vezes, dependendo do controle das queixas do paciente. Omalizumabe, um anticorpo anti‐IgE, é iniciado em pacientes que não respondem ao tratamento com anti‐histamínico em altas doses. Esse é o único tratamento com agente biológico licenciado para urticária em pacientes que não apresentam benefício suficiente no tratamento com anti‐histamínico de 2ª geração. Omalizumabe é muito eficaz e seguro no tratamento de UCE, promovendo a cura e prevenindo o desenvolvimento de angioedema, o que melhora significantemente a qualidade de vida.1,6 Omalizumabe é opção de tratamento eficaz para pacientes com sintomas moderados a graves da UCE e angioedema que não respondem à terapia anti‐histamínica em altas doses.7
Omalizumabe é um anticorpo monoclonal humanizado recombinante que reduz a IgE livre e funciona ligando‐se ao receptor de alta afinidade para a região Fc da IgE (FcɛRI).8
O escore da escala Urticaria Activity Score (UAS‐7) é avaliado pelo paciente todos os dias durante sete dias. Ele é proporcional à gravidade da doença e é usado para determinar a gravidade da erupção cutânea e do prurido.9,10
O presente estudo foi planejado para comparar os escores da escala UAS‐7 antes e depois do tratamento com omalizumabe, a necessidade de anti‐histamínicos, identificar quantos pacientes apresentaram recaída após o 60° mês e recorrência e reações adversas graves potencialmente fatais em pacientes com UCE de acordo com o uso de doses de 150mg ou 300mg de omalizumabe.
Materiais e métodosPacientes com UCE que não responderam à terapia anti‐histamínica em altas doses por pelo menos seis meses e posteriormente receberam tratamento com omalizumabe foram incluídos no estudo. Nenhum dos pacientes incluídos no estudo apresentou resposta clínica adequada, apesar de doses quádruplas de anti‐H1 antes de iniciar o tratamento com omalizumabe. Esses pacientes foram divididos em dois grupos: um recebendo 150mg e outro 300mg de omalizumabe, respectivamente. Os pacientes receberam o omalizumabe a cada quatro semanas.11
Pacientes com condições inflamatórias crônicas, aqueles recebendo tratamento anti‐inflamatório, indivíduos em terapia imunossupressora para outras condições médicas, pacientes com câncer recebendo tratamentos alternativos, pacientes com doenças psiquiátricas causando desafios de seguimento e tratamento, indivíduos submetidos a tratamento imunossupressor por qualquer motivo e aqueles com histórico de reações de hipersensibilidade ao omalizumabe foram excluídos do estudo.
O estudo incluiu uma comparação do escore na escala UAS‐7 antes e depois do tratamento com omalizumabe entre os dois grupos, bem como uma avaliação do uso de anti‐histamínicos durante o tratamento, a ocorrência de recaídas e a investigação e comparação de efeitos colaterais graves potencialmente fatais associados à terapia com omalizumabe entre os grupos.
A escala UAS‐7 é um sistema de pontuação utilizado pelos pacientes para avaliar a gravidade de sua condição registrando a intensidade do edema e do prurido ao londo de sete dias. Na escala UAS, o paciente avalia a gravidade do edema e do prurido uma vez ao dia durante uma semana. Os valores da UAS‐7 variam de 0 a 42, com escores mais altos indicando maior atividade da doença. Na escala UAS, o paciente avalia a gravidade do edema e do prurido uma vez ao dia (a cada 24 horas). Um escore na UAS‐7 de seis ou menos indica controle razoável, 7 a 15 sugere urticária com pequena atividade; 16 a 27 indica urticária com atividade moderada e 28 a 42 sugere urticária com atividade acentuada.9,12
O uso de anti‐histamínicos em altas doses indica aumento da dosagem de anti‐histamínicos de 2ª geração em até quatro vezes a dose padrão.1 O uso regular de anti‐histamínicos significa tomar anti‐histamínicos todos os dias. O tratamento com anti‐histamínicos conforme a necessidade, por outro lado, envolve seu uso apenas quando os sintomas estão presentes.
O protocolo de pesquisa do presente estudo foi aprovado pelo Comitê de Ética em Pesquisa Clínica do Gulhane Education and Research Hospital (E‐50687469‐799‐2023/12). Como o presente estudo é retrospectivo, o consentimento informado não foi obtido. Os dados dos pacientes foram acessados por meio do sistema de automação do hospital e dos registros dos pacientes.
Análise estatísticaVariáveis contínuas são apresentadas como média ± desvio padrão, enquanto variáveis categóricas são fornecidas como porcentagens. O teste de Kolmogorov‐Smirnov foi usado para verificar a normalidade da distribuição de variáveis contínuas. A análise estatística de dados clínicos dos dois grupos consistiu em testes t não pareados para dados paramétricos e análise do teste U de Mann‐Whitney para dados não paramétricos. Variáveis contínuas e categóricas foram analisadas pelos testes estatísticos de qui‐quadrado, teste t de Student ou teste de Kruskal‐Wallis quando apropriado. O coeficiente de Pearson foi usado como coeficiente de associação. As análises foram realizadas com o software PASW 22 (SPSS/IBM, Chicago, IL, EUA), e um valor de p bicaudal < 0,05 foi considerado estatisticamente significante.
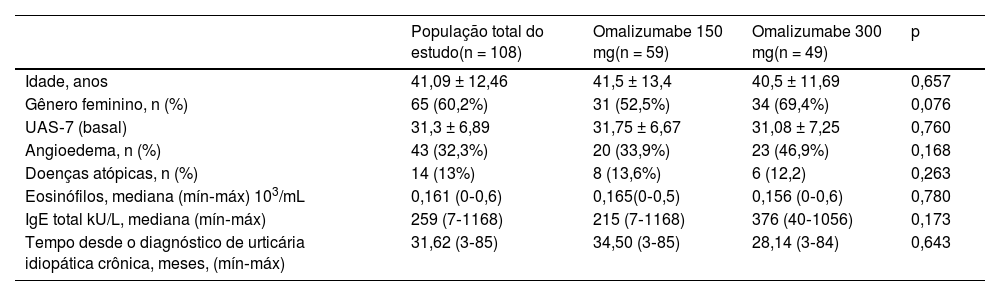
ResultadosA média de idade dos pacientes incluídos no estudo foi de 41,09 ± 12,4, e 60,2% eram do gênero feminino. Não houve diferenças estatisticamente significantes entre os grupos de doses de 150mg e 300mg de omalizumabe em relação a comorbidades, doenças atópicas (asma, rinite alérgica, sensibilidades alimentares), doença autoimune, médias de escore nas UAS‐7 basais e valores laboratoriais (p>0,05). Em ambos grupos, todos os pacientes estavam usando anti‐histamínicos em altas doses por pelo menos seis meses (tabela 1). Omalizumabe 600mg não havia sido administrado a nenhum dos pacientes.
Características basais dos grupos de doses de 150 e 300mg de omalizumabe
| População total do estudo(n = 108) | Omalizumabe 150 mg(n = 59) | Omalizumabe 300 mg(n = 49) | p | |
|---|---|---|---|---|
| Idade, anos | 41,09 ± 12,46 | 41,5 ± 13,4 | 40,5 ± 11,69 | 0,657 |
| Gênero feminino, n (%) | 65 (60,2%) | 31 (52,5%) | 34 (69,4%) | 0,076 |
| UAS‐7 (basal) | 31,3 ± 6,89 | 31,75 ± 6,67 | 31,08 ± 7,25 | 0,760 |
| Angioedema, n (%) | 43 (32,3%) | 20 (33,9%) | 23 (46,9%) | 0,168 |
| Doenças atópicas, n (%) | 14 (13%) | 8 (13,6%) | 6 (12,2) | 0,263 |
| Eosinófilos, mediana (mín‐máx) 103/mL | 0,161 (0‐0,6) | 0,165(0‐0,5) | 0,156 (0‐0,6) | 0,780 |
| IgE total kU/L, mediana (mín‐máx) | 259 (7‐1168) | 215 (7‐1168) | 376 (40‐1056) | 0,173 |
| Tempo desde o diagnóstico de urticária idiopática crônica, meses, (mín‐máx) | 31,62 (3‐85) | 34,50 (3‐85) | 28,14 (3‐84) | 0,643 |
UAS, Urticaria Activity Score; IgE, imunoglobulina E.
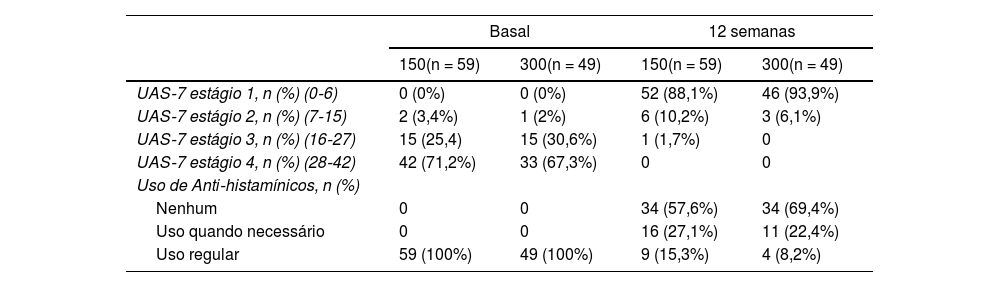
Os escores médios da UAS‐7 dos pacientes que receberam 150mg e 300mg de omalizumabe diminuíram significantemente comparando o escore basal da UAS‐7 com o escore da UAS‐7 na 12ª semana (p < 0,001). Na 12ª semana, não houve diferença estatisticamente significante nos valores da UAS‐7 comparando os pacientes que receberam 150mg e 300mg de omalizumabe (p = 0,299). Ao examinar os escores da UAS‐7, observou‐se que dos 59 pacientes que receberam 150mg de omalizumabe, 52 (88,1%) atingiram controle razoável e sete (11,9%) tiveram pequena atividade da urticária. Um paciente apresentou atividade moderada da urticária. Foi observado que esses sete pacientes continuavam a usar anti‐histamínicos regularmente. Ao avaliar os escores da UAS‐7, foi observado que dos 49 pacientes que receberam 300mg de omalizumabe, 46 (93,9%) atingiram controle razoável, enquanto três (6,1%) ainda apresentavam pequena atividade da urticária. Também foi observado que esses três pacientes continuaram a usar anti‐histamínicos regularmente (tabela 2).
Comparação entre os grupos de doses de 150 e 300mg de omalizumabe em termos de eficácia
| Basal | 12 semanas | |||
|---|---|---|---|---|
| 150(n = 59) | 300(n = 49) | 150(n = 59) | 300(n = 49) | |
| UAS‐7 estágio 1, n (%) (0‐6) | 0 (0%) | 0 (0%) | 52 (88,1%) | 46 (93,9%) |
| UAS‐7 estágio 2, n (%) (7‐15) | 2 (3,4%) | 1 (2%) | 6 (10,2%) | 3 (6,1%) |
| UAS‐7 estágio 3, n (%) (16‐27) | 15 (25,4) | 15 (30,6%) | 1 (1,7%) | 0 |
| UAS‐7 estágio 4, n (%) (28‐42) | 42 (71,2%) | 33 (67,3%) | 0 | 0 |
| Uso de Anti‐histamínicos, n (%) | ||||
| Nenhum | 0 | 0 | 34 (57,6%) | 34 (69,4%) |
| Uso quando necessário | 0 | 0 | 16 (27,1%) | 11 (22,4%) |
| Uso regular | 59 (100%) | 49 (100%) | 9 (15,3%) | 4 (8,2%) |
UAS, Urticaria Activity Score.
Dos pacientes que receberam inicialmente omalizumabe 150mg, sete (11,9%) continuaram a utilizar anti‐histamínicos regularmente junto com omalizumabe 150mg, mas melhora clínica ideal não foi alcançada, então eles passaram a utilizar omalizumabe 300mg. Na avaliação na 24ª semana, observou‐se que os escores na UAS‐7 indicavam que cinco desses pacientes haviam atingido controle razoável. Os dois pacientes restantes continuaram a apresentar pequeno nível de controle e a usar anti‐histamínicos regularmente.
Entre os pacientes que inicialmente receberam omalizumabe 300mg, três apresentaram pequena atividade de urticária na 12ª semana de acordo com o escore da escala UAS‐7, e esses pacientes continuaram a usar anti‐histamínicos regularmente junto com omalizumabe 300mg. Na avaliação na 24ª semana, foi observado que todos os três pacientes permaneceram com pequeno nível de controle e continuaram a usar anti‐histamínicos regularmente.
Para o restante dos pacientes que receberam omalizumabe 150mg e omalizumabe 300mg, controle razoável continuou na 24ª semana.
As características clínicas de sete pacientes que não atingiram controle razoável após receber omalizumabe 150mg na 12ª semana e de três pacientes que não atingiram controle razoável após receber omalizumabe 300mg na 12ª semana são mostradas na tabela 3.
Características clínicas de pacientes que não alcançaram controle razoável após receber omalizumabe
| P1 | P2 | P3 | P4 | P5 | P6 | P7 | P8 | P9 | P10 | |
|---|---|---|---|---|---|---|---|---|---|---|
| Idade, anos | 39 | 43 | 53 | 62 | 51 | 50 | 41 | 33 | 48 | 44 |
| Gênero, M‐F | F | F | F | M | F | F | F | M | M | F |
| Doença atópica | ‐ | ‐ | ‐ | ‐ | + | ‐ | + | ‐ | ‐ | ‐ |
| Angioedema | ‐ | ‐ | + | ‐ | ‐ | + | ‐ | ‐ | + | ‐ |
| Tempo desde o diagnóstico de urticária idiopática crônica, meses, mediana | 82 | 23 | 13 | 20 | 46 | 24 | 10 | 5 | 24 | 10 |
| IgE total kU/L | 0 | 233 | 1 | 264 | 191 | 96 | 1 | 5 | 1168 | 222 |
| Eosinófilos, 103/mL | 100 | 200 | 0 | 0 | 100 | 0 | 200 | 400 | 300 | 100 |
| Dose de omalizumabe, mg | 150 | 150 | 150 | 150 | 150 | 150 | 150 | 300 | 300 | 300 |
| Uso de anti‐histamínicos após o início do omalizumabe | Sim | Sim | Sim | Sim | Sim | Sim | Sim | Sim | Sim | Sim |
| Recorrência após 60 meses | Sim | Sim | Não | Não | Não | Não | Não | Não | Não | Não |
P, paciente; M, masculino; F, feminino; UAS, Urticaria Activity Score; IgE, imunoglobulina E.
Foi observado que 36,5% dos pacientes que receberam 150mg de omalizumabe e 19,6% dos pacientes que receberam 300mg de omalizumabe apresentaram recorrência da urticária 60 meses ou mais após o tratamento (p = 0,056; tabela 4). Não houve diferenças estatisticamente significantes entre os dois grupos em relação a pequenas reações adversas, como dor no local da injeção, edema, prurido e eritema. Além disso, nenhum evento adverso sério potencialmente fatal foi observado nos dois grupos.
DiscussãoNo presente estudo, foi demonstrado que não houve diferença significativa na avaliação pós‐tratamento entre grupos de pacientes usando doses de 150mg ou 300mg de omalizumabe em pacientes com UCE em termos de escores na escala UAS‐7, necessidade de anti‐histamínicos, recorrências em 60 meses ou mais e eventos adversos graves.
A UCE é doença crônica da pele que afeta a qualidade de vida e as relações sociais dos pacientes. Em seu tratamento, anti‐histamínicos de 2ª geração são usados como terapia de primeira linha. Entretanto, em casos em que anti‐histamínicos em altas doses são ineficazes, o omalizumabe, um anticorpo monoclonal humanizado recombinante, é empregado.13 Os pacientes devem receber 150‐300mg de omalizumabe a cada quatro semanas como dose de tratamento.
As novas diretrizes da European Academy of Allergy & Clinical Immunology, recomendam o omalizumabe 300mg. No entanto, o presente estudo é retrospectivo, então os pacientes iniciaram o tratamento com 150mg ou 300mg de omalizumabe pelas diretrizes anteriores.11
Em estudos comparando o tratamento com placebo e omalizumabe em pacientes com UCE que não respondem a anti‐histamínicos em altas doses, foi observado que os pacientes que receberam omalizumabe apresentaram melhores resultados em termos do índice Chronic Urticaria Quality of Life Index e do tempo até a recorrência da doença. Os eventos adversos identificados em pacientes que usaram omalizumabe foram consistentes com um perfil de segurança favorável.14‐16
Em outra metanálise conduzida por Zhao et al. em 2016, sete estudos foram comparados, envolvendo 1.312 pacientes com urticária crônica, para avaliar a eficácia do omalizumabe em comparação ao placebo em um ambiente controlado. Em todos os estudos, foi observado que o tratamento com omalizumabe reduziu e controlou significantemente os sintomas da UCE em comparação ao placebo. Os pacientes tratados com omalizumabe tiveram seus sintomas melhor controlados do que aqueles que receberam placebo. Além disso, observou‐se que o omalizumabe 300mg foi mais bem tolerado do que o omalizumabe 600mg. Em outro estudo observou‐se que houve melhora no escore da atividade da urticária em pacientes com urticária crônica que receberam omalizumabe 150mg e omalizumabe 300mg em comparação com placebo.5 Da mesma maneira, no presente estudo, observou‐se que o tratamento com omalizumabe resultou em controle eficaz para a maioria dos pacientes que não responderam à terapia anti‐histamínica em altas doses por pelo menos seis meses e cujos sintomas não foram controlados.
Em outra metanálise conduzida por JIA HX et al. em 2020, 1.612 pacientes foram comparados com 1.251 indivíduos no grupo placebo. O estudo descobriu que o omalizumabe foi mais eficaz no controle dos sintomas do que o placebo. Observou‐se também que os pacientes que receberam omalizumabe 600mg tiveram maior incidência de eventos adversos,17 e as publicações mostram que a frequência de eventos adversos aumenta com a dose.18 Durante o tratamento com omalizumabe, efeitos colaterais como reações de hipersensibilidade, reações relacionadas à injeção, sintomas agudos de asma, doenças eosinofílicas, febre, dor nas articulações, erupção cutânea e outros podem ser observados.19,20
No presente estudo, não houve diferença significante em relação a reações como dor, edema, prurido e eritema no local da injeção entre os dois grupos, e nenhum evento adverso sério foi observado nos dois grupos de 150 e 300mg. À luz dos estudos citados, a possibilidade de eventos adversos pode aumentar à medida que a dose aumenta. Nesse contexto, os autores acreditam que a estratégia inicial de baixa dose, que é rotineira na prática clínica para a maioria das doenças, deve ser preferida.
Maurer et al. estudaram 323 pacientes sintomáticos com urticária crônica idiopática, que foram monitorados e receberam três injeções subcutâneas de omalizumabe ou placebo em doses de 75mg, 150mg ou 300mg, com quatro semanas de intervalo, seguido por um período de observação de 12 semanas. Notou‐se que o omalizumabe administrado em três doses de 75mg, 150mg ou 300mg em intervalos de quatro semanas reduziu significantemente os sintomas em comparação ao placebo. Em pacientes que receberam 150mg ou 300mg de omalizumabe, foi observada melhora significante no escore da atividade da urticária no final da 12ª semana em comparação com as características basais.8
De maneira similar, no presente estudo, nenhuma diferença significante foi observada na eficácia entre doses de 150 e 300mg na avaliação ao final da 12ª semana. Entretanto, o omalizumabe foi trocado para dose de 300mg em sete pacientes cujas queixas não melhoraram, apesar da dose de 150mg. Isso sugere que apenas pacientes que não respondem a 150mg devem ser trocados para a dose superior de 300mg.
Em estudo conduzido por Saini et al., pacientes que receberam doses de 300mg e 600mg de omalizumabe foram avaliados na 12ª semana, e melhora significante foi observada entre os dois grupos.21 No estudo ASTERIA I, pacientes que tomaram 300mg e 150mg foram comparados, e concluiu‐se que a dose de 300mg proporcionou controle dos sintomas mais rapidamente do que a dose de 150mg.18
Embora tenha sido observado no presente estudo que o alívio dos sintomas ocorreu mais precocemente com a dose de 300mg, resultados semelhantes em termos de recorrência foram detectados tanto com as doses de 150 como de 300mg com seguimento em longo prazo. Certamente, espera‐se que a medicação controle os sintomas em um curto espaço de tempo. Entretanto, os resultados de longo prazo também são critério determinante na continuidade do tratamento. O presente estudo teve período de seguimento para recorrência de 60 meses, que é mais longo do que o observado em todos os outros três estudos.
Kim et al. iniciaram o tratamento com omalizumabe 150mg em 179 pacientes com urticária crônica espontânea e, no final da 12ª semana, o controle completo foi alcançado em 158 pacientes.22 De maneira similar, no presente estudo, alguns pacientes iniciaram com 150mg de omalizumabe, enquanto outros iniciaram com 300mg de omalizumabe. Nenhuma diferença significante foi observada entre os dois grupos.
Atualmente, os custos do tratamento são um problema muito importante em todo o mundo. Obter tratamento com boa relação custo‐benefício para os pacientes não é apenas um problema financeiro, mas também de saúde em relação aos resultados.23–27 Nesse contexto, doses de 150mg e 300mg foram comparadas no presente estudo, e nenhuma diferença significante foi encontrada em relação à eficácia do tratamento. Com base nisso, a dose de 150mg, que é mais econômica do que a de 300mg, pode ser utilizada em pacientes com UCE. No país dos autores, o frasco de omalizumabe 150mg está disponível. Quando se prefere a dose inicial de omalizumabe de 300mg, os custos aumentam duas vezes. Por esse motivo, pode ser melhor começar com 150mg e depois mudar para 300mg, dependendo da avaliação ao final da 12ª semana.
ConclusãoComo não há diferença significante entre as doses de 150 e 300mg de omalizumabe em relação à eficácia do tratamento em longo prazo e aos efeitos colaterais em pacientes com UCE, pode ser apropriado começar com 150mg como dose de tratamento. O tratamento com dose baixa será mais econômico. Pode ser razoável começar com omalizumabe 150mg primeiro e mudar para omalizumabe 300mg se nenhuma melhora clínica for alcançada em avaliações subsequentes. Certamente, se a melhora clínica não for alcançada com omalizumabe 150mg em pacientes selecionados, a dose pode ser aumentada.
Limitações do estudoAs principais limitações do presente estudo incluem seu desenho retrospectivo e o fato de ter sido realizado em centro único para atingir um número mais significante de pacientes. Além disso, a ausência de pacientes recebendo a dose mais baixa (75mg) e a mais alta (600mg) de omalizumabe, pode ser considerada uma deficiência do estudo. A falta dos índices de massa corporal total de todos os pacientes divididos em diferentes grupos de dose de omalizumabe é outra limitação. Adicionalmente, o uso de medicamentos distintos pode contribuir para resultados não confiáveis, representando mais uma limitação do presente estudo. Por fim, o número de pacientes do presente estudo é pequeno, e outros estudos podem ser conduzidos com mais pacientes. Certamente, estudos prospectivos mais abrangentes são necessários.
Suporte financeiroNenhum.
Contribuição dos autoresFikriye Kalkan: Concepção e planejamento do estudo; obtenção de dados ou análise e interpretação dos dados; elaboração e redação do manuscrito ou revisão crítica de conteúdo intelectual importante; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura e aprovação da versão final do manuscrito.
Sait Yeşillik: Concepção e planejamento do estudo; obtenção dos dados ou análise e interpretação dos dados; participação efetiva na orientação da pesquisa e aprovação da versão final do manuscrito.
Fevzi Demirel: Obtenção dos dados ou análise e interpretação dos dados; análise estatística; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados.
Ezgi Sönmez: Obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados.
Yasemin Balaban: Obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados.
Mustafa İlker İnan: Obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados.
Özgür Kartal: Obtenção de dados, ou análise e interpretação dos dados; análise estatística; elaboração e redação do manuscrito ou revisão crítica de conteúdo intelectual importante; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura e aprovação da versão final do manuscrito.
Como citar este artigo: Kalkan F, Yeşillik S, Demirel F, Sönmez E, Balaban Y, İnan Mİ, et al. Comparison of long term efficacy and cost‐effectiveness of omalizumab in 150 mg and 300 mg doses in patients with chronic spontaneous urticaria. An Bras Dermatol. 2025;100:31–7.
Trabalho realizado no Gulhane Training and Research Hospital, Ankara, Turquia.