O carcinoma sebáceo (CS) é neoplasia maligna rara, descrita por Allaire em 1891, comumente localizado na cabeça e pescoço e com predileção pela região periocular (38,7%).1 O CS apresenta maior incidência em idosos (6a a 7a décadas de vida) e no sexo masculino (58% dos casos); a população caucasiana é a mais acometida (86,2%).1,2 Avaliamos, de maneira retrospectiva, 22 casos de pacientes diagnosticados com pelo menos um CS. Três pacientes tiveram o diagnóstico de dois CS primários, entre janeiro de 2006 e dezembro de 2020, em um hospital universitário brasileiro. Assim como descrito em trabalhos anteriores,2 o sexo masculino apresentou maior incidência de CS, correspondendo a 55% dos casos avaliados. A média de idade ao diagnóstico foi de 67 anos (24 a 94 anos), e a maioria dos pacientes era de etnia caucasiana.
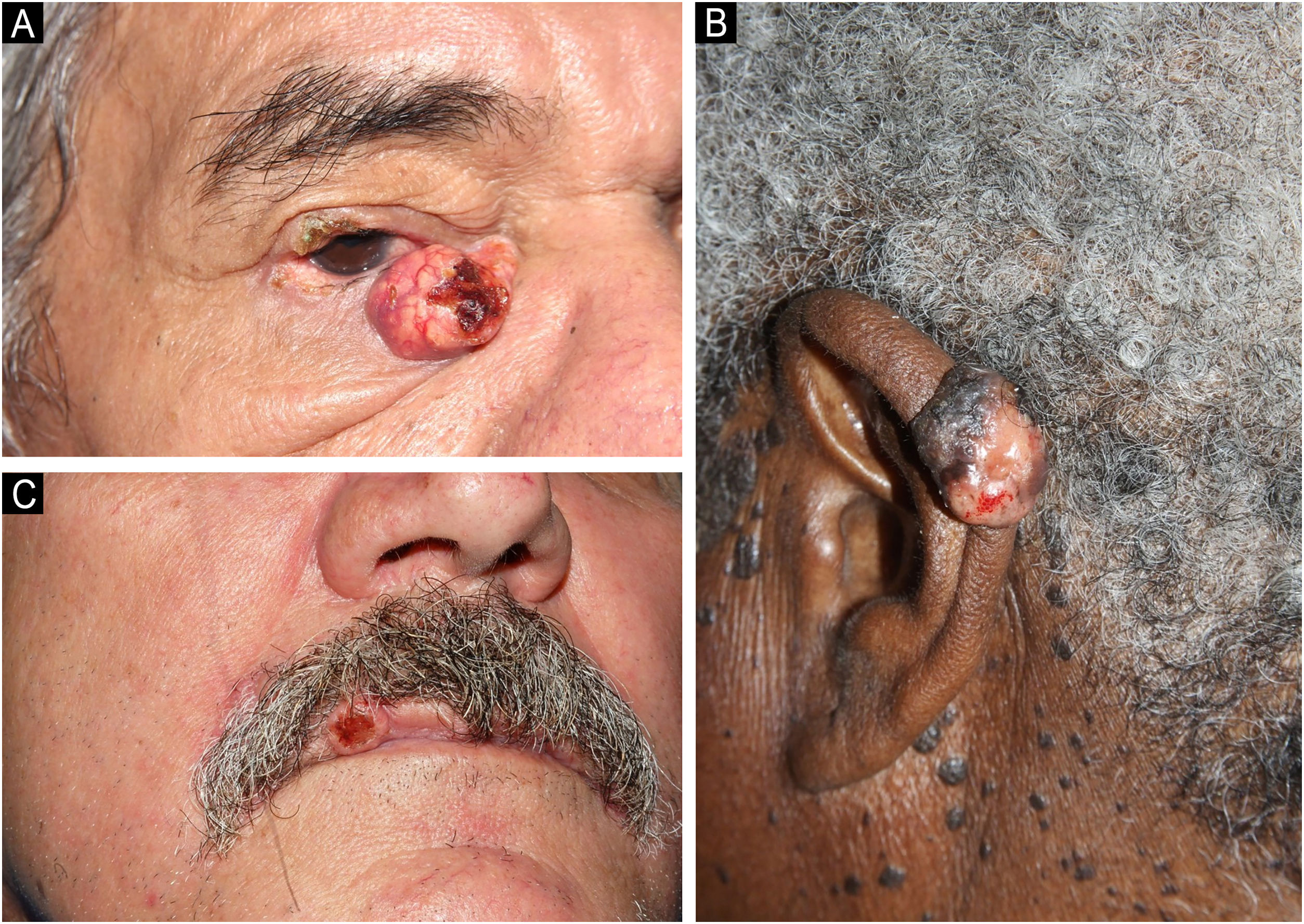
Clinicamente, os CS diagnosticados apresentaram características variadas: pápulas, placas, nódulos ou tumores, geralmente amarelados ou eritematosos, com telangectasias, brilho perláceo, ceratose ou ulceração. A região cranioencefálica e cervical foi preferencialmente acometida e, em 10 casos, o CS estava localizado na região periocular (seis na pálpebra superior e quatro na inferior; fig. 1A). Foram descritos um caso de CS no pescoço, um no pavilhão auricular (fig. 1B), três na região malar, cinco na região nasal, um no couro cabeludo, um no lábio (fig. 1C) e um no mento. Apenas dois CS foram diagnosticados em outra topografia (ombro e tórax). Nove pacientes foram investigados quanto à presença da síndrome de Muir‐Torre (SMT), e apenas em quatro foi confirmada a perda de expressão de pelo menos um gene de reparo de DNA do tipo mismatch por imuno‐histoquímica. Metade dos casos estudados apresentou diagnóstico de outros tumores cutâneos, como carcinomas basocelulares (CBC), carcinomas espinocelulares (CEC), adenomas sebáceos e sebaceomas, únicos ou múltiplos, com ou sem associação com a SMT. Ademais, oito casos apresentaram diagnóstico de neoplasias não cutâneas: 1) carcinoma de mama ductal invasivo (sem associação com SMT); 2) linfoma de Hodgkin; 3) linfoma não Hodgkin e adenocarcinoma de cólon; 4) retinoblastoma bilateral (não investigados para SMT); 5) adenocarcinoma de cólon; 6) tumor neuroendócrino de sigmoide e hepatocarcinoma; 7) adenocarcinoma de cólon, adenocarcinoma de papila duodenal com metástase hepática e adenocarcinoma de próstata; 8) adenocarcinoma de cólon e mieloma múltiplo (confirmados para SMT). O tratamento de escolha em dez casos de CS foi a excisão ampla do tumor. Em um caso foi realizada cirurgia micrográfica de Mohs e, em outro caso, a radioterapia foi adotada como método adjuvante. Apenas um caso foi tratado com radioterapia paliativa. Quatro tumores foram removidos por meio de shaving ou saucerização. O tempo médio de seguimento dos pacientes foi de quatro anos; apenas nove mantiveram o seguimento ambulatorial até o término do estudo. Três pacientes apresentaram metástase do CS: 1) CS diagnosticado na pálpebra inferior apresentou metástase para linfonodo cervical; foi realizada exérese ampla, sem novas recorrências; 2) dois CS diagnosticados nas pálpebras superior e inferior, com metástases parotídeas e pulmonares, foram tratados com excisão de todos os tumores associada à radioterapia, sem recorrência; 3) CS diagnosticado no ombro, tratado inicialmente com excisão ampla, apresentou recorrência local após um ano associada à metástase linfonodal. Esse paciente evoluiu a óbito. Houve ainda dois óbitos por causas não relacionadas ao CS (hepatocarcinoma e mieloma múltiplo). Os dados compilados se encontram na tabela 1.
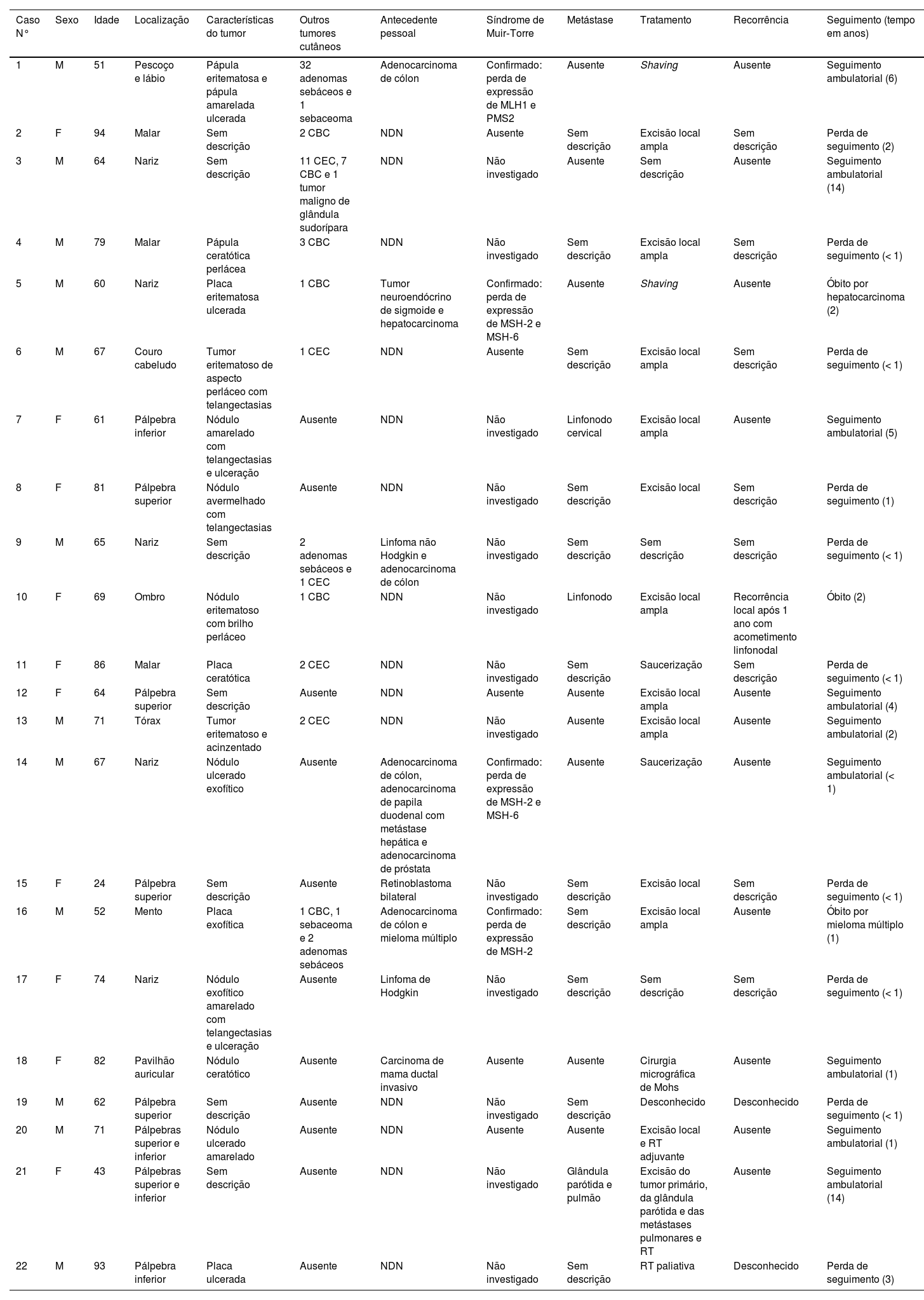
Características clínicas dos pacientes diagnosticados com carcinoma sebáceo
| Caso N° | Sexo | Idade | Localização | Características do tumor | Outros tumores cutâneos | Antecedente pessoal | Síndrome de Muir‐Torre | Metástase | Tratamento | Recorrência | Seguimento (tempo em anos) |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | M | 51 | Pescoço e lábio | Pápula eritematosa e pápula amarelada ulcerada | 32 adenomas sebáceos e 1 sebaceoma | Adenocarcinoma de cólon | Confirmado: perda de expressão de MLH1 e PMS2 | Ausente | Shaving | Ausente | Seguimento ambulatorial (6) |
| 2 | F | 94 | Malar | Sem descrição | 2 CBC | NDN | Ausente | Sem descrição | Excisão local ampla | Sem descrição | Perda de seguimento (2) |
| 3 | M | 64 | Nariz | Sem descrição | 11 CEC, 7 CBC e 1 tumor maligno de glândula sudorípara | NDN | Não investigado | Ausente | Sem descrição | Ausente | Seguimento ambulatorial (14) |
| 4 | M | 79 | Malar | Pápula ceratótica perlácea | 3 CBC | NDN | Não investigado | Sem descrição | Excisão local ampla | Sem descrição | Perda de seguimento (< 1) |
| 5 | M | 60 | Nariz | Placa eritematosa ulcerada | 1 CBC | Tumor neuroendócrino de sigmoide e hepatocarcinoma | Confirmado: perda de expressão de MSH‐2 e MSH‐6 | Ausente | Shaving | Ausente | Óbito por hepatocarcinoma (2) |
| 6 | M | 67 | Couro cabeludo | Tumor eritematoso de aspecto perláceo com telangectasias | 1 CEC | NDN | Ausente | Sem descrição | Excisão local ampla | Sem descrição | Perda de seguimento (< 1) |
| 7 | F | 61 | Pálpebra inferior | Nódulo amarelado com telangectasias e ulceração | Ausente | NDN | Não investigado | Linfonodo cervical | Excisão local ampla | Ausente | Seguimento ambulatorial (5) |
| 8 | F | 81 | Pálpebra superior | Nódulo avermelhado com telangectasias | Ausente | NDN | Não investigado | Sem descrição | Excisão local | Sem descrição | Perda de seguimento (1) |
| 9 | M | 65 | Nariz | Sem descrição | 2 adenomas sebáceos e 1 CEC | Linfoma não Hodgkin e adenocarcinoma de cólon | Não investigado | Sem descrição | Sem descrição | Sem descrição | Perda de seguimento (< 1) |
| 10 | F | 69 | Ombro | Nódulo eritematoso com brilho perláceo | 1 CBC | NDN | Não investigado | Linfonodo | Excisão local ampla | Recorrência local após 1 ano com acometimento linfonodal | Óbito (2) |
| 11 | F | 86 | Malar | Placa ceratótica | 2 CEC | NDN | Não investigado | Sem descrição | Saucerização | Sem descrição | Perda de seguimento (< 1) |
| 12 | F | 64 | Pálpebra superior | Sem descrição | Ausente | NDN | Ausente | Ausente | Excisão local ampla | Ausente | Seguimento ambulatorial (4) |
| 13 | M | 71 | Tórax | Tumor eritematoso e acinzentado | 2 CEC | NDN | Não investigado | Ausente | Excisão local ampla | Ausente | Seguimento ambulatorial (2) |
| 14 | M | 67 | Nariz | Nódulo ulcerado exofítico | Ausente | Adenocarcinoma de cólon, adenocarcinoma de papila duodenal com metástase hepática e adenocarcinoma de próstata | Confirmado: perda de expressão de MSH‐2 e MSH‐6 | Ausente | Saucerização | Ausente | Seguimento ambulatorial (< 1) |
| 15 | F | 24 | Pálpebra superior | Sem descrição | Ausente | Retinoblastoma bilateral | Não investigado | Sem descrição | Excisão local | Sem descrição | Perda de seguimento (< 1) |
| 16 | M | 52 | Mento | Placa exofítica | 1 CBC, 1 sebaceoma e 2 adenomas sebáceos | Adenocarcinoma de cólon e mieloma múltiplo | Confirmado: perda de expressão de MSH‐2 | Sem descrição | Excisão local ampla | Ausente | Óbito por mieloma múltiplo (1) |
| 17 | F | 74 | Nariz | Nódulo exofítico amarelado com telangectasias e ulceração | Ausente | Linfoma de Hodgkin | Não investigado | Sem descrição | Sem descrição | Sem descrição | Perda de seguimento (< 1) |
| 18 | F | 82 | Pavilhão auricular | Nódulo ceratótico | Ausente | Carcinoma de mama ductal invasivo | Ausente | Ausente | Cirurgia micrográfica de Mohs | Ausente | Seguimento ambulatorial (1) |
| 19 | M | 62 | Pálpebra superior | Sem descrição | Ausente | NDN | Não investigado | Sem descrição | Desconhecido | Desconhecido | Perda de seguimento (< 1) |
| 20 | M | 71 | Pálpebras superior e inferior | Nódulo ulcerado amarelado | Ausente | NDN | Ausente | Ausente | Excisão local e RT adjuvante | Ausente | Seguimento ambulatorial (1) |
| 21 | F | 43 | Pálpebras superior e inferior | Sem descrição | Ausente | NDN | Não investigado | Glândula parótida e pulmão | Excisão do tumor primário, da glândula parótida e das metástases pulmonares e RT | Ausente | Seguimento ambulatorial (14) |
| 22 | M | 93 | Pálpebra inferior | Placa ulcerada | Ausente | NDN | Não investigado | Sem descrição | RT paliativa | Desconhecido | Perda de seguimento (3) |
CBC, carcinoma basocelular; CEC, carcinoma espinocelular; F, feminino; M, masculino; NDN, nada digno de nota; RT, radioterapia.
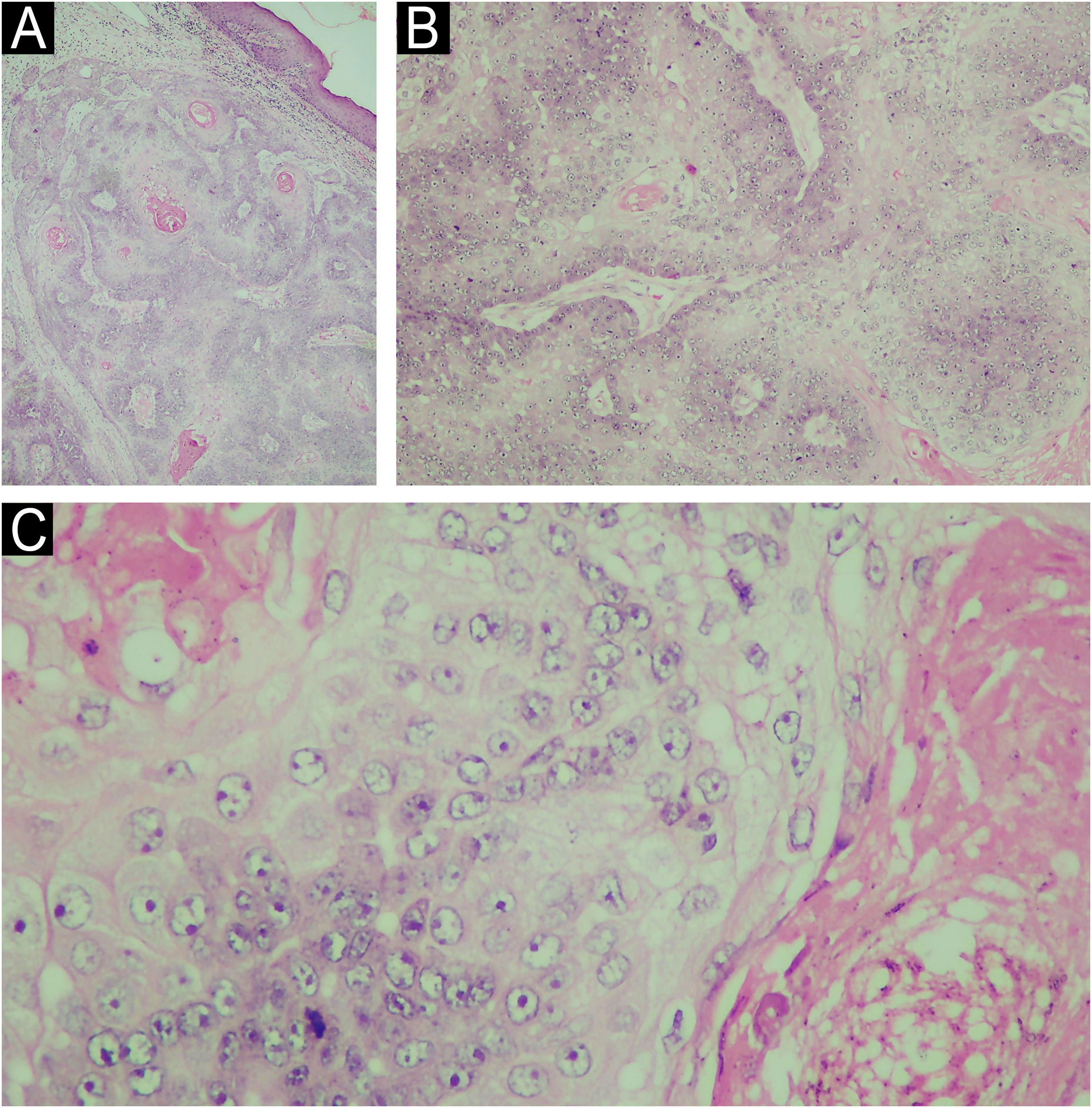
Morfologicamente, o CS pode se apresentar com características variadas, mimetizando tumores benignos (hiperplasias sebáceas, adenomas sebáceos, sebaceomas, nevos nevocelulares), neoplasias malignas (CBC e CEC), bem como doenças inflamatórias, como no calázio, na blefarite e na ceratite – essas últimas afecções consideradas diagnósticos diferenciais de lesões perioculares.1,3 Seu diagnóstico é confirmado pelo exame histopatológico de uma biopsia contendo a derme profunda (fig. 2) e do exame imuno‐histoquímico (EMA, epithelial membrane antigen, positivo, óleo vermelho O positivo, Sudan preto positivo – essas duas últimas colorações devem ser feitas em cotes congelados; fig. 2). O exame anatomopatológico do CS é caracterizado pela presença de lóbulos sebáceos irregulares e assimétricos, com sebócitos apresentando citoplasma vacuolizado, hipercromasia e atipia nuclear (fig. 2).2,4 Pelo fato de ser raro e mimetizar outras dermatoses, procedimentos inadequados para o diagnóstico, como o shaving e a saucerização são realizados, o que retarda ainda mais o diagnóstico do CS.
(A) Exame histopatológico da biopsia cutânea do carcinoma sebáceo da região mandibular esquerda (Hematoxilina & eosina, 10×). (B) O exame histológico revelou a presença de invasão desordenada da derme por lóbulos mal definidos de sebócitos atípicos (Hematoxilina & eosina, 100×). (C) Em maior aumento, pode ser observado sebócitos atipicos (Hematoxilina & eosina, 400×).
A maioria dos casos de CS acontece de maneira esporádica e tem como fatores de risco a imunossupressão, em especial o transplante de órgãos sólidos e a síndrome da imunodeficiência adquirida (Aids), a exposição à radiação ultravioleta (UV), radioterapia, infecções virais, antecedente de retinoblastoma familiar e SMT.5 A predominância de lesões de CS nas áreas fotoexpostas foi evidenciada em nosso estudo; 90% dos tumores se localizavam na cabeça e pescoço e 40% na região palpebral (entre eles, dois casos com lesões nas pálpebras superior e inferior). Outra evidência de que os pacientes de nossa casuística apresentavam fotodano importante é o diagnóstico de outros tumores cutâneos induzidos pela radiação UV, como o CBC e o CEC, observados em 45% dos nossos casos. O Brasil é um país com alta incidência de radiação UV em virtude de sua posição geográfica, aumentando, assim, o risco de desenvolvimento de tumores malignos cutâneos induzidos pela radiação UV em sua população.
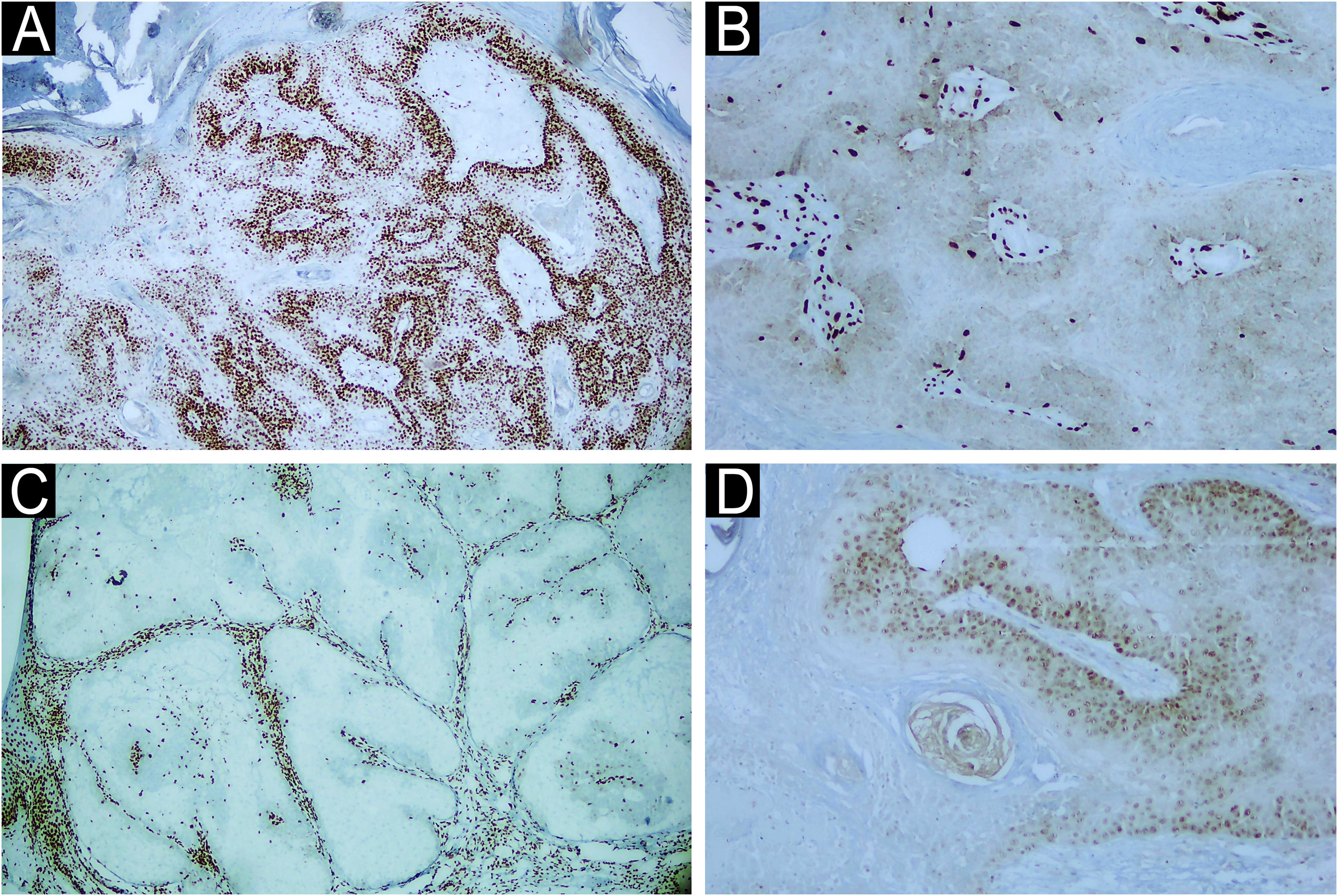
A SMT é doença rara autossômica dominante em que há mutação em um gene de reparo do DNA do tipo mismatch (MLH‐1, MSH‐2, MSH‐6, PMS1 Homolog 2 e PMS‐2).4,6,7 É caracterizada pela presença de neoplasias benignas ou malignas originadas em glândulas sebáceas que podem ocorrer de modo concomitante ou não a outras neoplasias malignas, em especial do trato gastrintestinal e do sistema genitourinário – o mais comum é o câncer colorretal (80% dos casos). Ceratoacantoma e CBC com diferenciação sebácea também são comumente diagnosticados nesses pacientes.6 Na SMT, o CS ocorre em idades mais precoces e é comum nas regiões extraoculares.8 A suspeição de SMT a partir do diagnóstico dos tumores sebáceos torna possível o rastreamento precoce de lesões malignas viscerais, o que pode favorecer melhor prognóstico aos portadores dessa síndrome. Em nossa casuística, quatro casos foram diagnosticados com SMT, apresentando perda de expressão de pelo menos um gene de reparo de DNA do tipo mismatch (fig. 3) e com antecedente de neoplasia de cólon acompanhada ou não de outra neoplasia primária. Apenas um caso de SMT não apresentou outra neoplasia cutânea.
Exame imuno‐histoquímico da biopsia cutânea de carcinoma sebáceo da região mandibular esquerda de paciente com SMT. O exame imuno‐histoquímico demonstrou a expressão dos genes de reparo do tipo mismatch (A) MLH‐1 presente (40×), (B) perda de MSH‐2, (C) perda de MSH‐6 (40×) and (D) perda de PMS‐2 (400×).
O tratamento cirúrgico com excisão do tumor com avaliação de margens no intraoperatório é o mais indicado para o CS.2,9 Entretanto, em tumores perioculares, sua realização pode ser desafiadora. Em caso de comprometimento de margens ou tumor localmente avançado com margens estreitas, a radioterapia adjuvante pode ser indicada.2,10 Em nossa casuística, há relato de apenas um caso tratado com cirurgia micrográfica de Mohs (CS do pavilhão auricular) e um de realização de radioterapia adjuvante (CS das pálpebras superior e inferior). Em ambos os casos, os pacientes mantêm seguimento ambulatorial sem recorrência do tumor primário ou metástases. A pequena disponibilidade de profissionais capacitados e equipamentos para realizar a cirurgia micrográfica de Mohs limita seu uso.
O CS é tumor maligno agressivo que apresenta altas taxas de mortalidade (5%–10%) e de recorrência (16%–18%).3 Os fatores de mau prognóstico são tumores >2cm, doença multicêntrica, lesões mal diferenciadas e acometimento simultâneo das pálpebras superior e inferior.9 Observamos três casos de metástases, uma de recorrência e um óbito em nossa casuística. No entanto, esses dados não foram suficientes para determinar a taxa de metástase, de recorrência e de mortalidade, pois dentre as limitações presentes em nosso estudo, a perda de seguimento dos pacientes e a documentação incompleta impossibilitaram seu cálculo.
Esta série de casos retrospectiva discute a importância de se ter em mente o CS como diagnóstico diferencial, principalmente em lesões perioculares. O diagnóstico precoce, a investigação de fatores de risco e da SMT são importantes para conduta adequada em benefício do paciente.
Suporte financeiroNenhum.
Contribuição dos autoresTatiana Mina Yendo: Concepção e desenho do estudo; Levantamento de dados, análise e interpretação dos dados; Redação do artigo, obtenção, análise e interpretação dos dados; Revisão crítica de literatura; Aprovação final da versão final do manuscrito.
Flavia Mascarenhas Damiani: Levantamento de dados, análise e interpretação dos dados; Análise estatística; Redação do artigo, obtenção, análise e interpretação dos dados; Revisão crítica de literatura; Aprovação final da versão final do manuscrito.
Suzana Matayoshi: Revisão crítica do conteúdo intelectual importante; Aprovação final da versão final do manuscrito.
Marcello Menta Simonsen Nico: Concepção e desenho do estudo; Revisão crítica do conteúdo intelectual importante; Participação efetiva na orientação da pesquisa; Participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; Revisão crítica de literatura; Aprovação final da versão final do manuscrito.
Conflito de interessesNenhum.
Os autores agradecem à Dr.a Neusa Yuriko Sakai Valente, do Departamento de Dermatologia da Faculdade de Medicina da Universidade de São Paulo, pelo auxílio nos exames anatomopatológicos e de imuno‐histoquímica deste trabalho.
Como citar este artigo: Yendo TM, Damiani FM, Matayoshi S, Nico MMS. Sebaceous carcinoma: clinical and demographic profile of patients in a tertiary referral hospital in Brazil. An Bras Dermatol. 2025;100. https://doi.org/10.1016/j.abd.2024.06.004.
Trabalho realizado na Faculdade de Medicina, Universidade de São Paulo, São Paulo, SP, Brasil.