Avaliar os efeitos adversos dos tratamentos estéticos faciais perante o uso da toxina botulínica e do implante de biomaterial.
MétodosA pesquisa bibliográfica desta revisão narrativa considerou artigos publicados em periódicos das bases de dados Medline, Pubmed, Embase e Lilacs com os seguintes termos: dermal fillers AND complications, vascular complications AND dermal fillers, adverse reaction AND toxin botulinum e adverse reaction AND dermal fillers. Os critérios de inclusão foram artigos disponíveis em inglês sobre eventos adversos no uso estético da toxina botulínica e preenchedores/bioestimuladores dérmicos.
ResultadosAs complicações demonstradas crescem simultâneas à progressiva realização dos procedimentos estéticos faciais. Estatísticas quantificativas dos procedimentos e dos países que os utilizam são habilmente classificados, outrossim as tendências de prosperidade desses procedimentos. As complicações não recebem essa mesma relevância – há deficiência na divulgação pela comunidade científica, ou por outra, o viés de publicação entre os resultados exitosos e as adversidades.
ConclusãoO desconhecimento das complicações advindas de procedimentos tão propagados e realizados impedem a elaboração de diretrizes baseadas em evidências. As complicações em procedimentos estéticos se tornam problema de saúde pública, epidemia que acontece sob a observância das autoridades sanitárias. A notificação compulsória dos eventos adversos ocorridos em procedimentos estéticos, que exijam atendimento médico, objetiva suprir essa lacuna. Com dados confiáveis e técnicos, poderemos reconhecer as causas e executar intervenções capazes de minimizar sequelas irreversíveis e óbitos. As complicações devem ser prontamente reconhecidas pelo dermatologista para, quando possível, buscar sua reversão ou seu manejo adequado.
A demanda por procedimentos estéticos, que tem aumentado mundialmente,1 tornou a utilização da toxina botulínica (TB) e de biomateriais altamente popular. Em 2021, a International Society of Aesthetic Plastic Surgery (ISAPS) divulgou a estatística mundial: foram realizados 30.439.576 procedimentos estéticos, cirúrgicos e não cirúrgicos.
A aplicação de TB continua a liderar os procedimentos não cirúrgicos, com 7.312.616 tratamentos, o que representou aumento de 17,7% em relação a 2020.
Biomateriais são elementos naturais ou sintéticos implantados em diversas partes do corpo, especialmente na face. O intuito estético é avolumar, reparar ou mesmo substituir tecidos. No caso do preenchedor, o efeito é avolumar; já os chamados bioestimuladores têm o efeito de induzir reações inflamatórias que culminam na reformulação dérmica, especialmente do colágeno. O ácido hialurônico (AH) é reconhecido por seu efeito volumizador; a hidroxapatita de cálcio e o ácido polilático, por seu efeito estimulador de fibroblastos.
Em 2019, o AH utilizado como preenchedor para fins estéticos contabilizou 4.315.859 procedimentos, um aumento de 15,7% em relação a 2018. Em 2020, o AH apresentou queda de 6,1%, provavelmente em virtude da pandemia de COVID‐19, com número absoluto de 4.053.016 aplicações.
Os biomateriais caracterizam‐se pelo downtime reduzido, e são anunciados por parte dos profissionais, ao nosso entendimento erroneamente, como procedimentos minimamente invasivos.2 A utilização de termos que atenuam a complexidade dos procedimentos médicos pode prejudicar o real entendimento da população quanto aos riscos que eles carregam.
A indústria fabricante desses produtos visa à comercialização e atua atendendo aos seus interesses. Aos médicos, não cabe a comercialização e sim o tratamento, operando procedimentos que melhorem a autoestima e a qualidade de vida dos pacientes.3 Embora sejam procedimentos relativamente seguros, é evidente a crescente ocorrência de complicações que exigem intervenções médicas.
Protocolos e diretrizes frente às adversidades devem ser dominados pelos médicos para realização imediata quando as complicações ocorrem, seja no momento da aplicação ou posteriormente. Entretanto, não há uma diretriz na condução de eventos adversos com evidência científica, apesar dos ensaios clínicos presentes na literatura.
Perspectivas como a notificação compulsória de eventos adversos que necessitem de atendimento médico podem auxiliar o conhecimento das causas das complicações e possibilitar a elaboração de diretrizes baseadas em evidências.4 Desse modo, pode‐se prevenir futuros distúrbios e iniciar o debate sobre os produtos e tecnologias, as técnicas, aspectos imunológicos do hospedeiro e os profissionais que atuam nos diversos níveis de tratamentos estéticos.2,4
Nesta narrativa, os autores abordam tipos de reações adversas com recomendações para minimizar os resultados dessas reações ao tratar pacientes com TB ou implantes cutâneos ou biomateriais.
MétodosEsta revisão narrativa baseou‐se em artigos publicados em periódicos das bases de dados Medline, Pubmed, Embase e Lilacs. Foram considerados: artigos originais, estudos experimentais, relatos de caso, série de casos, opiniões de especialistas; estudos observacionais (coorte) prospectivos, retrospectivos, estudos transversais, ensaios clínicos e revisões de literatura, com detalhes de casos individuais, investigando ou discutindo o papel dos biomateriais e da TB que descrevessem os eventos adversos no uso com intuito estético de 2017 a 2022; além de publicações em livros.
Foram utilizados os termos: “dermal fillers AND complications, vascular complications AND dermal fillers, adverse reaction AND toxin botulinum e adverse reaction AND dermal fillers, fillers AND autoimmune syndrome”.
Limitamos a busca para estudos publicados em texto completo e no idioma inglês. A triagem dos artigos elegíveis rendeu 50 estudos. Além desses, foram incluídos outros trabalhos relevantes em relação aos dados estatísticos de reações adversas aos procedimentos, características dos biomateriais e toxinas, reações de hipersensibilidade e síndrome autoimune/autoinflamatória desencadeada por adjuvantes, biofilmes, patógenos e medicamentos.
Eventos adversos da toxina botulínica, prevenção e manejoA TB é proteína proveniente da bactéria Clostridium botulinium. A TB apresenta elevada afinidade e especificidade para células neuronais e é capaz de se ligar a essas células, bloqueando a liberação da acetilcolina na placa motora e causando paralisia muscular seletiva.5
Os fatores predisponentes relacionados aos eventos adversos da toxina são a qualidade do produto, caraterísticas do diluente, ausência de competência (conhecimento e habilidade) do profissional e variabilidade da anatomia facial.6,7 Os eventos adversos relacionados à TB são menos graves quando comparados aos dos biomateriais.8
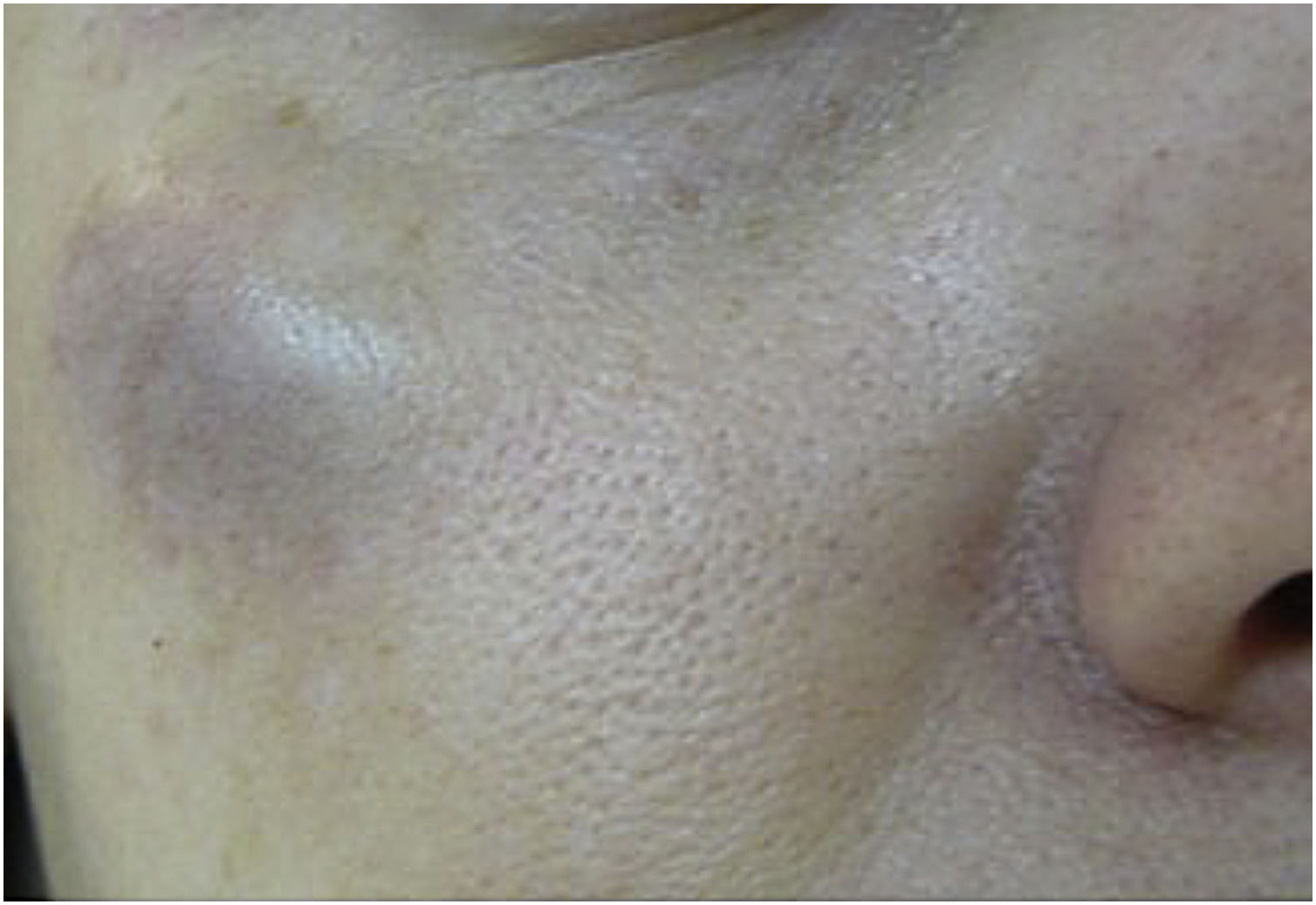
Hematoma e equimoseSão os efeitos adversos mais comuns após a aplicação da TB. A equimose ocorre com maior frequência frente ao hematoma, que é mais raro; no entanto, pode surgir após aplicações mesmo com agulhas finas e bisel afiado5,8 (fig. 1).
Frente ao hematoma, pode ser realizada a administração de analgésicos, cremes heparinoides e Arnica montana, embora sem evidência científica.8,9 Cabe a orientação ao paciente acerca da decomposição e absorção do sangue extravasado.
Hipotonia muscular e hipertonia do músculo antagônicoO efeito da TB é neurotóxico. Quando ele se dá nos alvos musculares desejados, temos efeito terapêutico; entretanto, se o relaxamento ou a paralisação muscular ocorrer nos músculos adjacentes ou fora da área planejada, esse efeito torna‐se adverso.8 Dentre as causas dos efeitos adversos, estão: má seleção de pacientes, injeção em local impróprio e doses altas.10 Como má seleção, consideramos: pacientes com expectativas irreais aos verdadeiros e possíveis efeitos da TB, pacientes que apresentam sulcos estáticos, os quais não necessitam da movimentação muscular para se apresentar clinicamente, e os que têm níveis elevados, III ou IV segundo a classificação de envelhecimento de Glogau. Os sinais clínicos de envelhecimento pela classificação de Glogau, descrita em 1996 no Seminário de Medicina e Cirurgia Cutânea, incluem, além das rítides, lentigos, ceratoses, telangiectasias, brilho, vigor e cor da pele da face. No tipo III, as rugas aparecem em repouso; no tipo IV, toda a face é tomada por rugas.11
A hipotonia do músculo elevador da pálpebra superior por má aplicação ou por difusão da TB leva à ptose da pálpebra superior.12
A ptose da sobrancelha depende do tratamento do músculo frontal e da adinamia obtida. Assimetria e ptose da sobrancelha são efeitos adversos relativamente comuns após o tratamento com TB. Sua incidência varia entre menos de 1%, podendo chegar a 5%.10
A assimetria das sobrancelhas surge quando a dose equivalente não é injetada no lado contralateral ou pela difusão inadequada da toxina nas fibras musculares, ou mesmo quando algumas fibras do músculo frontal são hipertônicas em relação às contralaterais. Essa forma de assimetria pode ser facilmente controlada pela injeção de unidades adicionais nos músculos hipertônicos.13
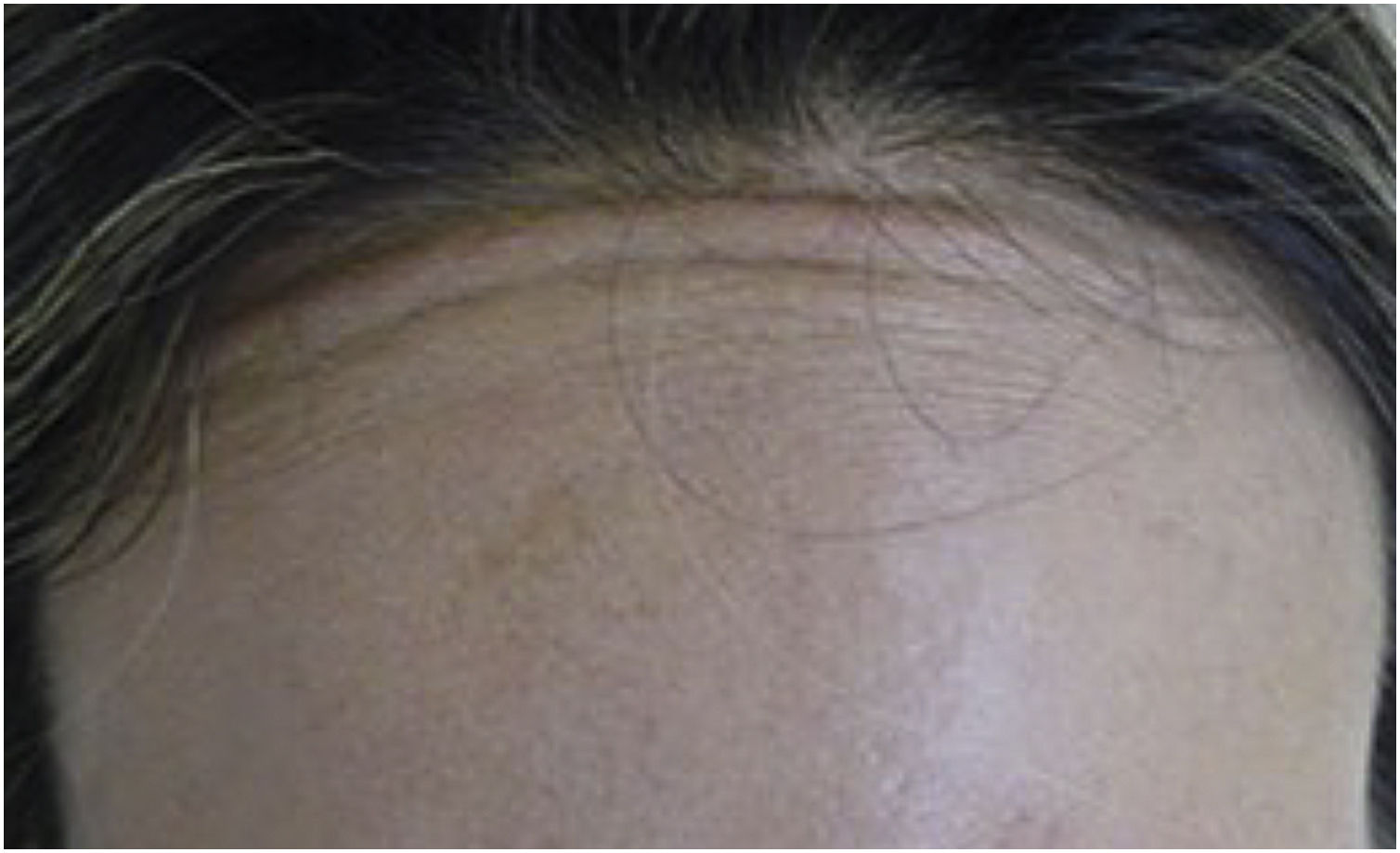
O músculo frontal tem variações anatômicas em relação a seus corpos laterais e o plano tendinoso central.14,15 A avaliação clínica minuciosa diminui essas situações desfavoráveis, tanto pela falta quanto pelo excesso de tratamento do músculo frontal.13
Fibras musculares do músculo frontal que ultrapassam a linha de implantação capilar persistem na contração, causando incômodo estético (fig. 2).
Blefaroptose e ectrópioBlefaroptose e persistência da assimetria da sobrancelha podem surgir após tentativa de correção de assimetrias. Estudo envolvendo 25 pacientes para tratamento da região frontal mostrou ptose de sobrancelha média de 2,3mm em 22 pacientes.15
A ptose da sobrancelha pode ser evitada ao se injetar cerca de 2 a 3cm acima da margem supraorbitária ou pelo menos 1,5 a 2cm acima da sobrancelha. A ptose palpebral é observada em pessoas idosas com dermatocalaze e que contraem as fibras inferiores do músculo frontal para elevar as sobrancelhas e as pálpebras.5 Em pacientes acima de 65 anos tratados para o relaxamento glabelar, a assimetria é um efeito adverso que pode ser observado. Grande parte desses pacientes tem uma das sobrancelhas anatomicamente inferior em comparação à contralateral – trata‐se de assimetria própria dessa faixa etária. Em conjunto, a pálpebra superior ipsilateral da sobrancelha inferiorizada também se encontra com essa mesma característica. A elevação compensatória da sobrancelha levará à visão desobstruída, mas quando esses pacientes são tratados com TB, há o enfraquecimento das fibras inferiores do músculo frontal, interrompendo, assim, a elevação compensatória da sobrancelha. Sem essa elevação, há aparente queda na pálpebra superior, resultando em assimetria. Isso pode ser evitado examinando cuidadosamente e levando em consideração a assimetria da linha de base antes da definição da dose de TB na área em questão.15
Apraclonidina 0,5% colírio pode ser usado para ptose palpebral causando contração do músculo de Müller, que é um elevador simpatomimético da pálpebra superior, elevando‐a em 1 a 2mm.16 A solução oftálmica de fenilefrina é alternativa à apraclonidina, mas seu uso deve ser monitorado adequadamente em virtude do risco de efeitos adversos, como glaucoma de ângulo estreito.5
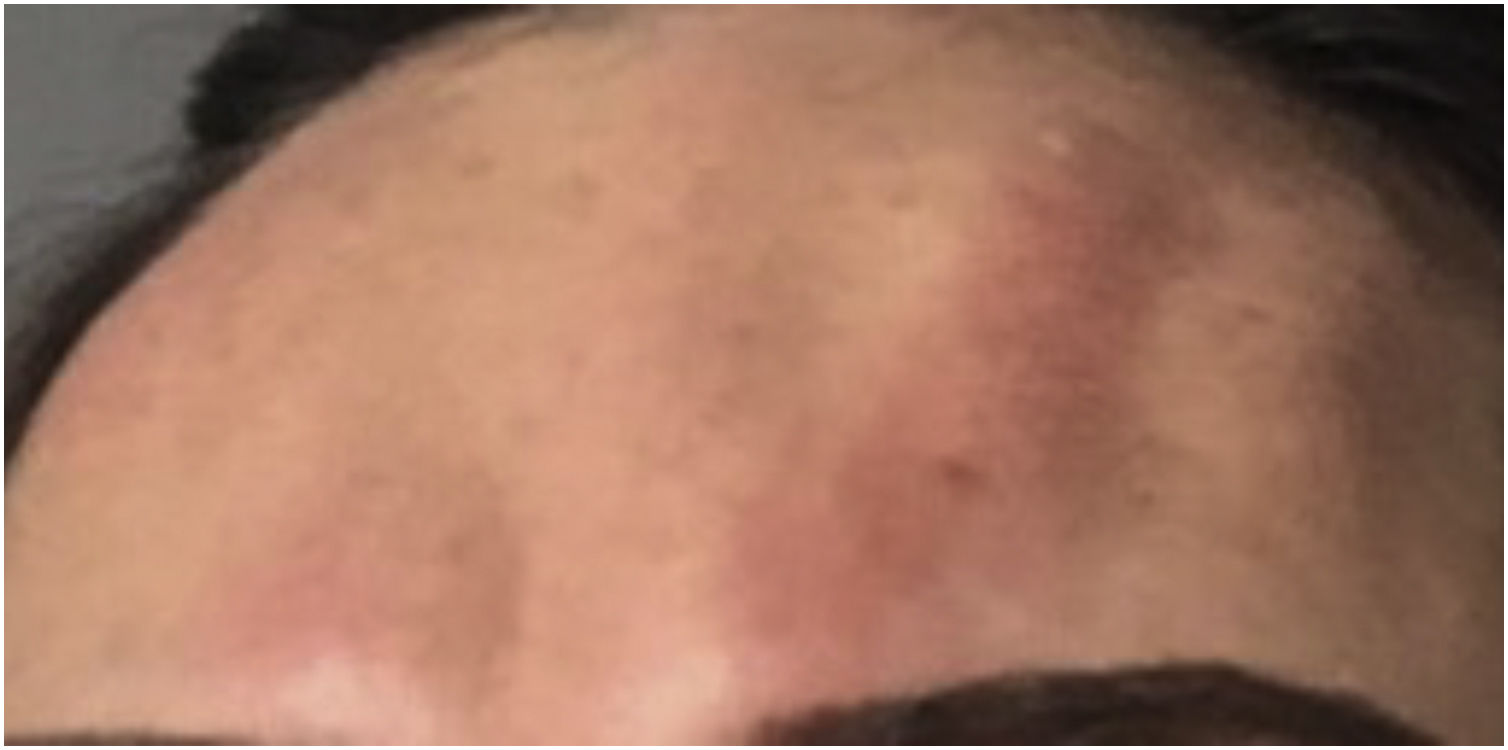
Quando o tratamento é realizado próximo à pálpebra inferior, há perda de força da alça muscular orbicular lateroinferior decorrente da difusão local da TB, podendo causar ectrópio.17 O ectrópio pode causar complicações pela exposição prolongada da córnea, como xeroftalmia secundária por evaporação do filme lacrimal (fig. 3).
Não há tratamentos específicos para reversão do ectrópio. O uso de lubrificantes oculares está indicado para os casos de xeroftalmia, além do acompanhamento oftalmológico até a reinervação fisiológica do músculo.13,18,19
Cefaleia e alterações oftalmológicasA ptose palpebral é o efeito adverso mais frequente, ocorrendo em 3,39% dos casos. Nesta mesma metanálise, a cefaleia aparece como o segundo efeito adverso.20
Além das distonias musculares, outras complicações são passíveis à aplicação da TB. A injeção da TB na lateral da órbita pode causar efeitos colaterais oftalmológicos como diplopia, ectrópio, lagoftalmo e xeroftalmia.13,21
A ocorrência de diplopia pode ser decorrente da difusão da TB além do septo orbitário, o que confere relaxamento dos músculos extraoculares. Estudo relatou incidência de 1,7% e a maioria foi por paresia do músculo oblíquo inferior.22 Lentes corretivas com prisma podem ser utilizadas, mas o quadro é dinâmico e passageiro, o que torna essa conduta desnecessária.
O lagoftalmo pode ocorrer pela perda da função esfincteriana do músculo orbicular dos olhos, levando ao fechamento inadequado das pálpebras. A perda da função esfincteriana do músculo orbicular do olho, juntamente com a fraqueza da pálpebra, pode ocorrer se a toxina se difundir para a parte palpebral do músculo orbicular do olho.
A lubrificação nos casos de ectrópio ou lagoftalmo são essenciais para evitar o ressecamento da córnea.
A xeroftalmia, pela diminuição da produção de lágrimas, pode ser observada se a toxina for injetada profundamente na área periocular lateral superior por afetar a glândula lacrimal.20
A epífora pode ocorrer pelo enfraquecimento induzido pela toxina na porção palpebral medial do músculo orbicular dos olhos, com aumento da secreção de lágrimas. Essas complicações podem ser evitadas pela injeção subdérmica da toxina e pela injeção lateral à linha vertical que passa pelo canto lateral.13,18,19
Ao planejar injeções infraorbitais deve‐se excluir pacientes com scleral show, aqueles que apresentem tratamentos prévios nas pálpebras ou que apresentem xeroftalmia, pois podem piorar com a aplicação da TB.
Pacientes com frouxidão septal inferior podem evidenciar as bolsas de gordura infraorbitais pelo enfraquecimento do músculo orbicular, tornando proeminentes pseudo‐hérnias; portanto, não devem ser tratados até que as bolsas tenham sido removidas.23
Relatos de disfagia após o uso estético de TB na região cervical estão entre efeitos adversos compilados pela FDA. Casos extremos decorrentes da aplicação de altas doses de TB são a paralisia muscular dos músculos da faringe e do esôfago ocasionando pneumonia por aspiração. A conduta é a intubação e respiração assistida.24
Urticária, anafilaxia, dispneia e edema dos tecidos molesAinda que raras, complicações graves como urticária, anafilaxia, dispneia e edema dos tecidos moles podem ocorrer. O tratamento imediato deve ser iniciado (fig. 4).25,26
Há relatos de granuloma supurativo no local da injeção de TB com resolução após seis semanas de antibioticoterapia de amplo espectro.26
Edema periocular com duração de alguns dias pode ocorrer. Essa reação particular é atribuída à estase linfática causada pelo enfraquecimento da função de bombeamento esfincteriano do músculo orbicular levando à retenção de linfa nas áreas adjacentes.26
Infecções cutâneas podem ocorrer após injeção de TB. A injeção cria pertuito que rompe a barreira protetora da pele e facilita a penetração de microrganismos. Infecções causadas por microbactérias atípicas são relatadas na literatura.27 As microbacterioses atípicas são facilmente confundidas com infecções comuns. Testes microbiológicos precoces são indicados para o diagnóstico. Embora rara, trata‐se de complicação grave. Lima et al.28 relataram o surgimento de placas e nódulos eritematosos com sinais inflamatórios que surgiram dias após a aplicação de TB. Cinco meses após foi realizada biopsia, e o anatomopatológico demonstrou presença de infiltrado inflamatório granulomatoso dérmico e hipodérmico com células epitelioides e áreas centrais com abscesso. Alguns bacilos ácido‐resistentes positivos foram identificados pela coloração de Fite‐Faraco. O tratamento é variável quanto aos antimicrobianos e quanto ao tempo. Pode ser realizado em monoterapia ou necessitar da combinação de outros antimicrobianos, como claritromicina ou azitromicina, associação de etambutol e rifampicina28 ou rifabutina. Minociclina e doxiciclina29 podem ser alternativas, assim como sulfametoxazol associado ao trimetoprim. O tempo de tratamento é longo; considera‐se manter de um a dois meses após a resolução clínica.30
É importante o monitoramento rigoroso dos pacientes submetidos a procedimentos cosméticos com doenças infecciosas. As infecções por micobactérias são especialmente desafiadoras, pois são difíceis de diagnosticar e tratar; a recorrência da doença é morbidade comum desse processo. O tratamento dessas infecções requer intervenções médicas para alcançar a cura. Pode ser necessário o desbridamento cirúrgico combinado com antibióticos sugeridos pelo antibiograma. As três espécies relevantes associadas aos procedimentos cosméticos são Mycobacterium abscessus, M. chelonae e M. fortuitum. Mycobacterium abscessus pode formar biofilme e ser resistente ao tratamento.31,32
Outros eventos adversos são mais comuns após o uso terapêutico da TB; contudo, podem ser notados após o uso cosmético. Destacamos: insuficiência velofaríngea, plexopatia braquial, hipotonia muscular generalizada semelhante ao botulismo, fasciíte necrosante, crise de miastenia, blefaroptose bilateral acentuada, comprometimento da fala e mastigação, síndrome de Guillain‐Barré, disfagia, pneumonia por aspiração, madarose facial unilateral e alopecia e nefropatia.33–37 Entretanto, a patogênese da neuropatia após injeção de TB não está elucidada, já que a paralisia do nervo facial é doença comum e pode ocorrer por coincidência.31–33 Sabemos que a TB pode contribuir para o surgimento da neuropatia por ser capaz de ligar com alta afinidade a gangliosídeos (GT1b e GQ1b), induzindo características clínicas semelhantes à síndrome de Guillain‐Barré.33–35 Exame neurológico e estudo eletrofisiológico são úteis para distinguir paralisia do nervo facial da fraqueza muscular relacionada à TB.34
TB e anticorpos autoimunes contra a tireoide compartilham homologia na sequência de aminoácidos. Epítopos, ou seja, a menor porção do antígeno, são encontrados em algumas regiões homólogas. Esse dado é relevante por sugerir possível ligação patogenética entre a TB e doenças autoimunes da tireoide.38
Recomenda‐se que pacientes com suspeita de distúrbio neuromuscular subclínico sejam testados antes da administração da TB pré‐tratamento, mesmo em pequenas doses.39
Dover et al. relatam que complexos de neurotoxina/proteína BoNT‐A não influenciam a imunogenicidade. Qualquer relação entre a formação de anticorpos neutralizantes e a resposta clínica é complexa, e os médicos devem considerar outros fatores que podem induzir uma aparente perda de resposta clínica.40
Prevenção de complicações relacionadas à toxina botulínica e manejo das adversidadesO conhecimento da anatomia facial, tanto angiolinfática quanto neural e sobretudo muscular, de técnicas de antissepsia, princípios farmacológicos da TB, interações com medicamentos e doenças, entre outros aprendizados da formação médica são essenciais para o adequado tratamento facial com TB.41–43
Eventos adversos do uso de biomateriais (preenchedores e/ou bioestimuladores)Os biomateriais são substâncias derivadas ou produzidas por organismos vivos, ou ainda, provenientes de material sintético que interagem com o sistema biológico do receptor com diferentes objetivos, como sustentar e até mesmo substituir tecidos.44 São amplamente utilizados com finalidade cosmética.45
A Food and Drug Administration (FDA) conceitua os biomateriais utilizados com fins estéticos como preenchedores dérmicos ou implantes injetáveis para preenchimentos de tecidos moles, como sulco nasolabial, malares, mento, lábios e dorso de mãos. A FDA não aprova o uso de biomateriais na glabela, nariz, região frontal, cervical, mamas e glúteos.46 Em junho de 2023, a FDA aprovou biomaterial para injeção na região periorbital.47
A duração desse efeito depende do biomaterial e da área onde são injetados. Atualmente, os implantes injetáveis mais utilizados são AH, hidroxiapatita de cálcio, ácido poli‐L‐láctico,48 polimetilmetacrilato e policaprolactona. Os biomateriais são categorizados conforme suas caraterísticas químico‐físicas e reológicas, a qual destacam‐se composição química, tempo de permanência, viscosidade, coesividade e elasticidade.49
Segundo a Agência Nacional de Vigilância Sanitária (Anvisa), os biomateriais recebem o nome técnico de “solução para preenchimento intradérmico”, “implantes absorvíveis” e “implantes faciais”. São classificados como devices e quanto ao risco à saúde como “risco máximo”, e apenas orientações de uso e não bulas são disponibilizadas pela agência. Chama atenção o número de implantes injetáveis para preenchimentos intradérmicos registrados na Anvisa – apenas os biomateriais de AH contabilizam 121 produtos. A classificação do AH apresenta três nomes técnicos, a maioria categorizada como “solução para preenchimento intradérmico”. Entre esses, muitos têm a orientação da Anvisa para que sejam injetados no subcutâneo ou região supraperiostal, e não intradérmico.50
Estão disponíveis e registrados no mercado brasileiro quatro produtos à base de hidroxiapatita de cálcio e policaprolactona – três à base de ácido poli‐L‐lático. Entre as policaprolactonas, as apresentações recebem o nome técnico de “implante facial”. Encontramos produtos não registrados na Anvisa à base de hidroxiapatita de cálcio e formulações com vários princípios farmacêuticos associados ao AH.
Apesar dos avanços nas caraterísticas químicas e biológicas dos preenchedores, reações adversas transitórias e/ou persistentes podem ocorrer após o uso de qualquer biomaterial, mesmo nas mãos de experientes dermatologistas e cirurgiões plásticos, podendo causar substancial impacto no resultado.51,52
Todos os biomateriais são potencialmente capazes de causar reações adversas sérias, embora essas reações não sejam frequentes.53,54
Alguns alertam para que sejam usados apenas por médicos; outros, por profissionais de saúde. Acreditamos que seja necessária uma classificação mais homogênea e clara pelos órgãos competentes, outrossim, respeitar a Lei 12.842/2013, vigente no Brasil.55
A maioria das reações adversas é discreta, transitória, reversível e não específica e está relacionada ao procedimento e a resposta inflamatória de curto prazo evocada pelo implante.56,57
Entretanto, é reconhecido pela comunidade científica que as reações adversas não estão apenas associadas à falha técnica ou ao aumento do número de indicações, mas também à resposta imune que se manifesta sob diferentes formas clínicas (edema, nódulos, placa endurada) e com diferentes padrões anatomopatológicos (reação granulomatosas, granuloma sarcoídico, granuloma de corpo estranho, paniculite eosinofílica).51,58
Essa resposta imune do hospedeiro frente ao implante pode ser em razão da própria imunogenicidade, ou da capacidade de o biomaterial atuar como superantígeno e iniciar diretamente resposta imune e da presença de DNAs contaminantes nos implantes injetáveis que, por meio dos receptores Toll‐like (TLR), podem estabelecer a transição do estado de infecção para o de hipersensibilidade59,60 e induzir a produção de citocinas pro‐inflamatórias, como interleucina 12 e fator de necrose tumoral, que potencialmente são capazes de desencadear exacerbação da inflamação.59,61
Saczonek et al. relatam que a patogênese pode estar associada à capacidade de o biomaterial se comportar como adjuvante, por ser capaz de ligar‐se aos receptores padrões de reconhecimento desencadeando resposta imune inata. Assim, é capaz de aumentar a resposta inflamatória por interagir com os TLR, ativando células dendríticas, inflamassomas com liberação de citocinas inflamatórias pode levar à estimulação da resposta imune adaptativa e desencadear doença autoinflamatória ou autoimune.62
Algumas evidências indicam que organismos procarióticos (DNAs contaminantes) podem invadir a área de implantação do preenchedor aderindo à superfície do implante e possibilitando a formação de colônia denominada biofilme. O comportamento adaptativo dos microrganismos dentro do biofilme e a capacidade de se esquivar do sistema imunológico conferem resistência aos antibióticos.59,61
Assim, por meio de vários mecanismos, os implantes injetáveis são capazes de provocar reações imunomediadas indesejáveis. O risco dessas reações parece estar associado ao tempo de permanência do biomaterial nos tecidos.
Classificação e tratamento das reações adversas aos implantes dérmicosConforme a Anvisa e a Organização Mundial da Saúde, os efeitos adversos desses devices (biomateriais) são classificados em leve, moderado e grave, de acordo com o percentual de permanência em relação ao tempo, grau de intensidade e a frequência que ocorre em 30 dias.
Dessa maneira, entendemos que a classificação com base no tempo de aparecimento dos sinais e sintomas não está adequada e não há consenso nas definições precoce e tardia.
Assim, a prevalência das complicações passíveis ao tratamento com implantes injetáveis é deficiente na literatura científica63 e elas transitam entre adversidades de baixo impacto, como excesso de produto levando a assimetrias faciais graves, a raras e significantes, que podem evoluir ao óbito do paciente após infecção ou oclusão de vasos.
É provável que também estejam atribuídos aos fatores de complicação o recente e rápido crescimento no uso do implante injetável, em conjunto com o controle inadequado do produto e do injetor. Pesquisadores sugerem que para minimizar as complicações deve haver cuidadosa consideração das variáveis, como paciente, produto e procedimento.64
Algumas condições preexistentes do paciente são contraindicações absolutas ou relativas para o uso de biomateriais. Destacamos: infecções ativas da pele ou de outros, por exemplo sinusite, doença periodontal, gastroenterite e infecção urinária. Condições inflamatórias da pele (pioderma gangrenoso) ou à distância do local tratado (colite ulcerativa, doença de Crohn, osteoartrite), alergias, diabetes não controlada, doenças autoimunes, imunossupressão e alterações da coagulação.61,65
Neste artigo, consideramos a classificação utilizada pela Anvisa que se baseia no artigo publicado por Requena et al.45
Não existem classificações homogêneas. Consideremos reação adversa leve como sendo de intensidade tolerável e raramente ultrapassando 30 dias. Dentre as reações adversas leves às aplicações de biomateriais, destacamos: equimoses/hematoma, eritema, edema, parestesias, dor e prurido.
A frequência de equimoses/hematomas é variável (1,6 a 51,7%)66 e um dos eventos adversos mais comuns. Safran defende que provavelmente não é relatado em muitos artigos de aumento labial em virtude do tempo limitado para o paciente. No entanto, ainda representa resultado que causa desconforto, preocupação e recuperação prolongada.63 Não há especificação da técnica utilizada para o preenchimento; no entanto, pode haver indícios de subnotificação quando comparado com outros estudos, como o de Daytan, que tratou 157 pacientes e obteve hematomas em 93,3%.67 Fagien relatou a presença de hematoma após preenchimento dos lábios em 92%.68 Em 2005, Carruthers et al. publicaram ensaio clínico em que utilizaram AH nos lábios de 15 pacientes; dor, eritema e edema ocorreram nos 15 pacientes.69
Por outro lado, Solish et al. preencheram os lábios de 21 pacientes e 61,5% apresentaram edema.70 Em 2012, Eccleston relatou em um universo de 60 indivíduos: 8,3% com edema e nódulos no local da aplicação; outros efeitos adversos ocorreram em menos de 4% desses 60 indivíduos. Considerou‐se eventos leves em 75% e moderado em 25% pacientes. Apenas um caso de nódulo perdurou por mais de 12 meses.71
Acredita‐se que a variação de 100% demonstrada por Carruthers e 8,3% por Eccleston pode ser decorrente de diferenças no método do avaliador. O mesmo pode ser considerado por Beer, que tratou 221 pacientes e obteve edema labial severo e 2%. Um dado adicional neste estudo é o relato de dor em 20% dos pacientes.72
Em 2013, Fagien constatou edema em 94% dos pacientes tratados com AH. Esse dado está em concordância com os achados por Carruthers.68,69
Os edemas geralmente são autolimitados.63 Não há tratamento específico para essas reações adversas, que em geral desaparecem em sete dias. Compressas frias, quando totalmente excluída a hipoperfusão sanguínea, são recomendadas para edema e hematoma, e analgésicos/anti‐inflamatórios para parestesias. O uso de medicamentos tópicos locais para equimoses e hematomas carece de evidência científica.
Efeito Tyndall, edema persistente de caráter intermitente ou não, nódulos não inflamatórios e inflamatórios, infecção, ulceração, abscesso, reações de hipersensibilidade e necrose são classificados como moderados ou graves, a depender da magnitude do quadro clínico.73,74
O efeito Tyndall é o surgimento da coloração azulada por posicionamento superficial do biomaterial, comum no uso de AH. Descrito por John Tyndall em 1868, é o espalhamento da luz através de um meio denso. Esse meio denso é o preenchedor; a luz azul predomina por ser a onda mais distribuída.75 Pouco se descreve sobre esse efeito. Se não for tratado quando possível, o efeito permanece visível por vários anos, e tem como diferencial o hematoma e a diminuição da irrigação da pele.
O edema persistente de caráter intermitente classificado por alguns autores como aquele que dura mais de 14 dias apresenta alto incômodo estético. O preenchimento realizado na pálpebra inferior é propenso a essa complicação. O preenchimento do tear trough é passível a edemas persistentes. Acreditamos que essa área seja uma das que mais exige conhecimento técnico do médico.
Estudo conduzido por Diwan com tratamento de 48 goteiras lacrimais demonstrou que a aplicação por meio de cânulas de ponta romba supraperiostal e não por agulhas se mostrou segura. No entanto, o autor relata um pequeno número de indivíduos que evoluíram com hematomas e edemas que duraram até quatro semanas.76
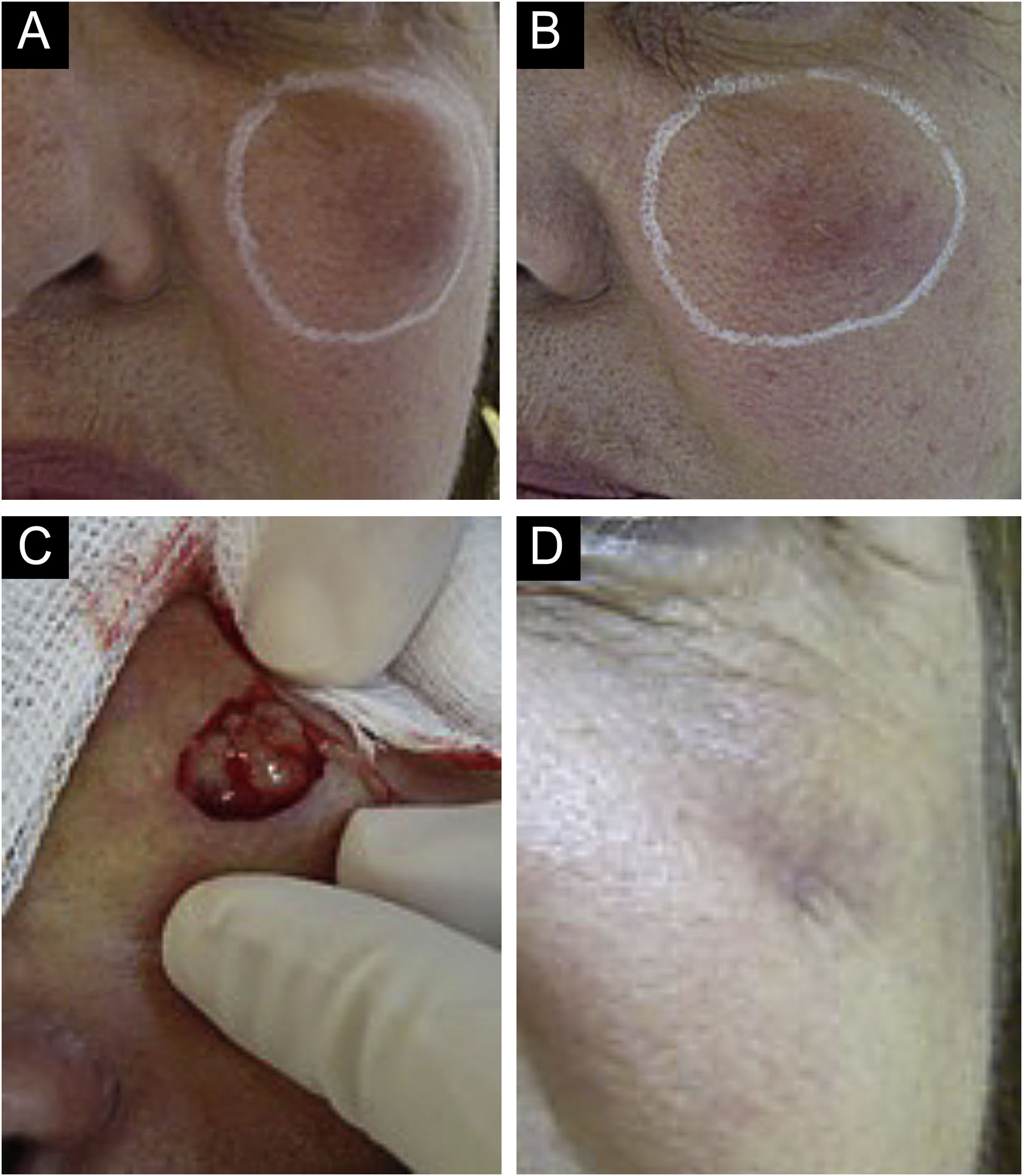
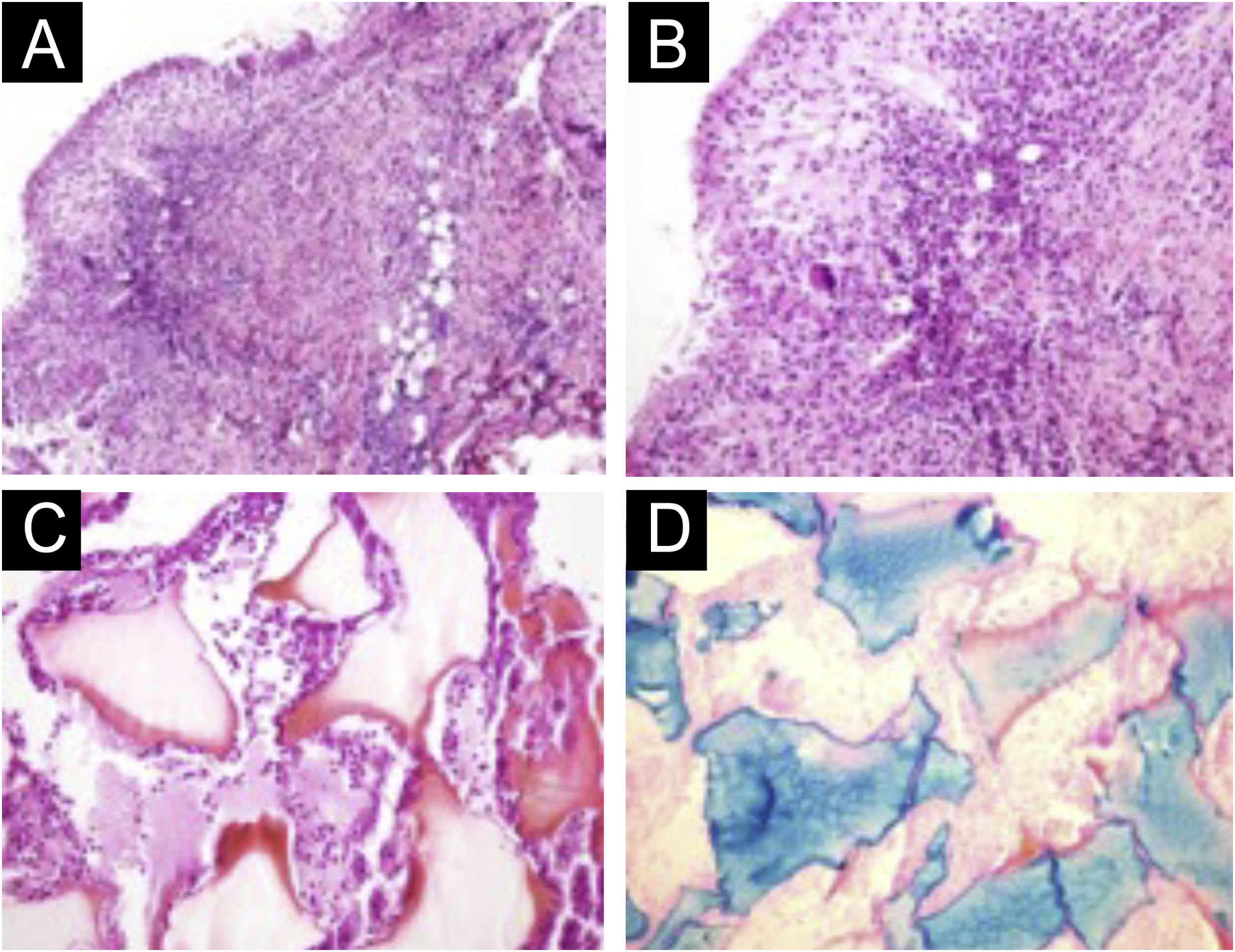
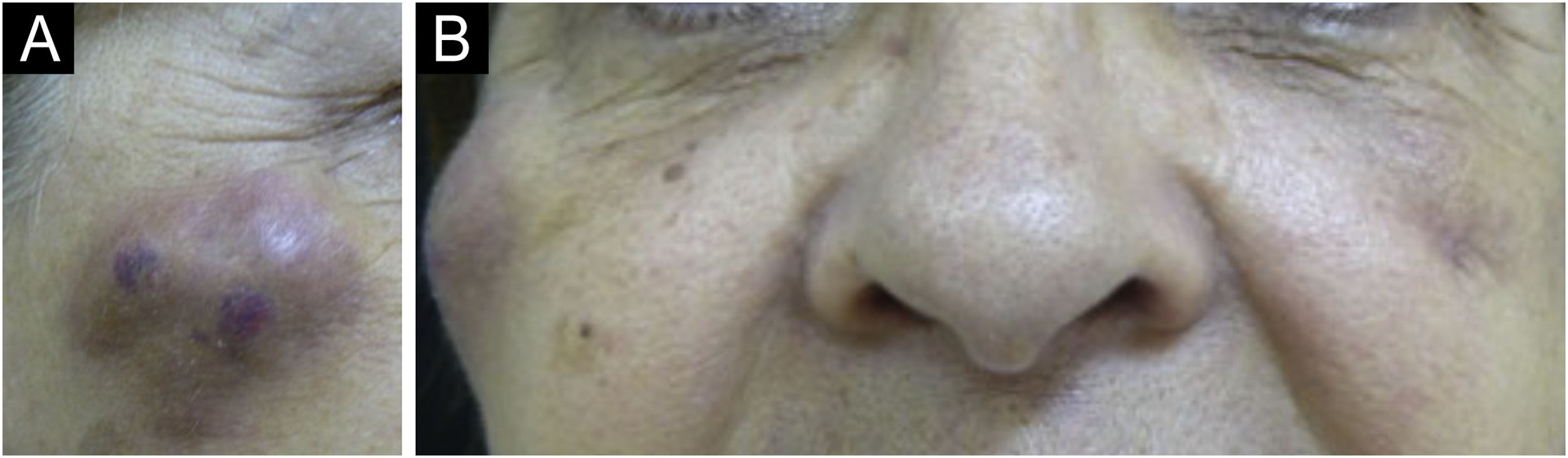
Existem variações estatísticas em relação à formação de nódulos a depender da área e técnica utilizada. Os nódulos não inflamatórios surgem logo após o procedimento e representam acúmulo de produto (fig. 5). Os nódulos inflamatórios representam inflamação granulomatosa caraterizada pelo histopatológico por granuloma, que podem ser de origem infecciosa ou não infecciosa, com células epitelioides, que podem se fundir gerando células gigantes (tipo Langherans ou semelhante a corpos estranhos), linfócitos, leucócitos, até plasmócitos. Os nódulos infecciosos podem ser causados por fungos, bactérias (fig. 6) ou microbactérias, e os não infecciosos se apresentam histopatologicamente como granulomas de tipo corpo estranho ou sarcoidose‐símile (fig. 7), que podem surgir até anos após o implante dérmico (fig. 8).77
Nódulo inflamatório. Drenado com presença de secreção seropurulenta. (A‐B) Região malar esquerda. Nódulo palpável em todo o perímetro circundado em branco. Eritema, edema, aumento da temperatura local e dor à palpação. Vinte dias depois, iniciou preenchimento com ácido hialurônico, supraperiostal, segundo informação da profissional que realizou o procedimento. (C‐D) Drenagem e limpeza da cavidade. Material purulento, espesso e sem odor. Cicatriz com perda de volume na região drenada. Efeito adverso permanente (grave).
Anatomopatológico do nódulo. (A) Derme reticular profunda com infiltrado inflamatório misto e infiltrado granulomatoso tuberculoide em paliçada circundando material amorfo e eosinófilo com os caracteres de ácido hialurônico (Hematoxilina & eosina, 100×). (B) Pormenor evidenciando o infiltrado granulomatoso tuberculoide em paliçada (Hematoxilina & eosina, 200×). (C) Material amorfo e eosinófilo envolto por leucócitos neutrófilos íntegros e degenerados (Hematoxilina & eosina, 200×). (D) Coloração pelo ferro coloidal fortemente positiva comprovando tratar‐se de ácido hialurônico. Ferro coloidal, 200×.
Surgimento de nódulos na região malar direita, 45 dias após o procedimento e 30 dias após o surgimento do nódulo contralateral, de iguais características. Paciente já estava com antibiótico de amplo espectro em virtude do nódulo à esquerda. Destaca‐se que são três nódulos provavelmente nos locais das injeções do implante.
Não está claro se as reações inflamatórias que surgem tardiamente (grau moderado a grave), assim nominadas por Artzi, são verdadeiras reações de hipersensibilidade. Os especialistas consultados pelo grupo de Artzi apoiaram fortemente etiologia ou gatilho infeccioso e rejeitaram a palavra “hipersensibilidade” no contexto de reações inflamatórias tardias. E associaram a alguns fatores desencadeantes, como infecções virais, produtos de baixa qualidade, combinações de diferentes produtos e técnica inadequada. A maioria desses especialistas concordou que antibióticos devem ser administrados como terapia de primeira linha, até mais de um antibiótico. Por outro lado, o uso de corticosteroides é reservado para reações inflamatórias intensas com edema importante ou para casos recalcitrantes, e não citaram o uso de anti‐histamínicos ou anti‐inflamatórios. 73,78
Há hipótese de que infecções de outras regiões e traumas possam atuar como fatores desencadeantes por permitir pequenas bacteremias (fig. 9). Observa‐se que alguns nódulos evoluem para abcessos com fístulas e cultura negativas. A falha da antibioticoterapia sugere presença de microbactérias ou biofilmes por bactérias comuns – p. ex., estafilococos. Não é claro como identificar biofilmes nesses implantes, e estudos prospectivos e randomizados de longa duração com rígidos fatores de inclusão e exclusão são necessários.
Em relato de casos que analisou preenchimento nos lábios, a formação de nódulos foi o evento adverso mais comum, representando 56,7% dos casos. O autor relata que sua incidência é bastante rara e muitas vezes causada por maior volume de produto colocado superficialmente ou em um mesmo ponto ou por reação de defesa do organismo, em que histologicamente encontramos os granulomas de corpo estranho.67
As condutas frente à formação de nódulo não se sustentam em evidência científica, mas há resultados satisfatórios com tratamentos médicos instituídos.
Inicialmente, deve‐se classificar clinicamente os nódulos em inflamatório ou não inflamatório. Entre os nódulos inflamatórios, é preciso reclassificar pelas características clínicas em infecciosos ou não infecciosos, e deve‐se conhecer, sempre que possível, o produto injetado.
O tratamento deve ser precoce para nódulo não inflamatório, caracterizado pelo excesso de material injetado. Quando o biomaterial for o AH, deve‐se proceder com massagem local e injeção de hialuronidase (preferencialmente guiada por ultrassom dermatológico). Nos casos de nódulos por hidroxapatita de cálcio, Reddy cita a laserterapia, massagem e injeção de soro fisiológico no nódulo; entretanto, nem sempre se obtém bons resultados. Massagem e infiltração com soro fisiológico também são citadas para os casos em que o biomaterial usado foi o ácido poli‐L‐láctico.79,80
Farwick et al. defendem que o AH de baixo peso molecular tem maior atividade inflamatória.81 Entretanto, o AH derivado de Streptococus equi apresenta alto peso molecular pelo tamanho do polímero, o que pode explicar o motivo de diferentes preenchedores a base de AH com diferentes crosslinking estarem associados a diferentes reações, de moderadas a graves.59,60
Na presença de nódulo inflamatório com características clínicas de infecção, é mandatória a biopsia da lesão e exames anatomopatológico, cultura para bactérias aeróbias, anaeróbias e microbactérias, além do antibiograma. Pode‐se instituir antibioticoterapia após a coleta do material para os exames complementares, e realizar, se necessário, a drenagem do abscesso.
Para granuloma do tipo corpo estranho ou sarcoidose‐símile em que não se conseguiu identificar agente infeccioso, não há tratamento padronizado. Na literatura há relatos, desde infiltração de corticoide com ou sem 5‐fluoracil, aplicação local da hialuronidase (se o biomaterial for AH) e alguns relatos de melhora com inibidores da angiotensina 1 e inibidores da Jack quinase, além da exérese cirúrgica, quando possível.82,83
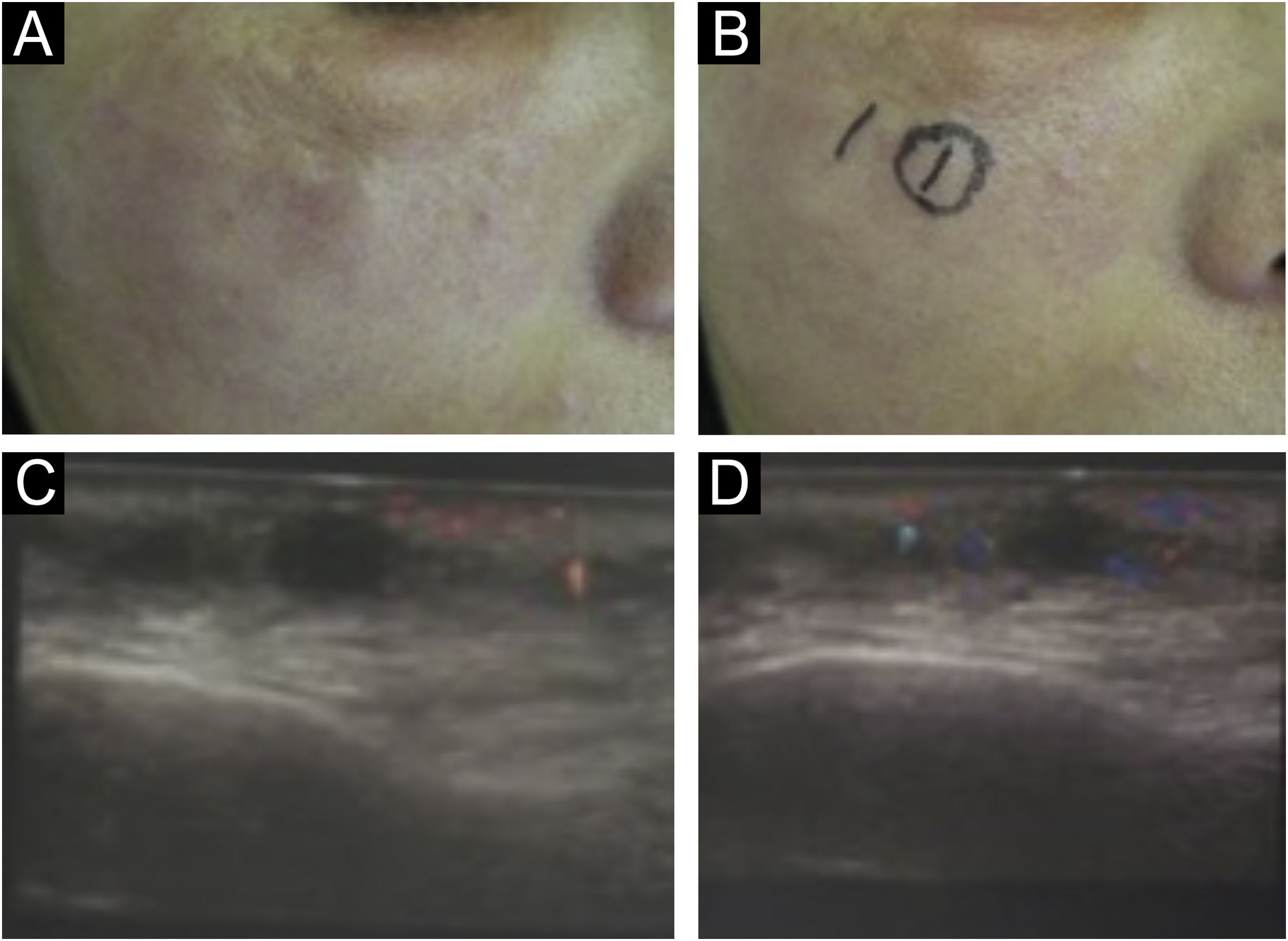
A reação adversa com lesão similar ao xantelasma (fig. 10) provocada por biomateriais não está totalmente esclarecida. Acredita‐se que o biomaterial pode se ligar às lipoproteínas de baixa densidade e o complexo LDL‐glicosaminoglicanos é internalizado por macrófagos. O tratamento é a exérese cirúrgica.84,85
Choque anafilático, migração do biomaterial, nódulos permanentes, opilação da irrigação sanguínea por oclusão em injeções intravasculares que resultam em necrose, cegueira e acidente vascular encefálico (AVE) são classificadas como complicações graves e potencialmente irreversíveis.73,74
A oclusão vascular é uma das complicações mais temidas nos preenchimentos com biomateriais. Autores confirmam que tanto agulhas quanto cânulas podem levar a complicações vasculares (fig. 11). Entretanto, parece haver diminuição do risco de acidente vascular com cânulas de ponta romba e calibres (gauge) menores; mesmo assim, não devemos superestimar a segurança do preenchimento por meio de cânula.86,87
Atenção aos sinais menores de oclusão vascular. Podem ser mal diagnosticados como hematoma, dor e edema relacionado à injeção e terem seu tratamento retardado.88
Doerfler et al. verificaram que 25 pacientes entre os 28 casos de embolia grave por AH utilizaram cânulas de 27 G a 22 G. Entre esses pacientes, nove casos evoluíram para cegueira, um caso de cegueira com AVE e 18 casos de necrose de grande área. Os autores concluíram que cânulas com gauge menor que 25 G apresentam risco menor de acidente vascular.89,90
Os países que mais relataram casos de oclusão vascular foram Coreia e China.91 Esse dado pode sugerir fragilidade sobre o real conhecimento das complicações. Em 2019, foram realizados 398.830 aplicações de AH no Brasil; na Itália, 303.812; na França, 192.358; no México, 170.515; e na Turquia, 140.795.92 Não houve casos publicados dessas complicações nos países epigrafados, o que sugere fortemente a subnotificação.
Lee afirma que embora injeções lentas com baixa pressão sejam geralmente consideradas seguras, as diferenças na pressão de ejeção durante uma injeção de preenchedor ainda precisam ser determinadas. Ele conclui que independentemente da força de injeção, a pressão de ejeção provavelmente é maior do que a pressão vascular no momento da entrada no vaso, o que torna a injeção perigosa. Mesmo a mais baixa pressão de ejeção é maior do que a pressão arterial. Observou‐se que a menor pressão calculada no momento da injeção era pelo menos cinco vezes maior que a pressão arterial sistólica.93
A subnotificação e a não publicação de complicações de perda de visão desafiam a credibilidade dos dados conhecidos, dificultando todo um planejamento de prevenção de complicações.4
A proporção entre as complicações relatadas em seis anos em relação ao número de aplicações em apenas um ano, o de 2019, não é crível. O Brasil, com 398.830 aplicações, não relatou nenhuma publicação de perda de visão; a Tailândia, com 4.733, relatou seis casos dessa complicação.
Os médicos devem minimizar os riscos de complicações vasculares dominando a anatomia vascular da face.89 A técnica cuidadosa, utilizando baixa pressão de injeção e aspiração prévia e prolongada, deve ser lembrada, mas não isenta essa fatídica adversidade. No que tange à aspiração antes da injeção, parece haver baixa confiabilidade nas aspirações negativas (fig. 12).
Evidências publicadas por Casabona94 e Van Loghem95 mostraram que a confiabilidade da aspiração é de 53% segundo Casabona e entre 33% e 63% segundo Van Loghem.
Esse fato mostra que não é possível estabelecer como se faz uma aspiração ideal e segura antes da injeção. Entretanto, esses autores preconizam a aspiração sistemática com a agulha no local da injeção com pressão negativa durante 10 segundos, injeção lenta com dispensa de pouco volume de preenchedor e atenção quanto ao desconforto/dor, sinais de coloração da pele suprajacente à área tratada e intervalos entre uma região e outra. O diálogo constante sobre dor e desconforto e o paradoxo de que a anestesia troncular ou sedação podem inibir esse reflexo de defesa corporal deixa o procedimento com maior risco.
O diagnóstico precoce da oclusão vascular e a instituição do tratamento em até 48 horas apresentam os melhores resultados.96
Salientamos a necessidade de lei para tornar a notificação compulsória dos casos com complicações que necessitam a intervenção do profissional médico.2,4
O AVE é complicação ainda mais rara, resultante da injeção intra‐arterial de preenchedores. Moore et al. demonstraram o caso de paciente que sofreu as três complicações após a injeção de AH: comprometimento vascular da pele frontal, cegueira unilateral e AVEs subclínicos ipsilaterais. Se não fosse por um protocolo de investigação de AVE, poderiam não ser diagnosticadas. Sugere‐se que a incidência de AVE por injeção intra‐arterial possa ser maior do que a relatada.97
O uso de preenchedores dérmicos, principalmente de AH, na área periocular está aumentando tanto para indicações funcionais quanto estéticas, por oferecerem alternativa a alguns procedimentos cirúrgicos, com a vantagem de resultados instantâneos, tempo mínimo de recuperação e baixas taxas de complicações. No entanto, o sucesso depende da seleção criteriosa dos pacientes, produtos e procedimentos para alcançar resultados favoráveis. Todos os implantes podem induzir isquemia tecidual; embora pequenas oclusões vasculares cutâneas não sejam incomuns, casos de cegueira secundária a injeções de preenchimento facial são considerados raros.98
Os sinais e sintomas da necrose tecidual podem ocorrer durante ou horas após a injeção com quadro clínico semelhante à síndrome de Nicolau (dor imediata, palidez e livedo e após alguns dias eritema, edema, pústulas com neovascularização e necrose da pele).99,100
São várias as teorias propostas para a patogênese da necrose tecidual induzida pela injeção de implantes dérmicos. O mecanismo de inflamação e destruição celular não é bem compreendido e parece que a lesão final é decorrente da associação de três fatores: trombose e embolia, angioespasmo por edema e reação inflamatória local, e injúria do endotélio vascular e/ou por reflexos arterioarterial ou venoarterial, além do acréscimo de outros autores para a reposta imunoalérgica do tipo vasculite com depósito de imunocomplexos, ativação do complemento e quimiotaxia de neutrófilos, resultando em necrose.101,102
Observou‐se em modelo animal que é possível produzir necrose tecidual quando ocorre, além da embolia arterial, a obstrução do fluxo de arteriais terminais que irrigam a região por meio de anastomoses.103
Em relação à conduta a ser tomada no caso de isquemia vascular cutânea, existem apenas tratamentos circunstanciais e condutas com baixo nível de evidência.
O nível de evidência que suporta o uso de oxigenioterapia hiperbárica em complicações agudas de preenchimento é geralmente fraco.86 O emprego da hialuronidase em altas doses nas primeiras 24 horas apresenta melhores resultados na isquemia cutânea do que após 24 horas, apesar da carência de evidências.96
Por outro lado, não há evidência de uso para evitar cegueira e tratamento de AVE.98
Não há evidência direta de que o ácido acetil salicílico (AAS) impeça a agregação plaquetária no caso de uma oclusão relacionada ao AH. Alguns autores consideram razoável e seguro o uso de AAS, com base na extrapolação das evidências da síndrome coronariana aguda.104 Não há evidências que a pasta de nitroglicerina auxilie nas obstruções por AH.105 Na isquemia tecidual induzida por preenchimento, o produto de preenchimento está presente nas arteríolas. Teoricamente, a aplicação precoce de pasta de nitroglicerina pode não melhorar a perfusão e piorar a isquemia, com dilatação dos vasos e posterior propagação do produto para as arteríolas e capilares menores.106
Não há estudos comparativos que meçam resultados e eficácia do uso de vasodilatadores periféricos na microcirculação da face. O sildenafil tem sido utilizado em distúrbios não eréteis. E por ser inibidor seletivo da fosfodiesterase tipo 5 específica de c‐GMP, favorece o relaxamento da musculatura lisa dos corpos cavernosos e a dilatação das artérias, proporcionando dilatação macrovascular e microvascular dependente de c‐GMP. No entanto, como os capilares não têm células musculares lisas, a velocidade do fluxo capilar depende principalmente do tônus vasomotor nas arteríolas, e os relaxamentos dessas resultando em melhor enchimento capilar e aumento do fluxo. Por outro lado, a meia‐vida curta do sildenafil (cerca de 4 horas) limita seu uso clínico. Alguns autores evidenciaram que o sildenafil contribuiu para a melhora da microcirculação e dos sintomas do fenômeno de Raynaud e na viabilidade dos retalhos cutâneos por efeito vascular e inibição da atividade plaquetária. Entretanto, não podemos avaliar se o seu uso seria benéfico nos casos de injúria vascular ocasionada pelo preenchedor dérmico.107,108
A heparina de baixo peso molecular (HPBM) é a mais indicada em virtude das propriedades anticoagulantes e anti‐inflamatórias, auxiliando principalmente no alívio da dor.109 Por sua ação anti‐inflamatória, a HPBM reduz o vasospasmo e, assim, melhora o fluxo arterial local, além de prevenir a formação de microtrombos pela injúria vascular, por sua ação anticoagulante. Para melhor ação anti‐inflamatória, associam‐se corticosteroides em dose anti‐inflamatória por três a cinco dias; entretanto, não há evidência científica.
Assim, por não haver padrão estabelecido para tratamento da oclusão vascular, mais importante é a prevenção, a qualidade técnica na execução do procedimento e seu acompanhamento após a intervenção precoce, ambulatorial e tardia. O paciente precisa ter o contato do médico executor ou membro de sua equipe. Por se tratar de ato específico, nem todo serviço de urgência terá condições técnicas para instituição do tratamento precoce, fundamental para o prognóstico com êxito.
Síndrome autoimune /autoinflamatória induzida por adjuvantes (síndrome ASIA)A síndrome ASIA foi sugerida em 2011, primeiramente por Shoenfeld et al.,110 e envolve em um único grupo de doenças imunomediadas. As quais provavelmente podem se desenvolver em indivíduos geneticamente predispostos após a exposição a adjuvantes (estímulos ou fatores desencadeantes que desencadeiam atividade imunológica), com período de latência e espectro clínico de siliconose, síndrome da guerra do Golfo, síndrome da miofascite macrofágica e fenômenos pós‐vacinação.110 Esses quadros compartilham vários aspectos clínicos com possível aparecimento de autoanticorpos e tendência de melhora ao remover o fator desencadeante. Os critérios de diagnóstico sugeridos pelos autores para a síndrome correspondem a dois critérios maiores ou a um critério maior e dois critérios menores (tabela 1).111
Critérios de diagnóstico da síndrome ASIA111
| Maiores | Menores |
|---|---|
| Exposição ao estímulo externo | Autoanticorpos contra adjuvantes |
| Latência: variável | Outras manifestações clínicas |
| Manifestações clínicas | HLA específicos-(DRB1, DQB1) |
| Local: nódulos/edema | |
| Sistêmicas: inespecíficas (p. ex., mialgia, miosite, fraqueza muscular, artralgia, granuloma corpo estranho nos gânglios, artrite, fadiga crônica, distúrbio do sono, manifestações neurológicas, alteração cognitiva, perda da memória, febre, boca seca) | |
| Remoção do agente indutor induz melhora | Surge doença autoimune |
| Biopsia típica do órgão envolvido |
Alijotas et al.59 e Cohen et al.112 relacionaram novos adjuvantes à síndrome ASIA. Injeções de biomateriais diferentes do silicone, como AH, acrilamidas, metacrilato e outros óleos injetáveis. Em 2013, Alijotas et al.59 sugerem a inclusão dos antígenos de histocompatibilidade (HLA B8, DRB1, DR3, DQB1 E) para os critérios maiores da síndrome e ampliam com exames laboratoriais os critérios menores (aumento de gamaglobulinas e/ou LDH e/ou enzima conversora de angiotensina e diminuição complementos).59 Mais recentemente, em 2023, Cohen et al.112 acrescentaram autoanticorpos não clássicos desregulados direcionados contra receptores acoplados à proteína G (GPCRs) do sistema nervoso autônomo e neuropatia de fibras pequenas (SFN), na tentativa de explicar o desenvolvimento de disautonomia na síndrome ASIA.
Na revisão realizada por Borba et al. em 2020,113 os autores destacam que a etiologia das manifestações clínicas da síndrome ASIA está muito além da compreensão, ao relacionar sarcoidose, síndrome de Sjögren, doença indiferenciada do tecido conjuntivo (DITC), síndrome de incompatibilidade de implantes de silicone e eventos adversos relacionados ao sistema imunológico como exemplos clássicos da síndrome ASIA. Assim, esses autores acreditam que é possível assumir a autoimunidade/autoinflamação nessas doenças em razão dos critérios maiores (clínicos) e menores (imunogenéticos). Outros autores112,113 sugerem que os pacientes que apresentam reações adversas aos biomateriais devem ser monitorados por vários meses.
Acreditamos que seja necessária a presença de fatores desencadeantes com atividade imunológica (ou adjuvantes, como agentes infecciosos, poeiras, vacinas, silicone, sais de alumínio, biomateriais, entre outros) e a cooperação no contexto favorável e geneticamente determinado, a fim de promover o aparecimento da doença. Entretanto, não há limite de tempo entre a exposição a esses adjuvantes e o efeito (síndrome ASIA), e é difícil provar relação causal entre queixas e exposição que ocorreu há vários anos114. Por outro lado, consideramos importante e alertarmos os dermatologistas da possível ocorrência da síndrome, apesar de rara, já que esses profissionais são qualificados para o atendimento a essas reações adversas.
Estratégias de prevenção de complicaçõesConsidera‐se importante recomendações antes, durante e após o tratamento com objetivo de minimizar os eventos adversos e orientar os pacientes dos riscos no implante injetável. Em relação às ponderações, elencamos a obrigatoriedade da consulta médica prévia ao procedimento. A consulta prévia consiste no exame físico, anamnese, história pregressa de doenças do paciente e familiares, gestação, uso de medicamentos, suplementos e vitaminas e procedimentos anteriores. Deve‐se dar ao paciente a justa explicação do procedimento a ser realizado, seus benefícios e riscos. Faz parte da conduta ética e profissional do médico informar ao paciente o diagnóstico, o prognóstico, os riscos e os objetivos do tratamento. Encorajamos que todos os médicos exponham essas informações por escrito, expliquem‐nas ao paciente e tenham assinado o termo de consentimento informado incluindo a possibilidade de tratamento para possíveis complicações.
A ultrassonografia dermatológica pode complementar o exame clínico para conhecer os possíveis biomateriais previamente implantados, além de nos mostrar estruturas vasculares e planos de tratamentos. Além disso, é exame importante para direcionar o tratamento nas reações adversas, como evidenciar abcesso, orientar a aplicação de hialuronidase e os locais de biopsia.
Quanto ao produto, é importante ter ciência sobre sua licença nos órgãos competentes e conhecer a possível interação com outros biomateriais.
Em relação à aplicação, após documentação fotográfica, deve ser realizado o planejamento de aplicação com a quantidade, descrição do produto, conhecimento de anatomia, técnica adequada para região anatômica e treinamento. A realização do procedimento deve respeitar a técnica cirúrgica asséptica preconizada nas escolas médicas.
Dada a escassez de ensaios clínicos prospectivos randomizados de longa duração (os ensaios, em geral, duram um ano) e à luz da subnotificação de complicações, faltam na literatura informações sobre a eficácia e a segurança desses procedimentos.63
A elaboração de diretrizes com os dados da notificação compulsória de complicações advindas de procedimentos estéticos que necessitem de assistência médica proporcionará real conhecimento das causas e poderá ser base para futuras pesquisas, classificação da gravidade, outrossim, desenvolver o conhecimento sobre o prognóstico dessas complicações. O Projeto de Lei 9.602/2018, aprovado na Comissão de Saúde, Seguridade Social e Família quanto ao mérito e na Comissão de Constituição e Justiça e Cidadania quanto a sua constitucionalidade e juricidade, prevê essa notificação em todo o território brasileiro.4 Esse Projeto de Lei encontra‐se no Senado Federal do Brasil.
ConclusãoOs autores não concordam com o termo “minimamente invasivo” utilizado por profissionais e até mesmo em artigos publicados em periódicos científicos. Classificar como “minimamente invasivos” procedimentos certamente invasivos como TB e uso de biomateriais com finalidade estética pode induzir a confusão e passar ao leigo a falsa impressão da inexistência de efeitos adversos, o que não é verdade.
Protocolos e diretrizes de condutas frente às adversidades devem ser dominados pelos médicos para realização imediata quando as complicações ocorrem no momento da aplicação.
Perspectivas como a notificação compulsória de eventos adversos em complicações causadas por procedimentos estéticos que necessitem de atendimento médico podem auxiliar o conhecimento das causas das complicações e possibilitar a elaboração de diretrizes baseadas em evidências.4 Desse modo, pode‐se realmente prevenir futuras complicações.
É essencial conhecer de maneira sistematizada e organizada as causas que originam as complicações. Entendemos que a notificação e o reconhecimento das causas ajudarão na prevenção e no tratamento e incitarão o debate sobre os produtos, tecnologias, técnicas e qualificação dos profissionais que atuam nos tratamentos estéticos.
Suporte financeiroNenhum.
Contribuição dos autoresÉrico Pampado Di Santis: Concepção e o desenho do estudo; levantamento dos dados, ou análise e interpretação dos dados; redação do artigo ou revisão crítica do conteúdo intelectual importante; participação efetiva na orientação da pesquisa; revisão crítica da literatura; aprovação final da versão final do manuscrito.
Sérgio Henrique Hirata: Redação do artigo ou revisão crítica do conteúdo intelectual importante; participação efetiva na orientação da pesquisa; revisão crítica da literatura; aprovação final da versão final do manuscrito.
Giulia Martins Di Santis: Levantamento dos dados, ou análise e interpretação dos dados; revisão crítica da literatura.
Samira Yarak: Concepção e o desenho do estudo; levantamento dos dados, ou análise e interpretação dos dados; redação do artigo ou revisão crítica do conteúdo intelectual importante; participação efetiva na orientação da pesquisa; revisão crítica da literatura; aprovação final da versão final do manuscrito.
Ao Professor Doutor Nilceo Schwery Michalany, patologista (CRM/SP 22.304 e RQE 48.700), pela cessão e laudo da figura 7.
Como citar este artigo: Di Santis EP, Hirata SH, Di Santis GM, Yarak S. Adverse effects of the aesthetic use of botulinum toxin and dermal fillers on the face: a narrative review. An Bras Dermatol. 2025;100:87–103.
Trabalho realizado na Pós‐graduação em Saúde Baseada em Evidências, Escola Paulista de Medicina, Universidade Federal de São Paulo, São Paulo, SP, Brasil.