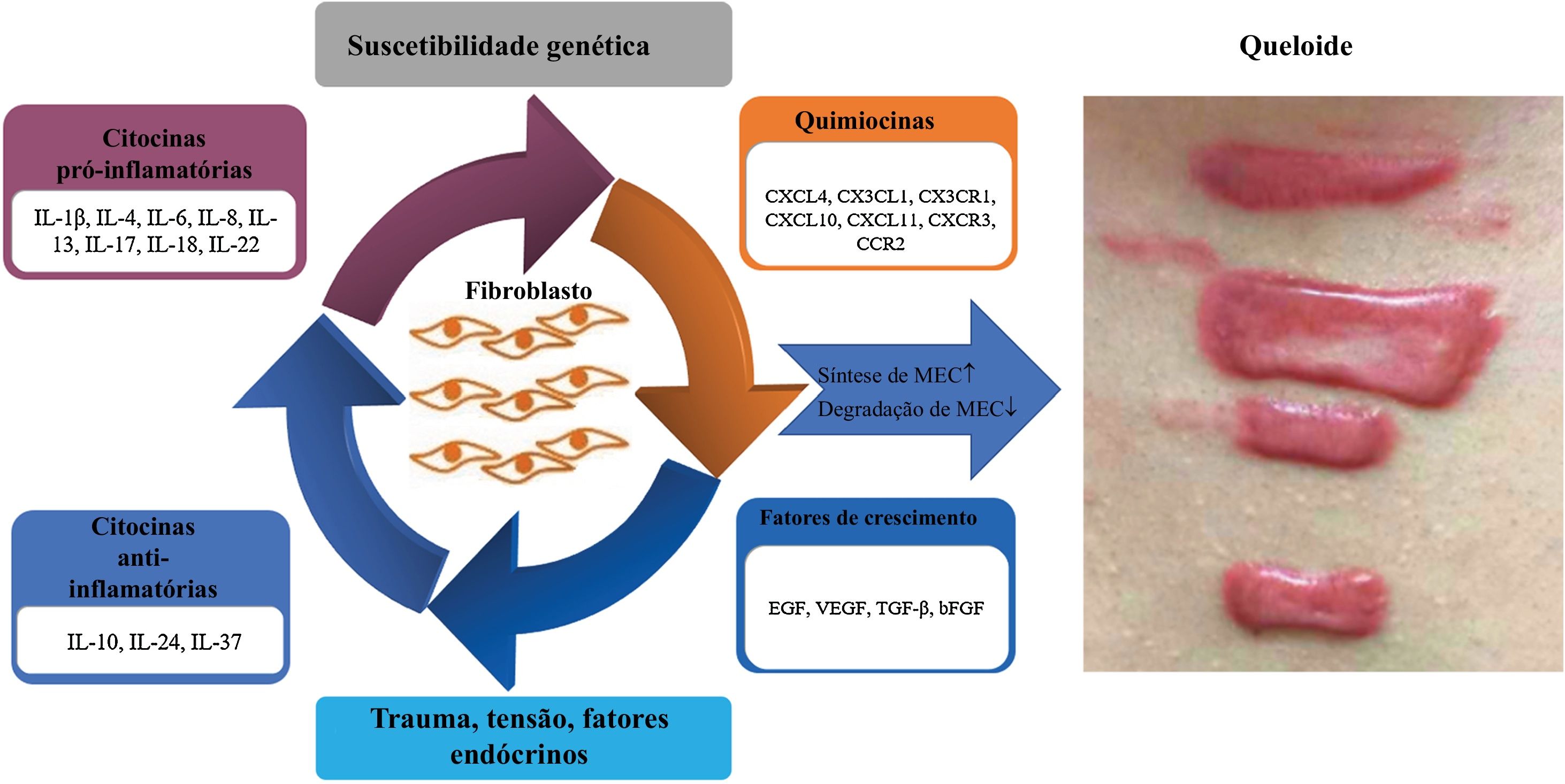
Queloide é doença fibrótica comum, de difícil tratamento, que muitas vezes causa prurido e dor, o que atrapalha muito o trabalho e a vida dos pacientes e traz grandes dificuldades para a interação social. Sua patogênese não é clara, e está relacionada a vários aspectos: suscetibilidade genética, fatores ambientais, imunológicos e endócrinos, trauma e tensão. O aspecto principal de sua patogênese é a proliferação excessiva de fibroblastos, com síntese e secreção excessivas de matriz extracelular, como colágeno. Entretanto, a causa da proliferação e diferenciação excessivas de fibroblastos não é clara. Anormalidades imunológicas podem desempenhar papel importante, com citocinas, quimiocinas, fatores de crescimento e outras moléculas imunológicas importantes atuando nos fibroblastos. Este artigo faz uma revisão bibliográfica detalhada e abrangente sobre o assunto.
Queloide é decorrente de um processo cicatricial excessivo que ocorre após trauma ou sem trauma óbvio. Na histopatologia, o queloide é caracterizado principalmente pela deposição excessiva de matriz extracelular (MEC), composta principalmente de colágeno, que se estende além dos limites do ferimento original e invade o tecido normal circundante. O queloide progride lentamente, muitas vezes acompanhado de prurido ou mesmo dor, mas também compromete a aparência, em geral causando vários obstáculos fisiológicos e psicológicos. Atualmente, o mecanismo exato de formação do queloide não está completamente esclarecido, mas o resultado é a proliferação excessiva de fibroblastos na derme, aumento da síntese e redução da degradação do colágeno e da MEC. O desequilíbrio entre ambos leva ao acúmulo excessivo de colágeno e fibrose. Nesse processo complexo, pode haver participação de tensão, suscetibilidade genética, fatores imunológicos, endócrinos entre outros. Muitos estudos anteriores confirmaram que fatores imunológicos desempenham papel importante na patogênese do queloide, e especialmente citocinas, quimiocinas e fatores de crescimento podem ocasionar alterações funcionais dos fibroblastos e participar da patogênese do queloide agindo sobre os fibroblastos. Este artigo faz uma revisão detalhada e abrangente sobre esse assunto, a fim de encontrar dados sobre os aspectos imunológicos do queloide. Foi realizada uma busca da literatura relevante na base de dados PubMed nos últimos 20 anos, utilizando palavras‐chave como “queloides e citocinas, quimiocinas, fatores de crescimento”. Toda a literatura recuperada foi organizada sistematicamente para esta revisão.
Citocinas pró‐inflamatóriasIL‐1βA interleucina‐1 (IL‐1), também conhecida como fator estimulante de linfócitos, tem duas formas: IL‐1α e IL‐1β, que são produzidas principalmente por macrófagos/monócitos.1 O mediador pró‐inflamatório IL‐1 desempenha papel importante no estágio inicial da formação da cicatriz. A IL‐1 é liberada após uma lesão cutânea,2 que é conhecida por ativar fibroblastos3 e estimular a produção de prostaglandina E2 (PGE2) em fibroblastos humanos.4 A PGE2 é importante produto eicosanoide de fibroblastos, que demonstrou diminuir a proliferação de fibroblastos e reduzir os níveis de colágeno ao inibir sua síntese e promover sua degradação.5 A IL‐1β estimula a produção de PGE2 por fibroblastos normais e fibroblastos derivados de queloides. Um estudo mostrou produção reduzida de PGE2 por fibroblastos de queloides (FQs) estimulados por IL‐1β em comparação com fibroblastos de controle. Nesse estudo, embora sem significância estatística, a IL‐1β induziu maior produção de metaloproteinase‐1da matriz (MMP‐1) por fibroblastos de pele cultivados derivados de controles normais em comparação com a produção por fibroblastos de pele derivados de queloides. Como a PGE2 pode aumentar a expressão de MMP‐1 induzida por IL‐1β,6 uma diminuição na produção de PGE2 por fibroblastos derivados de queloides pode ter implicações na diminuição da produção de MMP‐1 por FQs, o que pode contribuir para o acúmulo de matriz extracelular que ocorre no queloide. Investigações sobre a diminuição da produção de PGE2 e MMP‐1 por fibroblastos derivados de queloides estimulados por IL‐1 podem fornecer mais informações sobre os fatores que contribuem para a formação de queloides.
IL‐4Pesquisas demonstraram que a IL‐4 é importante citocina profibrótica que estimula a síntese de colágeno pelos fibroblastos.7–9 Fibroblastos dérmicos humanos in vitro estimulados pela IL‐4 sintetizam um aumento dose‐dependente em mRNAs pré‐colágeno, resultando em níveis elevados de colágeno tipo I e III e fibronectina, neutralizado por anticorpos anti‐IL‐4. A IL‐4 é fortemente expressa durante as fases iniciais da cicatrização normal de feridas na pele de camundongos e diminui após o fechamento da ferida.10 A aplicação tópica de IL‐4 exógena em feridas cutâneas na fase aguda em camundongos induz aumento significante na formação de tecido fibrótico, enquanto a administração de oligonucleotídeos antisense de IL‐4 atrasa a cicatrização de feridas.10 A superexpressão de IL‐4 em camundongos transgênicos resulta na proliferação de fibroblastos e aumento da deposição focal de colágeno na derme.11 A expressão de IL‐4 foi significantemente diferente em pacientes com histórico familiar de queloides e naqueles com queloides esporádicos. A alta expressão de IL‐4 no grupo com histórico familiar pode ser de importância fundamental para explicar por que os queloides ocorrem em famílias.12 O sequenciamento de RNA do transcriptoma em queloides mostrou regulação positiva significante de IL‐4R em comparação com a pele saudável. Na imuno‐histoquímica observou‐se aumento da infiltração de células α+ de IL‐4r no tecido queloide.13
IL‐6Muitos estudos demonstraram que a IL‐6 desempenha papel importante na patogênese de lesões fibroproliferativas que produzem colágeno. A IL‐6 produzida por fibroblastos foi associada à patogênese da fibrose na cicatrização anormal de feridas, como o queloide.14 A análise global da expressão gênica de FQs revelou o envolvimento da via da IL‐6.15 Ghazizadeh et al. exploraram em seus estudos os patomecanismos dos queloides com foco na via de sinalização da IL‐6.16,17 A IL‐6 e seus receptores foram significantemente maiores em FQs, com um aumento concomitante na biossíntese de colágeno. Anticorpos anti‐IL‐6 ou o bloqueio dos receptores da IL‐6 provocam síntese reduzida de colágeno, sugerindo um papel para a IL‐6 na regulação da expressão do gene do colágeno. As expressões de mRNA e proteína gp130 e vários alvos downstream na sinalização da IL‐6 eram reguladas positivamente em FQs. Outras pesquisas mostraram que os níveis séricos de IL‐6 eram significantemente maiores em pacientes com queloides.18 Os níveis séricos mais elevados de IL‐6 foram associados ao genótipo GG, que foi significantemente maior em pacientes com queloides e aumentou o risco de seu desenvolvimento. Um estudo japonês mostrou a presença do polimorfismo da IL‐6 e a suscetibilidade à formação de queloides em uma população japonesa.19 Essa descoberta sugere que o polimorfismo IL‐6 ‐572G/C está significantemente associado à suscetibilidade para formação de queloides e sua gravidade, fornecendo assim informações sobre estratégias para previsão e prevenção da formação de queloides. Do mesmo modo, outro estudo chinês também descobriu que o polimorfismo IL‐6 ‐572C>G estava intimamente associado à incidência de queloides.20 Essas observações indicam que a sinalização da IL‐6 pode desempenhar papel fundamental na patogênese do queloide e fornecer pistas para o desenvolvimento de estratégias de bloqueio do receptor de IL‐6 para terapia ou profilaxia de cicatrizes queloides.
IL‐8A IL‐8 envolvida no desenvolvimento de queloides e na modulação de sua expressão pode ser valiosa no tratamento de longo prazo de queloides. Pacientes com queloides têm contagens mais elevadas de células progenitoras endoteliais no sangue periférico e células CD34+ com função vasculogênica e angiogênica normais que superexpressam o fator de crescimento endotelial vascular (VEGF, do inglês vascular endothelial growth factor) e a IL‐8.21 Os dados coletados mostraram aumento robusto na expressão do gene IL‐8 em células CD34+, o que foi consistente com o aumento da atividade do gene VEGF nessas células. O efeito pode ser recíproco com base em observações de que a IL‐8 aumenta o mRNA e a síntese de VEGF. Esses resultados apoiam o papel do fator de crescimento endotelial vascular e da IL‐8 no aumento do recrutamento de células progenitoras endoteliais em pacientes com queloides. A IL‐8 funciona como fator de neovascularização e está envolvida na angiogênese.22 Outro estudo descobriu que a taxa positiva de expressão da IL‐8 e seu escore em queloides eram significantemente maiores do que na pele normal, e a contagem de microvasos nos tecidos com expressão positiva de IL‐8 foi maior do que nos tecidos com expressão negativa de IL‐8. O escore de expressão foi positivamente correlacionado com a contagem de microvasos, sugerindo que fibroblastos e células endoteliais vasculares no queloide sintetizam e secretam IL‐8, promovendo angiogênese e levando à hiperplasia anormal do queloide.23
IL‐13A IL‐13 é citocina de quatro hélices localizada adjacente à IL‐4 no cromossomo 5q31. A IL‐13 compartilha várias características estruturais e funcionais com a IL‐4 e tem sido implicada na patogênese de várias doenças caracterizadas por fibrose. A IL‐13 modula a homeostase do colágeno na pele humana e FQs.24 Ao contrário da IL‐4 ou do fator de crescimento transformador‐β (TGF‐β1, do inglês transforming growth factor‐β), a IL‐13 induziu especificamente a expressão do gene procolágeno 3α1 e também induziu uma regulação positiva acentuada do colágeno total e da geração de colágeno tipo I a partir de FQs. A IL‐13 foi equipotente com a IL‐4 e TGF‐β1 nessa capacidade. A IL‐13 pode inibir a degradação do colágeno por meio da inibição de MMP‐1 e MMP‐3, da promoção do inibidor tecidual de metaloproteinase (TIMP‐1, do inglês tissue inhibitor of metalloproteinase), aumentando a deposição de colágeno. Em cicatrizes anormais, a IL‐4 e a IL‐13 induzem a secreção de periostina, que por sua vez induz a secreção de TGF‐β1 pela via RhoA/ROCK.25 O TGF‐β1 então induz mais produção e secreção de periostina, e a periostina e o TGF‐β1 cooperam para promover a fibrose da pele em um círculo vicioso. Essas descobertas sugeriram que a inibição de IL‐4/IL‐13 e da via RhoA/ROCK podem ser estratégias terapêuticas potencialmente úteis para reduzir a fibrose cutânea.
IL‐17A IL‐17, uma citocina pró‐inflamatória, é secretada por um subtipo distinto de células T CD4+ ativadas, conhecidas como Th17.26,27 Células‐tronco semelhantes às de tumores derivadas de queloide humano são governadas pelo nicho inflamatório conduzido pelo eixo IL‐17/IL‐6.28 Uma elevação robusta da expressão de IL‐6 e IL‐17 em queloides é confirmada por análises de matriz de citocinas, western blot e ELISA. As funções biológicas alteradas são rigidamente reguladas pelo nicho inflamatório mediado por um eixo de citocina autócrina/parácrina IL‐17/IL‐6.28 Utilizando células precursoras derivadas de queloide transplantadas para o tecido subcutâneo de camundongos imunocomprometidos, um modelo de tumor semelhante a queloide humano que é conduzido pelo nicho inflamatório in vivo permitiu testar o efeito terapêutico antitumoral de anticorpos direcionados a componentes de nicho distintos, especificamente IL‐6 e IL‐17. A IL‐17 induziu o fator‐1 derivado de células estromais e o fator profibrótico em fibroblastos de pele derivados de queloides por meio da via do transdutor de sinal e ativador da transcrição‐3 (STAT3, do inglês signal transducer and activator of transcription‐3).29 Os resultados mostraram que a reação fibrótica e a expressão da citocina pró‐inflamatória IL‐17 foram mais proeminentes na margem de crescimento (área perilesional) do tecido queloide e as células Th17 infiltraram significantemente a área perilesional. Além disso, a IL‐17 aumentou a expressão do fator‐1 derivado de células estromais (SDF‐1, do inglês stromal cell‐derived factor‐1), colágeno e α‐actina de músculo liso (α‐SMA, do inglês α‐smooth muscle actin) em FQs. O estudo demonstrou que aumento local de IL‐17 em tecidos queloides estimula a produção de SDF‐1 em FQs, causando recrutamento adicional de Th17, o que subsequentemente cria um ciclo de feedback positivo.29 Esses achados sugerem que a inibição de STAT3 pode ser usada para tratar cicatrizes queloides, revertendo o ciclo vicioso entre células Th17 e FQs. A IL‐17 induz disfunção de autofagia para promover morte celular inflamatória e fibrose em FQs por meio das vias de sinalização dependentes de STAT3 e fator induzido por hipóxia 1α (HIF‐1α, do inglês hypoxia inducible factor‐1α).30 O defeito na autofagia causado por IL‐17 foi avaliado, e a relação entre autofagia defeituosa e necroptose também foi examinada. A expressão de IL‐17, HIF‐1α e STAT3 estava significantemente aumentada no tecido queloide, e a conversão de autofagossomo em autofagolisossomo era defeituosa em FQs. O tratamento com IL‐17 elevou significantemente a expressão de STAT3 e HIF‐1α em fibroblastos normais e causou autofagia defeituosa, que foi revertida pelo inibidor de HIF‐1α. Além disso, a autofagia defeituosa foi associada ao aumento de necroptose e fibrose. O mapa poligênico de FQs revela alterações genéticas associadas à fibrose na inflamação e nas respostas imunes.31 Esse estudo reforçou o envolvimento de vários subtipos de células imunes e genes em vias de resposta imune relacionadas à fibrose, incluindo a IL‐17.
IL‐18A IL‐18 faz parte das citocinas pró‐inflamatórias, regulando a proliferação de células inflamatórias e sua função de secreção, o que sugere papel importante na inflamação inicial.32 A expressão de IL‐18 foi muito maior nos pacientes com queloide do que no grupo controle normal.33 O sistema IL‐18 desempenha papel importante na patogênese do queloide por meio de interações epiteliais‐mesenquimais.34 Não apenas a expressão de IL‐18, mas a expressão de IL‐18Rα e IL‐18Rβ também estava elevada no tecido queloide em comparação com o tecido cutâneo normal. Estudos sobre a expressão de IL‐18 e seu antagonista, proteína de ligação IL‐18 (IL‐18BP, do inglês IL‐18 binding protein), utilizando um modelo de cocultura, demonstraram desequilíbrio grave de IL‐18 IL‐18BP em coculturas de queratinócitos queloides/FQs com elevação significante de IL‐18 bioativa, enquanto os níveis de IL‐18BP permaneceram os mesmos. A secreção excessiva de IL‐18 madura pela cocultura queloide e o aumento da expressão de IL‐18R em FQs levam à secreção aumentada de componentes de colágeno‐MEC e citocinas profibróticas, como IL‐6 e IL‐8. A adição de inibidores de fosfatidilinositol 3‐quinase (PI3K, do inglês phosphatidylinositol 3‐kinase), proteína quinase ativada por mitógeno (MAPK, do inglês mitogen‐activated protein kinase), proteína de especificidade 1 (Sp1, do inglês specificity protein 1) e o alvo de rapamicina em mamíferos (mTOR, do inglês mammalian target of rapamycin) inibiu a secreção de IL‐18 em coculturas de queloides, sugerindo seu uso clínico potencial no tratamento de queloides.34
IL‐22A IL‐22 é citocina produzida principalmente por células T e células linfoides inatas e tem como alvo principal células não hematopoiéticas, como células epiteliais e fibroblastos. Na pele, a IL‐22 promove a proliferação de queratinócitos e fibroblastos dérmicos,35 desempenha papel importante na cicatrização de feridas e é expressa após queimaduras, estando envolvida na regeneração do tecido.36–38 A sinalização da IL‐22 é ativa em fibroblastos e direciona a expressão de genes da MEC e a diferenciação de miofibroblastos, e esses processos fisiológicos podem se tornar patogênicos se a produção excessiva de matriz destruir a arquitetura normal do tecido e interferir na função do órgão, causando cicatrizes anormais.39 O número de cópias relativas do mRNA da IL‐22 foi significantemente maior em pacientes com queloides.40 Biopsias de cicatrizes normais e queloides foram coletadas e a expressão de mRNA de vários fatores de crescimento e citocinas foi determinada: TGF‐β, fator de crescimento de fibroblastos, IL‐33, IL‐22, arginase‐1, arginase‐2, óxido nítrico sintase induzível, peptídeo intestinal vasoativo e seu receptor. Apenas IL‐22, TGF‐β e arginase‐1 exibiram níveis significantemente mais altos em cicatrizes queloides. A superexpressão de IL‐22, juntamente com outras alterações moleculares, contribui para a cicatrização anormal.
Citocinas anti‐inflamatóriasIL‐10Um estudo mostrou que a expressão de mRNA para IL‐10 foi significantemente menor em queloides.41 As correlações entre colágeno tipo III e IL‐10 foram negativas e significantes. Outro estudo descreveu o efeito terapêutico da IL‐10 em FQs pela supressão da via TGF‐β/small mothers against decapentaplegic (Smad).42 O estudo descobriu que, em comparação com o controle normal, a proliferação de FQs mostrou‐se significantemente suprimida no tratamento com IL‐10 de maneira tempo‐ e dose‐dependente. A expressão de P‐Smad 2/3 e Smad 4 foi cada vez mais regulada negativamente, enquanto Smad 7 foi regulada positivamente com o aumento da concentração de IL‐10. Em contraste, a variação das expressões Smad 2/3 foi pouco influenciada. Além disso, o colágeno tipo I e o colágeno tipo II mostraram‐se significantemente diminuídos após o tratamento com IL‐10. A IL‐10 inibiu a proliferação de FQs e a síntese de colágeno, e a IL‐10 também poderia modular negativamente a via de sinalização TGF‐β/Smad, impedindo a proliferação de FQs e a produção de colágeno.42 Esses dados sugerem que a IL‐10 pode ter um papel potencial no tratamento de queloides.
IL‐24A IL‐24 foi originalmente identificada como molécula supressora de tumor, e então renomeada IL‐24 e classificada como citocina, com base em sua localização cromossômica no locus IL‐10, sua expressão de mRNA em leucócitos e seus elementos de sequência secretora.43 Foi relatado que o gene IL‐24 pode estar envolvido na formação de queloides.44 O nível de mRNA da IL‐24 em FQs era obviamente menor do que na pele normal. A IL‐24 humana mediada por adenovírus suprime seletivamente a proliferação e induz a apoptose em FQs.45 Nesse estudo, o tratamento com o vetor de adenovírus incompetente para replicação carregando o gene IL‐24 suprimiu seletivamente a proliferação e induziu a apoptose em FQs. Outros estudos mostraram que o gene hlL‐24 mediado por lentivírus inibe eficientemente a progressão do ciclo celular, migração e atividade de invasão de FQs.46 Assim, a IL‐24 tem um grande potencial como terapia genética propiciando a melhoria das aplicações terapêuticas para queloides.
IL‐37A IL‐37 é um membro relativamente novo da família IL‐1, descrita como mediador anti‐inflamatório que ocorre em várias doenças inflamatórias autoimunes.47 A IL‐37 foi apresentada como nova citocina anti‐inflamatória com propriedades extracelulares e intracelulares para eventual supressão da inflamação e da imunidade inata.48 A IL‐37 está envolvida em um ciclo de feedback negativo para controlar o excesso de inflamação. Em um estudo, houve correlação negativa entre o nível sérico de IL‐37 e a gravidade do queloide.49 Essa correlação negativa indica que quanto menor o nível sérico de IL‐37, maior a gravidade do queloide. Assim, a IL‐37 pode ter papel na patogênese do queloide em virtude de sua capacidade de suprimir as respostas imunes inflamatórias inatas.
Quimiocinas50As quimiocinas são uma família de pequenas proteínas com tamanho de 8–10 KDa. As quimiocinas foram classificadas em quatro subfamílias principais: quimiocinas C (XCL), CC (CCL), CXC (CXCL) e CX3C (CX3CL). As quimiocinas são nomeadas por sua capacidade de induzir quimiotaxia de células responsivas próximas e desempenham papéis em muitos processos biológicos básicos, como tráfego e homing de leucócitos, desenvolvimento de órgãos, angiogênese, tumorigênese e metástase, inflamação, resposta autoimune e infecção viral.
Dados recentes demonstraram que o recrutamento de subtipos de leucócitos foi rigidamente regulado por quimiocinas durante a cicatrização de feridas.50 Na fase de hemostasia da cicatrização de feridas cutâneas, a CXCL4 parece funcionar neutralizando moléculas semelhantes à heparina na superfície endotelial dos vasos sanguíneos, inibindo assim a atividade local da antitrombina III e promovendo a coagulação.50 Na fase inflamatória da cicatrização de feridas cutâneas, em um modelo murino de pele excisada, tanto a quimiocina de cicatrização de feridas CX3CL1 quanto seu receptor CX3CR1 foram altamente induzidos nas feridas. A CX3CL1 colocalizou‐se com macrófagos e células endoteliais, enquanto o CX3CR1 colocalizou‐se principalmente com macrófagos e fibroblastos.51 A perda da função de CX3CR1 atrasou o fechamento da ferida em camundongos knockout de CX3CR1 e selvagens infundidos com anticorpos neutralizantes anti‐CX3CR1.51 Na fase proliferativa da cicatrização de feridas cutâneas, CXCL11 foi considerada um ligante‐chave no sistema de sinalização CXCR3 para reparo de feridas, promovendo a reepitelização e modulando a maturação da derme superficial.52 A CXCL11 promove simultaneamente a reepitelização como mediador da comunicação epidérmica‐dérmica durante o reparo de feridas.53 Na fase de remodelação da cicatrização de feridas cutâneas, as quimiocinas importantes são CXCL11 produzida por queratinócitos basais e CXCL10 produzida pelo endotélio de vasos neoformados, que interagem com o receptor de quimiocina CXCR3. A estimulação da sinalização de CXCR3 converte fibroblastos de um estado migratório para um estado contrátil após aumento das fibras de colágeno dérmicas maduras, aumenta a migração de queratinócitos pela ativação de m‐calpaína e inibe a migração e proliferação de células endoteliais.54 O sinal de CCR2 foi encontrado em tecidos queloides.55 A CXCL1 estava presente em miofibroblastos e linfócitos em tecidos queloides, correlacionando‐se positivamente com o grau de infiltrado inflamatório nas lesões.56 Os queloides também exibiram imunorreatividade acentuada para o receptor CXCR2 em células endoteliais e infiltrados inflamatórios com imunomarcação esparsa de miofibroblastos.57 Pode‐se inferir que na formação anormal da cicatriz queloide, as quimiocinas derivadas de células que infiltram a derme podem aumentar ainda mais os infiltrados celulares e a liberação de citocinas pró‐inflamatórias ou fibrogênicas, levando à ativação dos fibroblastos.
Fatores de crescimentoOs FQs apresentaram resposta de crescimento significantemente maior ao fator de crescimento epidérmico (EGF, do inglês epidermal growth factor) do que os fibroblastos normais. A produção de propeptídeo carboxiterminal do tipo I de procolágeno foi maior nos FQs do que nos fibroblastos normais.58 O VEGF foi implicado como fator crítico na regulação da angiogênese e inflamação em condições fisiológicas e patológicas e estava regulado positivamente nos FQs em comparação com os fibroblastos normais.59 O VEGF pode ser responsável pelo nível elevado do inibidor do ativador do plasminogênio‐1 por meio da ativação do ERK1/2 nos FQs.60 O TGF‐β está envolvido na inflamação, angiogênese, proliferação de fibroblastos, síntese de colágeno e remodelação da matriz extracelular.61–63 O TGF‐β foi expresso em fibroblastos dérmicos, células inflamatórias e células endoteliais de queloides.64,65 O TGF‐β induz a proteína de ligação ao trato de polipirimidina a alterar a proliferação de fibroblastos e a deposição de fibronectina no queloide.66 O TGF‐β iniciou a transição epitelial‐mesenquimal (TEM) em células epiteliais queloides induzindo a regulação positiva de snail2, e a via de sinalização TGF‐β/Smad 3 estava envolvida na TEM. A TEM pode alterar o fenótipo das células‐tronco epiteliais no queloide. A ativação do fator de transcrição 3 regula o crescimento celular, a apoptose, a invasão e a síntese de colágeno no FQ através da via de sinalização TGF‐β/Smad.67 Pelo contrário, o fator básico de crescimento de fibroblastos (bFGF, do inglês basic fibroblast growth factor) reduziu o queloide e promoveu a cicatrização de feridas ao inibir a via dependente de TGFβ1/Smad.68 O bFGF produziu melhora significante do colágeno e regulou a síntese e degradação da MEC ao interferir na distribuição do colágeno. O bFGF pode ser uma nova ferramenta terapêutica potencial para o tratamento de cicatrizes hipertróficas e queloides. Diferentes tipos de fatores de crescimento desempenham papéis diferentes na formação de queloides, e seus papéis específicos precisam ser mais explorados.
ConclusãoO presente artigo analisa em detalhes os possíveis papéis das citocinas pró‐inflamatórias (IL‐1β, IL‐4, IL‐6, IL‐8, IL‐13, IL‐17, IL‐18, IL‐22), citocinas anti‐inflamatórias (IL‐10, IL‐24, IL‐37), quimiocinas (CXCL4, CX3CL1, CX3CR1, CXCL10, CXCL11, CXCR3, CCR2) e fatores de crescimento (EGF, VEGF, TGF‐β, bFGF) na patogênese do queloide (figs. 1 e 2). No futuro, será possível conduzir pesquisas mais aprofundadas e completas sobre eles, e selecionar fatores mais específicos relacionados à patogênese do queloide, que poderão ser usados como novos alvos terapêuticos para fornecer novas possibilidades para o tratamento do queloide.
Representação esquemática dos principais fatores envolvidos na patogênese do queloide. O desequilíbrio de citocinas pró‐inflamatórias e anti‐inflamatórias existe em todos os estágios da cicatrização de feridas, atuando nos fibroblastos da pele, envolvendo a remodelação do tecido cutâneo, promovendo a formação de queloides graves. As quimiocinas e fatores de crescimento também contribuem para os processos inflamatórios, estimulando a quimiotaxia de células inflamatórias que então secretam citocinas pró‐inflamatórias, estimulam os fibroblastos, criando assim um círculo vicioso que representa um grande desafio no tratamento e na desaceleração da progressão do queloide. bFGF, Fator básico de crescimento de fibroblastos; MEC, matriz extracelular; EGF, fator de crescimento epidérmico; IL, interleucina; TGF‐β, fator de crescimento transformador‐β; VEGF, fator de crescimento endotelial vascular.
Este trabalho recebeu suporte financeiro através de bolsas da National Natural Science Foundation of China (n° 81602747).
Contribuição dos autoresMengguo Liu: Concebeu a ideia da revisão, escreveu, revisou e editou o manuscrito.
Conflito de interessesNenhum.
Como citar este artigo: Liu M. Cytokines, chemokines and growth factors involved in keloids pathogenesis. An Bras Dermatol. 2025;100. https://doi.org/10.1016/j.abd.2024.01.010
Trabalho realizado no Huashan Hospital Affiliated to Fudan University, Xangai, China.